慢病毒介导的CCDC80基因敲除通过降低Aib1表达抑制卵巢癌细胞增殖*
王卓文, 陈子彦, 杨柳青, 胡汉寅, 石子晴, 林仙德, 钱若文轩, 郭燕君,潘巍巍
(嘉兴学院医学院生物教研室,浙江 嘉兴 314001)
CRISPR/Cas9介导的基因组编辑技术发展迅速,在动物模型建立、作物育种、基因治疗和药物开发等不同领域中都得到了广泛应用[1-3]。研究表明,含卷曲螺旋结构域蛋白(coiled-coil domain-containing protein,CCDC)与恶性肿瘤发生密切相关,如CCDC136、CCDC127和CCDC67等[4-6]。Tremblay等[7]研究表明CCDC80在白色脂肪组织中高表达。此外,CCDC80可以抑制结肠癌HCT116细胞克隆形成[8],但在卵巢癌中的作用未见报道。本研究采用慢病毒系统和CRISPR/Cas9基因编辑系统对人卵巢癌ES-2细胞进行基因编辑,获得CCDC80基因敲除的稳定细胞株,初步分析CCDC80基因在卵巢癌ES-2细胞增殖中的作用,为筛选卵巢癌治疗的分子靶点提供参考资料。
材 料 和 方 法
1 主要试剂
感受态大肠杆菌DH5α购自杭州昊鑫生物科技有限公司;退火缓冲液购自碧云天生物技术研究所;Polybrene购自Sigma;PolyJet体外DNA转染试剂购自SignaGen;Annexin V/PI细胞凋亡检测试剂盒购自BD;FBS、DMEM/F12细胞培养液、PBS、 胰蛋白酶和青-链霉素均购自HyClone;cDNA逆转录试剂购自TaKaRa;qPCR试剂盒购自东洋纺;免疫组化试剂盒购自ABC;β-actin、p-ERK、ERK、p-histone H3和AKT抗体购自Cell Signaling Technology;各种II抗购自Jackson Labs。
2 动物和细胞
SPF级雌性裸鼠,6~8周龄,18~20 g, 10只, 购自浙江省实验动物中心(合格证号为20130016009052),饲养在嘉兴学院医学院实验动物中心。ES-2卵巢癌细胞和293T细胞由实验室保存。
3 主要方法
3.1慢病毒介导CRISPR/Cas9-CCDC80基因敲除载体构建 lentiCRISPR v2,psPAX2和pMD2.G质粒由管坤良教授赠送。用于CCDC80基因敲除的sgRNA(CCDC80-1: 5’-GGTGAGAAGGATCACCAG-CG-3’;CCDC80-2: 5’-CCTGGATAGGAAGTTCTCCA-3’)上、下游引物混合物退火体系及退火条件参见碧云天退火缓冲液说明。退火引物的磷酸化:上、下游引物混合液2 μL(100 μmol/L),10×T4连接酶缓冲液 1 μL, T4 PNK 0.5 μL, 无菌水6.5 μL,共10 μL。LentiCRISPR v2 空载体经BsmB Ⅰ酶切,琼脂糖凝胶电泳回收酶切后的空载体,将酶切后的空载与磷酸化处理后的sgRNA连接,同时设置对照,16 ℃,8 h连接过夜。将重组连接产物转化 DH5α感受态细胞,使用试剂盒提取连接后的质粒,将质粒送至上海生物工程科技有限公司测序。
3.2CCDC80基因敲除的卵巢癌细胞筛选 1.5×105293T细胞于6孔板过夜培养,将PolyJet转染试剂与病毒骨架载体、病毒对照载体或CCDC80基因敲除载体混匀,转染到293T细胞中,同时将ES-2细胞(1×105)接种于6孔板,24 h后将293T细胞的病毒上清过滤到ES-2细胞中,病毒感染ES-2细胞24~48 h后加入嘌呤霉素(2 mg/L)筛选阳性表达细胞。
3.3细胞总RNA提取和qPCR 取对照细胞和CCDC80基因敲除细胞,用TRIzol法提取细胞总RNA(具体步骤参见试剂说明)。逆转录cDNA后采用qPCR检测mRNA表达量,以β-actin为内参照,每组设置4个复孔。Apc的上游引物序列为5’-AGCAAGTTGAGGCACTGAAGA-3’,下游引物序列为5’-ACCGCAGTTTTACTCCAGGG-3’;Srpx的上游引物序列为5’-CAGCCGCAGCTTCCCAGATA-3’,下游引物序列为5’-CTCCAGGCCTTGTTGTCCAT-3’; Ppara的上游引物序列为5’-TTCGCCATGCTGTCTTCTGT-3’,下游引物序列为5’-ACGTTTAGAAGGCCAGGACG-3’; Aib1的上游引物序列为5’-GGCCAGTGATTCACG-AAAACG-3’,下游引物序列为5’-ACTTTCCTGCTCCCGTCTCC-3’; Htra1的上游引物序列为5’-GGGACTGGTCGTGTTTGTGC-3’,下游引物序列为5’-CATTGACCTTTGGGTGCTGACT-3’; osterix的上游引物序列为5’-TGCCTCCTCAGCTCACCTTC-3’,下游引物序列为5’-GCAGGTATCAGGCACAAGGG-3’;β-actin的上游引物序列为5’-GCTCTTTTCCAGCCTTCCTT-3’,下游引物序列为5’-GTACTTGCGCTCAGGAGGAG-3’;aggrecanase-1的上游引物序列为5’-TGCCGCTTCATCACTGA-3’,下游引物序列为5’-CAATGGAGCCTCTGGTTTGTC-3’。
3.4Western blot实验 取对照细胞和基因敲除细胞,提取细胞总蛋白,进行蛋白定量,取20 μg 总蛋白行8% SDS-PAGE, 转至PVDF膜上, 5%脱脂奶粉室温封闭1 h, 分别孵育抗β-actin(1 ∶1 000)、 ERK (1∶1 000)、 p-ERK(1∶1 000)、 p-histone H3(1∶1 000)和 AKT抗体4 ℃过夜, PBST洗膜, 5 min,HRP标记II抗室温孵育1 h, PBST洗膜,5 min,ECL 化学发光试剂盒暗房显影。
3.5Annexin V/PI染色检测细胞凋亡 将对照细胞和基因敲除组细胞过夜培养,收集细胞, 用预冷1×PBS洗涤2次, 1×Binding buffer 重悬细胞。设置空白对照、单染对照和双染检测组。应用流式细胞术检测细胞凋亡,操作步骤按照试剂说明。
3.6软琼脂克隆形成实验 配制底层胶0.5W/Vagar于6孔板,室温静置15 min待胶凝固,配制顶层胶0.35W/Vagar,将对照细胞与基因敲除细胞与顶层胶混合,接种于6孔板,细胞数为每孔3 000。室温静置20 min待胶凝固,放入2 mL新鲜培养液于顶层胶上,37 ℃、5% CO2培养14~20 d,用台盼蓝染色后计算克隆数, 每组设3个重复,实验重复3次。
3.7细胞划痕实验 将对照细胞与基因敲除的卵巢癌细胞接种于6孔板过夜培养,用200 μL吸头在培养皿表面划过,在6孔板中形成划痕,换无血清培养液,分别在划痕后0 h、10 h和20 h照相, 观察细胞的迁移。
3.8裸鼠荷瘤模型 6周龄雌性裸鼠10只,SPF级饲养,随机将裸鼠分成2组, 每组各5只。无菌条件下分别给一组裸鼠的背部皮下注射5×105个对照细胞,另一组裸鼠背部注射5×105CCDC80基因敲除细胞,7 d后使用游标卡尺测量肿瘤形成大小,待肿瘤直径≥15 mm时处死裸鼠。裸鼠腹腔注射5-溴-2’-脱氧尿嘧啶核苷(5-bromo-2’-deoxyuridine,BrdU;100 mg/kg),处死裸鼠取出皮下肿瘤组织称重,中性甲醛固定,脱水,石蜡包埋,切片(5 μm厚)。
3.9免疫组化染色 石蜡组织经二甲苯、乙醇脱蜡,水化,3%H2O2避光10 min,0.02 mol/L枸橼酸钠抗原修复,95 ℃ 15 min,室温冷却。M.O.M试剂盒处理按照试剂盒说明操作。ABD试剂盒室温孵育30分钟,PBST洗片,DAB显色,终止,逐级脱水,封片。
4 统计学处理
数据用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法)。GraphPad Prism统计软件作图。以P<0.05为差异有显著性。
结 果
1 慢病毒介导CCDC80基因敲除的ES-2细胞筛选和鉴定
为了研究CCDC80基因在人卵巢癌中的作用,我们分别针对人CCDC80基因第2个外显子和第5个外显子设计了2个不同的敲除序列,构建了CCDC80基因敲除的CRISPR/Cas9慢病毒载体,见图1A、B。质粒测序和琼脂糖凝胶电泳结果显示,Lenti-CCDC80 基因敲除(CCDC80 KO)载体构建成功。通过在293T细胞包装、感染ES-2细胞及嘌呤霉素筛选获得CCDC80基因稳定敲除的卵巢癌细胞pool。利用PCR结合测序方法鉴定,我们比对得出了缺失序列,见图1C。这一结果表明我们成功获得了CCDC80敲除的人卵巢癌ES-2细胞pool。
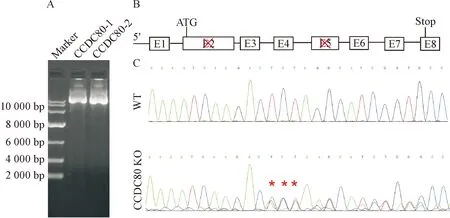
Figure 1.CCDC80deletion in ovarian cancer cells. A: indentification of vector construction; B: diagram showing the strategy ofCCDC80deletion; C: genomic sequencing ofCCDC80deletion in ovarian cancer cells.
图1 卵巢癌细胞中敲除CCDC80基因
2 CCDC80基因敲除抑制卵巢癌细胞的增殖、迁移和克隆形成
在正常培养条件下和血清饥饿条件下,CCDC80基因敲除卵巢癌细胞增殖均显著降低(P<0.01),见图2A。软琼脂克隆形成实验是检测肿瘤细胞增殖活力的有效方法,实验结果表明CCDC80基因敲除显著抑制卵巢癌细胞ES-2的克隆形成能力(P<0.01),见图2B。CCDC80基因敲除显著抑制卵巢癌细胞ES-2的迁移能力(P<0.01),见图2C。
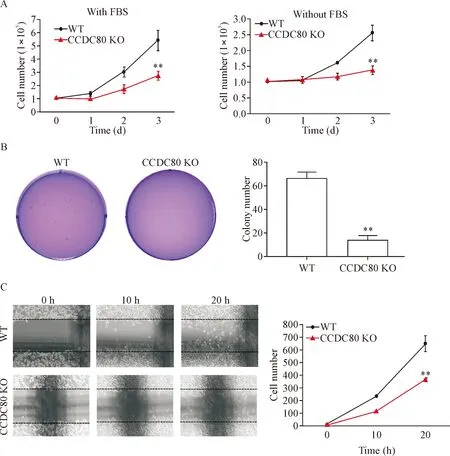
Figure 2.CCDC80deletion inhibited cell proliferation and migration.A:CCDC80deletion inhibited cell proliferation in normal condition and starvation condition; B:CCDC80deletion inhibited cell colony number; C:CCDC80deletion repressed cell migration. Mean±SD.n=3.**P<0.01vsWT group.
图2CCDC80敲除抑制细胞增殖和迁移
3 CCDC80基因敲除促进卵巢癌细胞ES-2凋亡
CCDC80基因敲除后卵巢癌ES-2细胞G1期细胞数显著减少,S期细胞数显著增加(P<0.01),G2期细胞数增加(P<0.05),见图3A。Annexin V/PI染色和流式细胞术结果表明,CCDC80基因敲除后凋亡细胞数达到17.5%,而对照组凋亡细胞数只有6%,两者差异显著(P<0.01),见图3B。
4 CCDC80基因敲除抑制裸鼠体内成瘤
注射对照细胞的裸鼠形成的肿瘤体积是注射CCDC80基因敲除细胞的2倍,实验组和对照组形成的肿瘤体积差异显著(P<0.01),见图4A;免疫组化检测显示CCDC80基因敲除细胞形成的肿瘤组织DNA损伤蛋白p-H2AX高表达,而细胞增殖标志物BrdU低表达,见图4B。
5 CCDC80基因敲除通过抑制Aib1表达和影响MAPK信号通路抑制卵巢癌细胞ES-2增殖
CCDC80基因敲除显著抑制了卵巢癌ES-2细胞Aib1的mRNA表达(P<0.01)。此外,CCDC80基因敲除也显著抑制了aggencanase-1和osterix的mRNA表达量(P<0.01),见图5A。Western blot检测结果显示,CCDC80基因敲除后增殖蛋白p-histone H3表达量显著降低,p-ERK1/2表达量增加,见图5B。
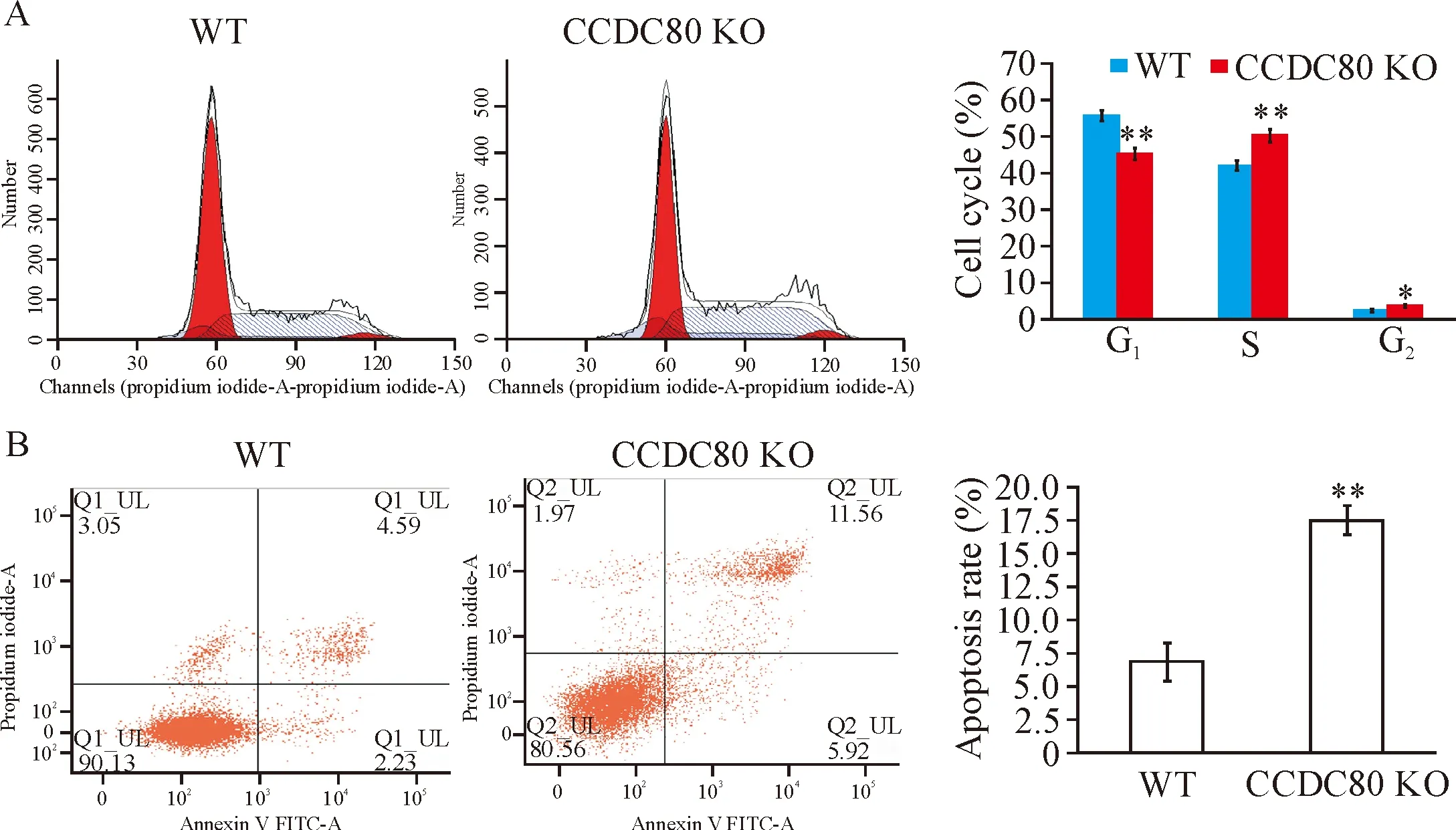
Figure 3.CCDC80deletion promoted the cell apoptosis. A:CCDC80deletion affected cell cycle; B:CCDC80deletion promoted apoptosis. Mean±SD.n=3.*P<0.05,**P<0.01vsWT group.
图3CCDC80敲除促进卵巢癌细胞凋亡
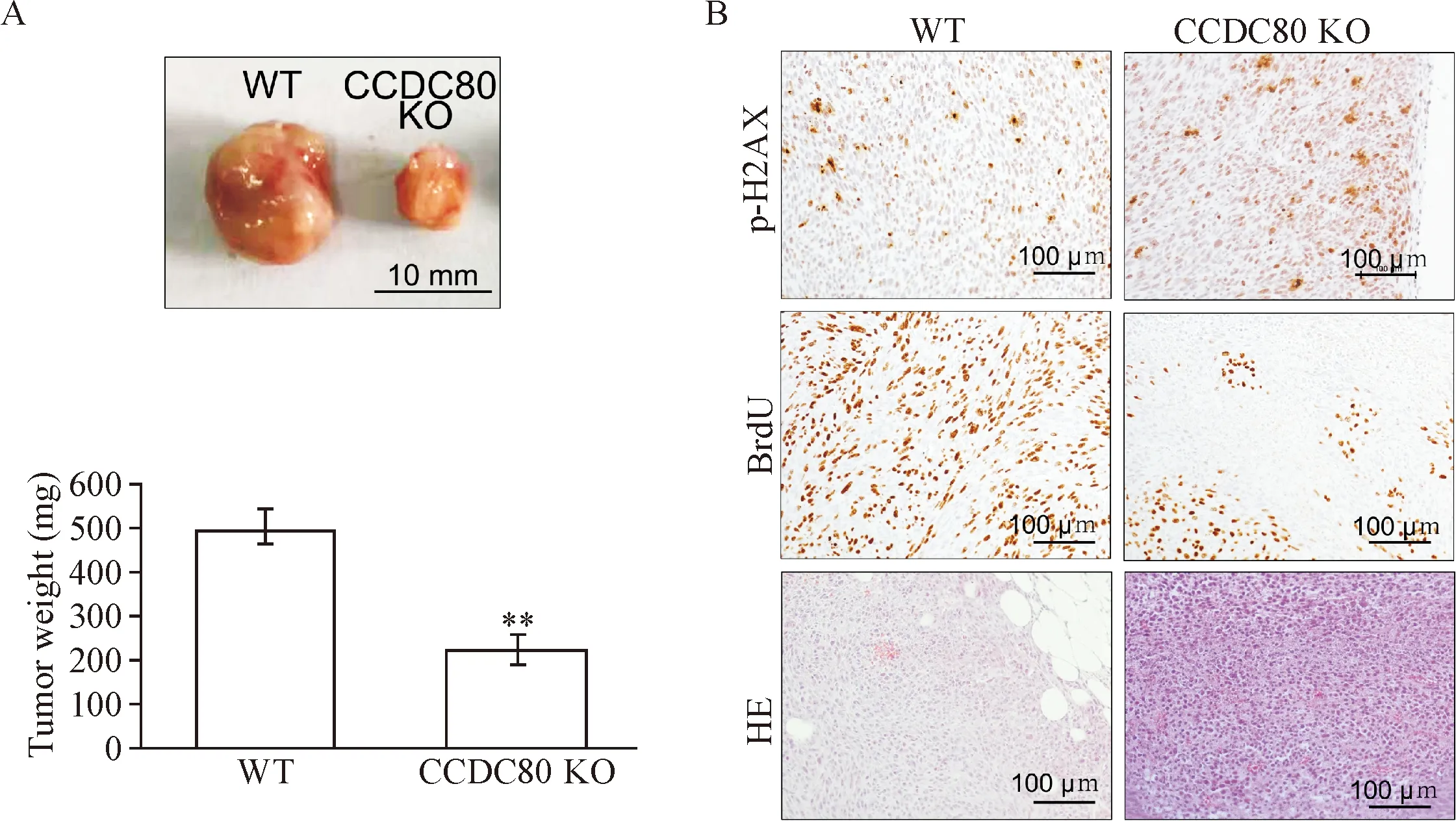
Figure 4.CCDC80deletion repressed cell growthinvivo. A: the tumor size and weight; B: IHC staining for BrdU expression in tumor tissues (×200). Mean±SD.n=3.**P<0.01vsWT group.
图4 在体内CCDC80缺失抑制卵巢癌细胞增殖
讨 论
卵巢癌是女性生殖系统常见的恶性肿瘤,其致死率在所有女性癌症中居于第5位。近年卵巢癌逐渐呈现年轻化趋势,发病率逐年上升,但卵巢癌发生的具体机制并不清楚。因此,寻找新的卵巢癌早期筛选标记分子及基因治疗的分子靶标,成为卵巢癌研究的热点问题。CRISPR与细菌抵抗外源遗传物质入侵的免疫系统有关[9]。近年CRISPR/Cas9基因编辑系统由于其简单高效的敲除特点广泛用于人类疾病动物和细胞模型的研究[10-11]。慢病毒是常用的外源基因体外传递系统,不仅可以高效感染处于分裂期和非分裂期的细胞,还可以将其携带的sgRNA高效整合进宿主细胞基因组中,使得sgRNA可以在细胞内稳定表达,这些优势是其他外源基因传递系统所没有的[12-13]。因此本研究将慢病毒系统与CRISPR/Cas9基因编辑系统结合起来,简单高效敲除人卵巢癌ES-2细胞CCDC80基因。
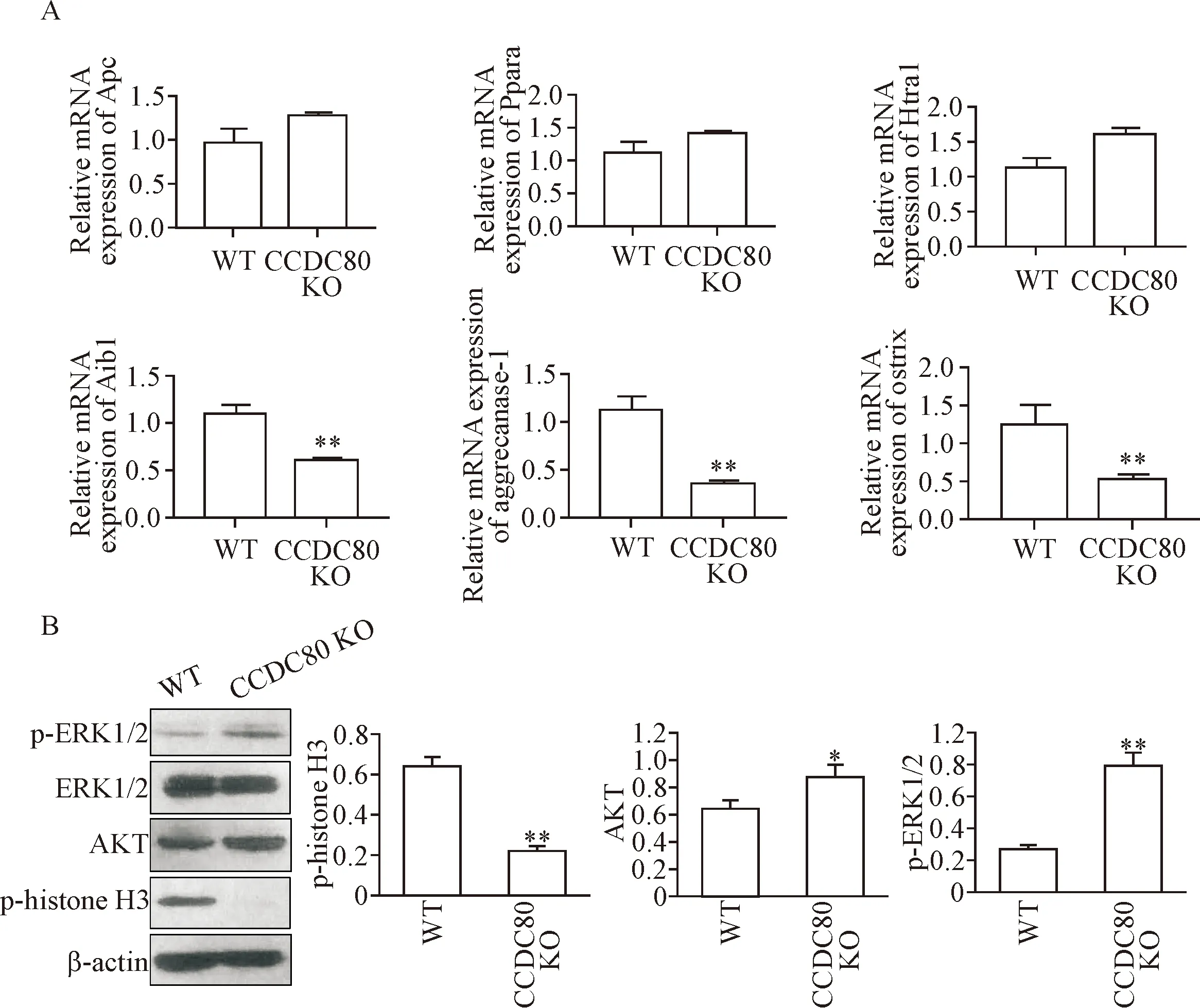
Figure 5.CCDC80deletion decreased Aib1 expression. A:CCDC80deletion decreased Aib1, aggrecanase-1 and osterix mRNA expression. B: p-histone H3, AKT and p-ERK1/2 protein levels detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsWT group.
图5CCDC80敲除抑制Aib1表达
CCDC80蛋白(也称down-regulated by oncogenes 1, DRO1)在甲状腺癌、乳头状癌、胰腺癌和结肠癌细胞系中低表达,而在脂肪组织中高表达[14-15]。研究表明,DRO1参与结肠癌受体介导凋亡途径[8],CCDC80异常表达抑制癌细胞生长,这些结果显示CCDC80作为抑癌基因发挥作用[16]。CCDC80在卵巢癌细胞中的作用至今不清楚。本研究通过慢病毒介导CRISPR/Cas9敲除卵巢癌ES-2细胞的CCDC80基因,结果表明卵巢癌ES-2细胞增殖能力、软琼脂克隆形成能力和迁移能力显著降低。裸鼠荷瘤模型显示CCDC80基因敲除体内也显著抑制ES-2细胞增殖。这些结果提示CCDC80基因在卵巢癌ES-2细胞中可能作为癌基因发挥作用。
为了寻找CCDC80蛋白在卵巢癌细胞中的下游靶基因,查阅文献表明DRO1与Aib1共同参与调节细胞凋亡[17]。Aib1作为核内的转录共激活因子发挥癌基因的作用[18],并且在非肿瘤细胞中Aib1核质间定位与细胞周期有关[19]。qPCR检测显示,在CCDC80基因敲除的卵巢癌ES-2细胞中Aib1 mRNA表达显著降低,提示CCDC80基因敲除抑制了Aib1基因的转录。此外,在CCDC80基因敲除的卵巢癌细胞中p-ERK1/2表达显著增加,说明在卵巢癌细胞中CCDC80基因敲除还可以影响MAPK/ERK信号通路。本研究表明了CCDC80基因在卵巢癌细胞增殖、凋亡和转移中的作用,并且找到了下游的靶基因Aib1,这为寻找卵巢癌治疗的分子靶点提供了参考资料。

