果聚糖蔗糖酶基因的克隆表达及酶学性质分析
徐 君, 张言周, 黎循航,2, 管政兵, 蔡宇杰, 廖祥儒*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江西农业大学 生物科学与工程学院,江西南昌330045)
果聚糖(levan)普遍存在于天然植物中,在植物生长过程中可以储藏能量,参与调节细胞渗透压,提高植物的耐旱能力[1]。许多微生物也可以合成果聚糖,据报道,能合成levan的菌株有很多,如果聚糖微杆菌(Microbacterium laevaniformans)[2]、水生拉恩氏菌 (Rahnella aquatilis)[3]、 枯草芽孢杆菌(Bacillus subtilis)[4]、 地 衣 芽 孢 杆 菌 (Bacillus licheniformis)[5]、 甲 基 营 养 型 芽 孢 杆 菌 (Bacillus Methylotrophicus)[6]。它们合成果聚糖能力不尽相同,且果聚糖相对分子质量也存在差异。据报道,有些细菌来源的levan具有抗病毒、增强免疫力等生理功能[7]。此外,果聚糖还具有热量低、保湿效果好等特点,在食品、化妆品和医药方面都有着广泛的应用[8-10]。
目前合成levan果聚糖的方法有化学合成法[11]、微生物发酵法以及酶催化合成法[7-8]。化学合成法过程较为繁琐,且生成的副产物在后期较难除去。发酵法一般是指微生物利用蔗糖发酵产生levan,但大部分菌株合成levan的能力不高,且底物利用率也比较有限。一般来说,利用果聚糖蔗糖酶(levansucrase,LSase)合成果聚糖的方法较为简单,且能获得较高的底物转化率和levan果聚糖产量。作者通过克隆来源Bacillus amyloliquefaciens H47中的levansucrase基因,在Escherichia coli BL21(DE3)中表达成功,并对重组LSase进行纯化及酶学性质分析。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 Bacillus amyloliquefaciens H47、Escherichia coli(E.coli)JM109、Escherichia coli DH5α、Escherichia coli BL21(DE3)、质粒 pET-28a(+):为作者所在实验室储存。
1.1.2 培养基 LB培养基:tryptone 10 g/L,酵母提取物 5 g/L,NaCl 10 g/L,agar固体培养基 20 g/L,湿热灭菌(121 ℃、20 min)。
LB-卡那霉素(Kana)培养基:LB培养基灭菌后冷却至40~50℃,加入 Kana至终质量浓度为50 μg/mL。
1.1.3 主要试剂 限制性内切酶BamHⅠ、XhoⅠ、T4 DNA连接酶、dNTP Mixture、标准蛋白质Marker和核酸Marker:大连宝生;胶回收试剂盒、质粒抽提试剂盒、DNA提取试剂盒:Takara公司;卡那霉素(Kana)和引物:上海生工。
1.1.4 主要仪器 高效液相色谱仪:HITACHI公司;蛋白质电泳仪、凝胶成像仪:上海生工;AKTA avant蛋白质纯化系统:美国通用公司。
1.2 方法
1.2.1 Levansucrase基因克隆及重组载体构建 依据Bacillus amyloliquefaciens H47全基因组测序结果分析,设计引物序列,levF:5’-GCCGGGATCC ATGAACATCAAAAAATTTGC-3’;levR:5’ -GCCG CTCGAGTTAGTTGTTAACCGT AAGC-3’(下划线部分为BamHI和XhoI酶切位点)。以B.amyloliquefaciens H47基因组DNA为模板进行PCR,产物回收后,将其与pET-28a(+)质粒分别用BamHI和XhoI双酶切,将酶切后的DNA和载体连接,12 h后将连接产物导入E.coli DH5α感受态细胞中,经含有Kana的LB平板筛选阳性转化子,挑取10个转化子转入LB-Kana培养基中过夜培养,提取质粒双酶切验证,并送往公司对目的基因进行测序。
1.2.2 Levansucrase的表达 将测序结果正确的重组质粒 pET-28a(+)-LSase 导入 E.coli BL21(DE3)感受态细胞中,通过LB-Kana平板筛选,挑取3-5个转化子,进行菌落PCR验证,将正确的转化子挑到LB-Kana液体培养基中过夜培养,-80℃甘油管保存。
从甘油管中接3 μL菌液至3 mL的LB-Kana培养基中,37℃、200 r/min培养12 h后,以1 mL的接种量复接到含50 mL LB-Kana培养基中,37℃培养 2 h(OD600约为 0.6),加入 0.4 mmol/L的 IPTG,同时降温至30℃培养,12 h后低温离心收集菌体,并用 20 mmol/L、pH 6.5的 Na2HPO4-NaH2PO4缓冲液将细胞悬浮,对悬浮后的菌液进行破壁,至菌液呈透明状,离心收集上清液和沉淀,经SDS-PAGE检测和酶活测定。
1.2.3 Levansucrase的纯化 将粗酶液过0.22 μm滤膜,选用1 mL HisTrap HP组氨酸标记亲和层析柱(镍柱)进行分离纯化。缓冲液A为含有20 mmol/L咪唑,0.5 mol/L氯化钠的磷酸钠缓冲液(20 mmol/L、pH 7.4)。缓冲液B为含有500 mmol/L咪唑,0.5 mol/L氯化钠的磷酸钠缓冲液(20 mmol/L、pH 7.4)。线性洗脱,先用低浓度咪唑的B将结合在镍柱上的杂蛋白质冲洗下来,再用较高浓度的咪唑洗涤目的蛋白质,收集样品并做SDS-PAGE检测和酶活测定。
1.2.4 Levansucrase酶活测定 用Na2HPO4-NaH2PO4缓冲液(20 mmol/L,pH 6.5)配置 1.2 mol/L的蔗糖溶液作为底物,取0.5 mL蔗糖与0.5 mL酶液,混合均匀后在40℃下反应20 min,以不加酶液的为空白对照,并通过HPLC法检测葡萄糖和果糖的生成量。
果聚糖蔗糖酶酶活定义为:每分钟生成1 μmol葡萄糖所需的酶量为一个酶活力单位(U)。水解酶活定义为:每分钟水解1 μmol果糖所需的酶量。转糖基酶活定义为:每分钟转移1 μmol果糖所需的酶量。
1.2.5 高效液相色谱 反应前后各物质的量通过高效液相色谱 (HPLC)法检测。色谱条件为:HITACHI系列色谱仪,示差检测器,HITACHI LaChrom NH2(250 mm×4.6 mm)色谱柱,粒径5 μm,柱温 30 ℃,流动相为乙腈∶水(70∶30),流速 1 mL/min,进样量 10 μL[12]。
1.2.6 温度和pH对重组LSase酶活的影响 LSase最适温度测定条件为:蔗糖浓度0.6 mol/L、20 mmol/L、pH 6.5的Na2HPO4-NaH2PO4缓冲液。在25~60℃范围内(25,30,35,40,45,50,55,60 ℃)测定 LSase 的酶活力,以确定LSase的最适催化温度。研究过程中,分析了酶在30、40、50℃下的温度稳定性,以处理前的初始酶活力为100%。
LSase最适pH测定条件为:在蔗糖浓度0.6 mol/L、40℃条件下,测定LSase在不同的pH(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)下酶活力的大小 (其中3.0~8.0为Na2HPO4-柠檬酸缓冲液,pH 8.0~9.0为Na2HPO4-KH2PO4缓冲液)。酶pH稳定性测定的前处理条件为:将LSase在上述pH条件下放置12 h后,测定其残余活力。
1.2.7 酶动力学参数测定 酶动力学参数测定条件为:20 mmol/L、pH 6.5 的 Na2HPO4-NaH2PO4缓冲液,底物为蔗糖。底物浓度范围0.025~0.9 mol/L。动力学参数Km和Vmax均采用Lineweaver-Burk方程进行计算。
1.2.8 LSase催化底物反应 将果聚糖蔗糖酶加到200 g/L的蔗糖溶液中,在pH 6.0、40℃条件下进行催化反应12 h后终止反应,并用1.2.5方法分析体系中各物质的量。
2 结果与讨论
2.1 Levansucrase基因的克隆及重组载体的构建
PCR产物经1%的核酸胶电泳,条带显示目的基因大小约为1.5 kb。将重组质粒用BamHI和XhoI进行双酶切验证,结果见图1。两个DNA片段大小约为5.4 kb和1.5 kb,表明目的基因成功插入载体pET-28a(+)上,测序结果也表明重组载体pET-28a-LSase在Escherichia coli中构建成功。

图1 重组质粒pET-28a-LSase的酶切验证Fig.1 Identification of recombinant plasmid of pET-28a-LSase
2.2 重组质粒的诱导表达
重组菌 E.coli BL21(DE3)/pET-28a(+)-LSase经0.4 mmol/L的IPTG诱导12 h后,离心收集菌体。以携带空载体 pET-28a(+)的 E.coli BL21(DE3)为对照组,结果见图2。SDS-PAGE结果显示,经IPTG诱导后的重组菌 E.coli BL21(DE3)/pET-28(a)-LSase,目的蛋白质条带出现在约 52 000(泳道4)处,这与预估的目的蛋白质大小一致,并且在重组菌破碎后的上清液中检测到酶活,而对照组均没有检测到酶活,表明 LSase在E.coli BL21(DE3)中成功表达。

图2 表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressed products
2.3 重组蛋白质的分离纯化
粗酶液经His Trap HP亲和柱纯化后,具有组氨酸标签的LSase能够与镍结合,而其他杂蛋白质被去除,得到的蛋白质相对较纯,结果见图3。

图3 纯化后LSase的SDS-PAGE分析Fig.3 SDS-PAGE analysis of samples from purification
2.4 温度对重组酶活性的影响
2.4.1 最适反应温度 由图4可知,重组酶LSase的水解酶活和转移酶活的最适温度分别在45℃和40℃。不同来源的酶最适温度差别很大,Bacillus sp.TH4-2来源的果聚糖蔗糖酶在60℃时转移酶活性最大[13],而运动发酵单胞菌(Zvmomonas mobilis)的重组酶合成果聚糖 的最适合温度为0℃[14],Microbacterium laevaniformans ATCC 15953所产的酶在30℃时表现出了最大的转移酶活性,而分解酶活性的最适温度在45~50℃[15]。

图4 温度对LSase酶活力的影响Fig.4 Effect of temperature on the activity of LSase
2.4.2 温度稳定性 将LSase置于不同温度(30、40、50℃)下处理,测定其残余酶活,结果见图5-6。表明在30℃下放置12 h后,分解残余酶活为83.07%,转移残余酶活为76.06%,40℃放置12 h后,分解和转移残余酶活分别为74.97%和76.05%,在50℃放置2 h后,分解酶活降低为原来的21.23%,转移酶活为12.46%,而在4 h后,酶几近失活。

图5 温度对LSase水解酶活稳定性的影响Fig.5 Effect of temperature on the hydrolytic stability of LSase

图6 温度对LSase转移酶活稳定性的影响Fig.6 Effect of temperature on the transfructosylation stability of LSase
2.5 pH对重组酶活性的影响
2.5.1 最适反应pH 由图7可知,在pH 6.5时,重组LSase的水解活力最大,而在pH 6.0时转移活力最大。这与已报道的Microbacterium laevaniformans ATCC15953所产酶的最适 pH接近[15]。Lactobacillus sanfranciscensis TMW 1.392的果聚糖蔗糖酶最适pH为5.4,当 pH在 4.4~6.2范围内,酶活在50%以上,但当 pH大于7.0时,该酶的活性则完全被抑制[16]。目前报道的大部分细菌来源的levansucrase最适pH都在5.0~7.0之间[13-16]。
2.5.2 pH稳定性 将重组酶LSase置于不同的pH(4~9)下放置,12 h后测定其残余酶活,结果见图 8。LSase在pH 6.0~7.5时稳定,12 h后其残余酶活仍然高达75%以上。
2.6 果聚糖蔗糖酶动力学参数的测定
实验用 Na2HPO4-NaH2PO4缓冲液 (pH 6.5、20 mmol/L)配置不同浓度的蔗糖溶液,采用1.2.7方法,计算出Km和Vmax分别为150.74 mmol/L和21.23 μmol/(mL·min)。

图7 pH对酶活力的影响Fig.7 Effect of pH on the activity of LSase
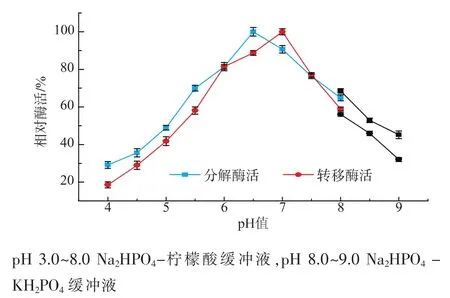
图8 pH对酶稳定性的影响Fig.8 Effect of pH on stability of LSase
不同微生物来源的levansucrase对蔗糖的亲和力差别很大。Leuconostoc mesenteroides B-512 FMC[17]、Rahnella aquatilis[18]、P.syringae[19]和Zymomonas mobilis[20]的果聚糖蔗糖酶的 Km分别为26.6、50、122、160 mmol/L。
2.7 LSase催化反应
以200 g/L蔗糖为底物,在pH 6.0、40℃条件下进行果聚糖蔗糖酶催化反应,12 h后终止反应并对产物进行分析。结果表明,产物中含有葡萄糖、果糖和果聚糖等一系列产物,且体系中的果聚糖质量分数为34.05%,而蔗糖只剩4.31%。
3 结语
将来源于Bacillus amyloliquefaciens H47中的levansucrase基因进行克隆,并实现了在Escherichia coli BL21(DE3)中的异源表达,经镍柱纯化后,对LSase的酶学性质进行了初步探索。研究发现,重组酶LSase的水解酶活和转移酶活最适温度分别为45℃和40℃,在温度低于40℃时,酶活较稳定。最适pH分别为6.5和6.0。在pH 6.0~7.5之间,酶可以较长时间保存。而果聚糖蔗糖酶Km和Vmax分别为 150.74 mmol/L 和 21.23 μmol/(mL·min)。 此外,在pH 6.0、40℃条件下进行酶催化反应,12 h后体系中果聚糖的质量分数达到34.05%。

