红缘拟层孔菌多糖分离纯化、结构表征及其免疫活性分析
彭慧群, 徐小刚, 陈昭月, 王 力, 戴 军*
(1.食品与技术国家重点实验室,江南大学,江苏 无锡 214122;2.东台市济民生物科技有限公司,江苏 东台224221;3.大连王力野生灵芝生物科技有限公司,辽宁 大连116003)
红缘拟层孔菌(Fomitopsis pinicola)是一种药用蘑菇,有待开发利用为食品新资源[1]。红缘拟层孔菌能祛风、除湿,民间用于治疗矿工“寒腿”病;其子实体的水提物具有抑制肿瘤等功效[2]。孙雪[3]等从红缘拟层孔菌发酵产物中提取分离得到了一种单体化合物,并对其进行了抗肿瘤和免疫增强实验的研究,在此基础上研制出了一种抑制肿瘤的保健食品。现代药理学研究证明,该菌水提取物具有抗菌、抗肿瘤、调节中枢神经系统、降血糖、调节人体免疫功能以及抗氧化和清除自由基等作用[4-6]。另外,红缘拟层孔菌具有补益作用、抗炎作用[7]、抑制水肿[8]以及治疗肥胖作用[9],可以运用到新型保健食品中。
目前,文献已报道的关于红缘拟层孔菌多糖的研究主要集中于红缘拟层孔菌子实体提取物的生物活性。而关于从红缘拟层孔菌多糖中分离出多种多糖级分,对其进行免疫活性分析并进行结构表征的报道较少。作者分别以纯水和碱液从中提取得到两类多糖,对纯水提取的多糖进行分离纯化,得到4个多糖级分,并均进行了体外免疫活性的检测和比较,优选出两个级分对其进行结构表征,为后续构效关系研究和开发利用提供了依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 红缘拟层孔菌子实体:大连王力生物科技有限公司提供;三氟乙酸(TFA):>99%,化学纯,国药集团化学试剂有限公司;乙腈:色谱纯,美国Tedia公司;1-苯基-3-甲基-5-吡唑琳酮(PMP):99%,美国 Acros Organics公司;四甲基偶氮唑蓝(MTT):>98%,美国 Biosharp;DMEM 培养液:美国Gibco生命技术公司;曲利本兰(台盼蓝):上海化学试剂采购供应站;氯化铵和乙二胺四乙酸二钠(EDTA-Na2):天津市大茂化学试剂厂;C57雄性小鼠:体重为(20~25 g),苏州艾尔麦科技有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备 高效液相色谱仪:Waters 1525型:安捷伦科技有限公司;冷冻干燥机:SCIENTZ-10N型,宁波新芝生物股份有限公司;多用途水浴恒温振荡器:DSHZ-300型:江苏太仓市实验设备厂;旋转蒸发仪:RE-52A型:上海亚荣生化仪器厂;可见光分光光度计722N型:上海精密科学仪器有限公司;循环水多用真空泵SHK-IIIS型:郑州科泰实验设备有限公司;定时数显恒流泵HL-2D型:上海沪西分析仪器厂。
1.2 试验方法
1.2.1 红缘拟层孔菌子实体多糖的提取 分别采用水提醇沉和碱提醇沉的方法从红缘拟层孔菌子实体中提取得到两种多糖FPS、FPJ。
将粉碎的红缘拟层孔菌子实体用95%的乙醇浸泡过夜,脱脂;在鼓风干燥箱中干燥后,加入料液比为1∶20的蒸馏水中,在100℃水浴中循环提取4~6 h。提取后真空抽滤,滤渣重复提取2~3次。合并提取液,55℃真空旋转蒸发浓缩至小体积,加3倍体积乙醇沉淀过夜,4℃10 000 r/min离心15 min,收集沉淀,经95%乙醇、无水乙醇依次洗涤,真空干燥得FPS[10]。将滤渣置于鼓风干燥箱中干燥8 h,将上述滤渣也真空干燥后加入料液比为1∶20的5%的NaOH溶液中,在60℃水浴中提取2 h,真空抽滤,往提取液中加入2 mol/L HCl中和,4 500 r/min离心15 min,取上清液,后续操作同纯水提取粗多糖,真空干燥得FPJ[11]。
1.2.2 脱色脱蛋白
1)采用大孔吸附树脂进行脱色:5 g D101加入250 mL的三角瓶中,再加入50 mL的5 mg/mL粗多糖溶液,放入恒温摇床中,40℃、140 r/min振荡8 h,过滤备用。
2)采用Sevag法脱蛋白质[12]:往脱色后的多糖溶液中加入 Sevag试剂 (氯仿∶正丁醇=5∶1)(多糖∶Sevag 试剂=5∶1 或者 4∶1)混合,振荡 30 min,静置分层,弃去下层含有白色沉淀有机相,如此重复6次,减压旋蒸浓缩后真空干燥备用。
1.2.3 FPS分离纯化
1)DEAE Sepharose Fast Flow 柱分离分级:称0.3 g经过脱色脱蛋白质的FPS溶于 5 mL、0.02 mol/L Tris[三(羟甲基)胺基甲烷]-HCl缓冲液(pH 7.8)中,通过 DEAE Sepharose Fast Flow 柱(3.5 cm×25 cm)进行分离,前100管用0.02 mol/L Tris-HCl缓冲液等强度洗脱,101~200管用 0.01~1 mol/L NaCl和0.02 mol/L Tris-HCl溶液梯度洗脱。流速:0.8 mL/min。以苯酚硫酸法跟踪检测各管中多糖质量,绘制多糖洗脱曲线并分别收集各多糖级分,用透析袋(相对分子质量3 500)流水透析48 h去除盐离子等小分子物质,真空旋蒸浓缩后冷冻干燥。
2)Sepharose CL-6B柱分离分级:称300 mg经DEAE Sepharose Fast Flow层析柱分离后多糖溶于10 mL 0.9%NaCl中,通过 Sepharose CL-6B(2.6 cm×95 cm)进行分离,洗脱液:0.9%NaCl,流速:0.4 mL/min。以苯酚硫酸法跟踪检测各管中多糖质量,绘制多糖洗脱曲线并分别收集各多糖级分,用透析袋(相对分子质量3 500)流水透析48 h去除盐离子等小分子物质,真空旋蒸浓缩后冷冻干燥。
1.2.4 4个多糖级分体外促进正常小鼠脾淋巴细胞增殖实验 参照文献[13]进行。
1.2.5 高效体积排阻色谱(HPSEC)分析 将不同相对分子质量的葡聚糖标准品及各级分多糖样品配制成约为5 mg/mL的溶液,参考文献[14]中的色谱条件,进样分析。
1.2.6 红缘拟层孔菌各级分多糖的单糖组成分析
1)多糖样品完全酸水解:将级分多糖样品配成5 mg/mL水溶液,参考文献[14]中的实验方法,对级分多糖样品进行酸水解。
2)标样及级分多糖样品的PMP衍生化:取100 μL混合单糖标准水溶液 (各单糖质量浓度为3 mg/mL)和多糖样品酸水解产物,参考文献[14]中的实验方法,对混合单糖标样及级分多糖样品酸水解产物进行PMP衍生化,进样分析。
1.2.7 红外光谱分析 取各级分多糖约1 mg放入研钵中,加入大约以1∶100的比例的溴化钾充分研磨后压片,4 000~400 cm-1区间扫描,扫描32次,分辨率为4 cm-1。
1.2.8 核磁共振分析 称取30 mg样品溶于0.5 mL D2O中,样品质量浓度为60 mg/mL,内标物为DDS,通过核磁共振仪进行13C和1H分析[15]。
2 结果与讨论
2.1 红缘拟层孔菌粗多糖的提取率及多糖质量
初步实验表明,经水提醇沉法所得的粗多糖FPS为棕褐色固体,而经碱提中和醇沉所得的粗多糖FPJ为黑色固体,两者均颜色较深,不易溶于水,需加热搅拌才能溶解,且含有少量不溶物质。不同批次红缘拟层孔菌粗多糖的提取得率及其多糖质量见表1。由表1数据可知,FPJ的得率明显高于FPS,但是FPS的糖质量分数高于FPJ,FPJ中所含杂质较多。
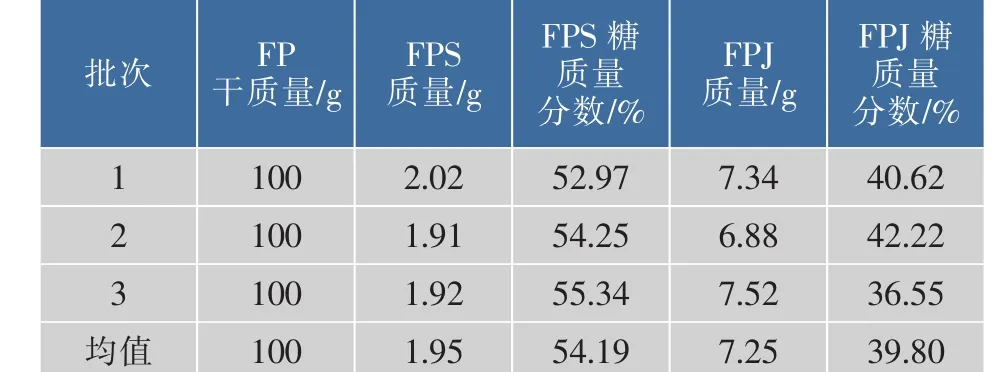
表1 不同批次的FPS和FPJ的提取得率及多糖质量Table 1 Yield and polysaccharide content of FPS and FPJ
2.2 FPS和FPJ脱色脱蛋白质得率及多糖质量
经大孔吸附树脂脱色和Sevag法脱蛋白质后,FPS呈淡灰色,FPJ为深灰色。由于FPJ颜色较深,故对其进行两次脱色。不同批次的FPS和FPJ脱色脱蛋白后得率及多糖质量见表2。由表2可知,经脱色脱蛋白处理,FPJ的损失率远远大于FPS,经处理后FPS的纯度高于FPJ,FPJ还是含有一定量的色素,其脱色后仍为深灰色。
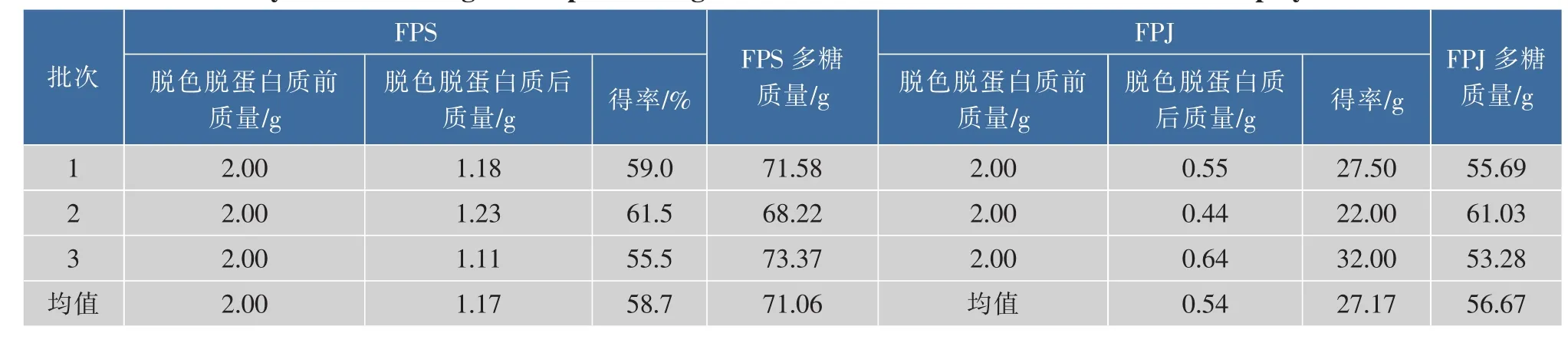
表2 不同批次的FPS和FPJ脱色脱蛋白得率及多糖质量Table 2 Recovery of decolorizing and deproteinzing of different batches FPS and FPJ and their polysaccharide content
2.3 FPS分离分级
2.3.1 DEAE-Sepharose Fast Flow柱分离分级 通过DEAE-Sepharose Fast Flow柱的洗脱液以管数为横坐标,吸光值为纵坐标绘制洗脱曲线,见图1。由洗脱曲线图可知,在1.2.3的分离条件下,FPS的两级分能够很好的分离,按照出峰顺序先后收集得到两个多糖级分分别命名为FPS1、FPS2,两级分透析除盐后冻干供后续实验。
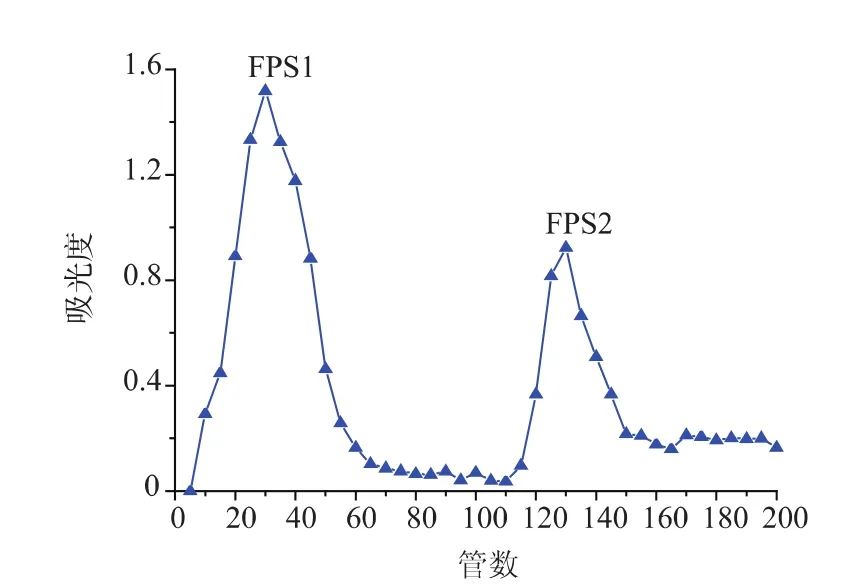
图1 FPS经DEAE Sepharose Fast Flow柱分离的洗脱曲线Fig.1 Elution profile of FPS on DEAE Sepharose Fast Flow column
2.3.2 FPS1、FPS2经Sepharose CL-6B柱分离分级FPS1、FPS2分别通过Sepharose CL-6B柱分离,共得到 4 个级分, 即 FPS1-1、FPS1-2、FPS2-1、FPS2-2,洗脱曲线见图2-3。
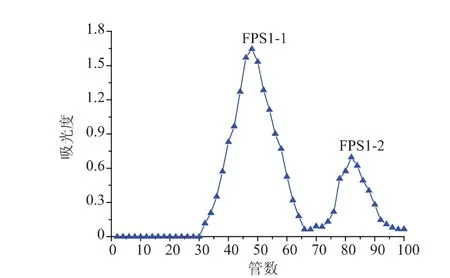
图2 FPS1经Sepharose CL-6B柱分离的洗脱曲线Fig.2 Elution profile of FPS1 on Sepharose CL-6B column
2.4 各多糖级分体外对正常小鼠脾淋巴细胞增殖作用的影响
为进一步考察比较多糖级分FPS1-1、FPS1-2、FPS2-1、FPS2-2 的活性,将 FPS1-1、FPS1-2、FPS2-1、FPS2-2同时进行体外单独促进正常小鼠脾淋巴细胞增殖试验。结果表明:4个级分在质量浓度为20、80、320 μg/mL时均有促脾淋巴细胞增殖活性,且FPS1-2及FPS2-1具有一定量效关系,4个多糖级分中FP2-1的促脾淋巴细胞增殖活性最强,结果见图4。
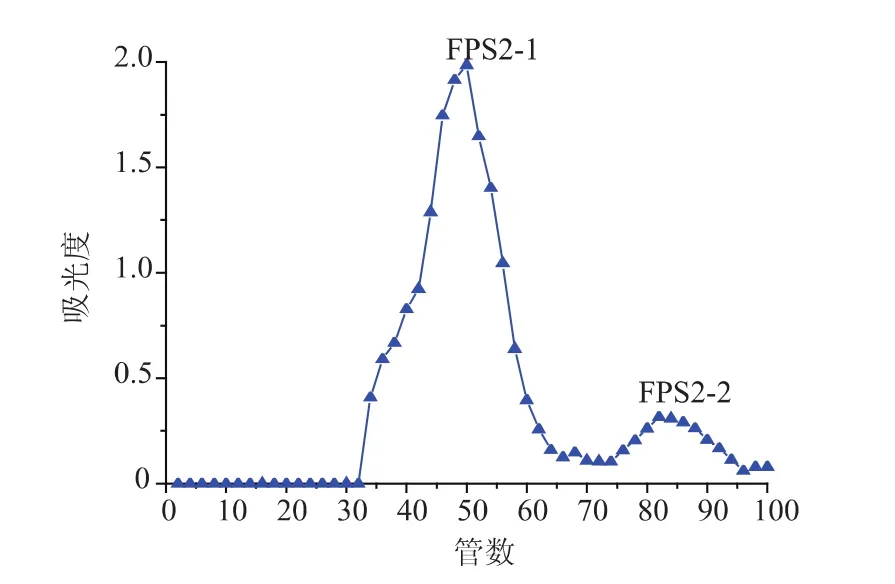
图3 FPS2经Sepharose CL-6B柱分离的洗脱曲线Fig.3 Elution profile of FPS2 on Sepharose CL-6B column
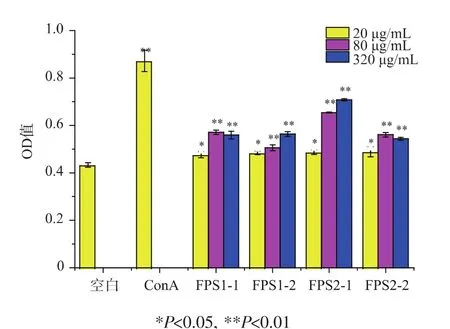
图 4 FPS1-1、FPS1-2、FPS2-1和 FPS2-2体外对正常小鼠脾淋巴细胞增殖作用的影响Fig.4 Effect of FPS1-1,FPS1-2,FPS2-1 and FPS2-2 on the proliferation of splenocytes of normaL mice in vitro
2.5 多糖级分的纯度测定及相对分子质量分布
多糖的生物活性和其相对分子质量大小密切相关。高效体积排阻色谱法(HPSEC)是目前应用较广泛且重复性较好、操作较简便快速的主要分析方法之一[16]。在 1.2.5所述分析条件下,HPSEC测得FPS1-2和FPS2-1的相对分子质量分布色谱图见图5。由图5可知,两级分均为单一对称峰,说明FPS1-2和FPS2-1皆为均一多糖组分。重均相对分子质量分别为 9.10×103和 3.02×105。
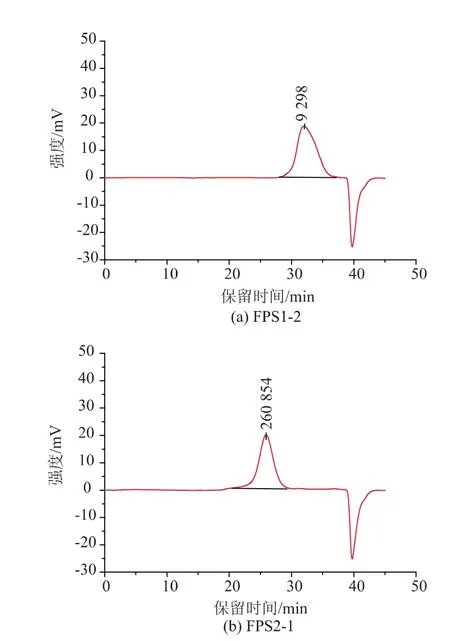
图5 FPS1-2和FPS2-1的HPSEC分析图谱Fig.5 HPSEC profile of FPS1-2 and FPS2-1
2.6 多糖级分的单糖组成
12种单糖标样的PMP衍生化RP-HPLC图谱见图6。由图6可知,在该色谱条件下12个单糖峰的分离效果较好。FPS1-2和FPS2-1完全水解后的PMP衍生化RP-HPLC图谱见图7。对照单糖标准品的保留时间可知,FPS1-2含有5种单糖,分别为甘 露 糖 (Man)、葡 萄 糖 (Glc)、半 乳糖 (Gal)、木 糖(Xyl)、 岩藻糖 (Fuc); 其摩尔百分比 (mol%)为14.88∶12.50∶60.80∶3.18∶8.65;FPS2-1 含有 4 种单糖,分别为甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)、岩藻糖(Fuc),其摩尔百分比(mol%)为 14.48∶37.71∶36.91∶10.90。
2.7 多糖级分红外光谱分析
使用傅立叶变换红外光谱仪检测了FPS1-2和FPS2-1在4 000~400 cm-1之间的红外光谱,结果见图8。两个级分的红外光谱带都具有多糖特征峰,(3 400±15)cm-1处的吸收峰宽且强,是由于多糖的的O-H的伸缩振动;(2 920±15)cm-1附近的中等强度的峰是由于饱和C-H的伸缩振动;(1 640±10)cm-1为酰胺羰基的特征吸收峰;1 411 cm-1处出现的弱峰是由于C-H的变角振动;这些特征峰均为典型的多糖特征峰。FPS1-2的红外光谱图在917 cm-1附近的吸收峰,是D-葡萄吡喃糖β端基差向异构的C-H变角振动,说明FPS1-2的的异头碳构型可能有β型。FPS2-1在840~853 cm-1附近处有一吸收峰,是D-吡喃环α端基差向异构的C-H振动。930 cm-1和761 cm-1附近吸收峰是 D-葡萄吡喃糖的C-O-C骨架非对称和对称伸缩振动,说明FPS2-1的异头碳构型可能有α型[17-20]。
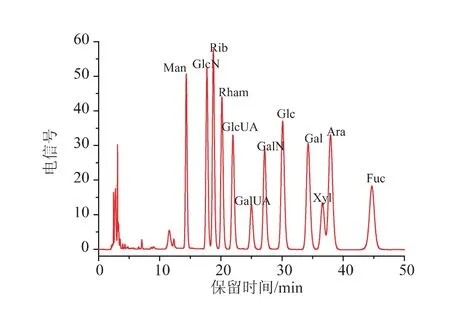
图612 种单糖PMP衍生物的HPLC图谱Fig.6 Chromatograms of PMP derivatives of twelve
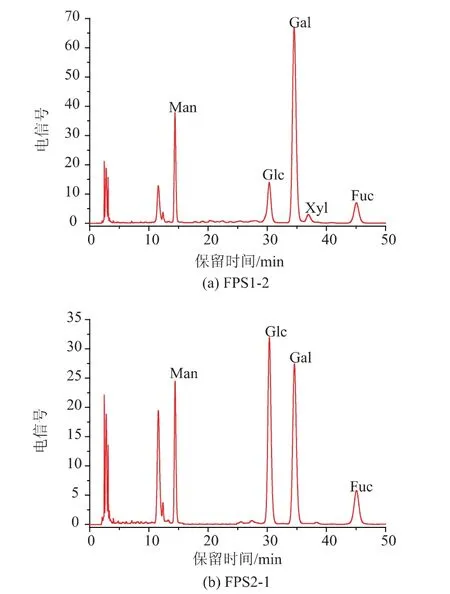
图7 FPS1-2和FPS2-1的PMP衍生物的HPLC图谱Fig.7 Chromatograms of PMP derivatives of FPS1-2 and FPS2-1
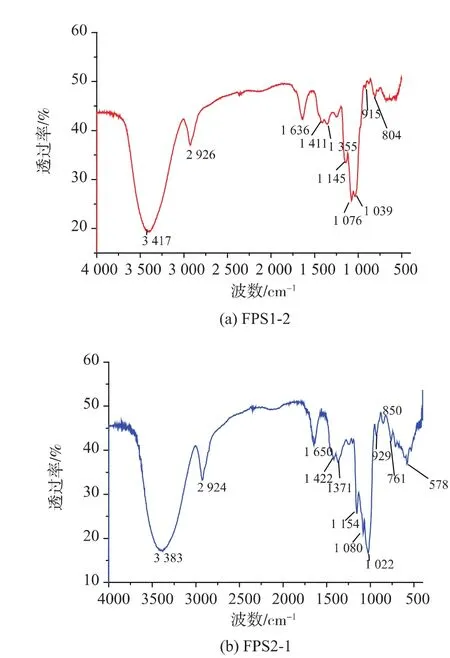
图8 FPS1-2、FPS2-1的红外光谱图Fig.8 Fourier transfrom IR spectrum of FPS1-2 and FPS2-1
2.8 多糖级分核磁共振分析
FPS1-2的1H-NMR谱和13C-NMR谱见图9-12。在1H-NMR图中,内标物的信号在0.33 δ处,故图中放大区域的主要峰信号为 δ 4.98,5.03,5.07,5.12;δ 4.98 为 β 构型异头氢信号,δ 5.03、 5.07、5.12为α构型异头氢信号。13C-NMR图中异头碳区域的主要峰信号为 δ 100.64、103.90、 104.89、105.53;δ 100.64为α构型异头碳信号,较强;δ 103.90、104.89、105.53为β构型异头碳信号,较弱。以上数据说明此多糖的结构重复单元可能主要由4种糖残基组成[21-23]。δ 82~84区域中无信号,说明为吡喃糖;δ 69.30是发生氧取代的C6的信号[24],δ 63.82处为游离C6的信号。所以FPS1-2可能有α-(1→6)糖苷键链接方式。
FPS2-1H-NMR谱和13C-NMR谱的异头区域都只有一个信号峰,说明只有一种α构型的糖残基组成;在1H谱图中异头碳的信号为δ 5.50,是α型吡喃糖的质子信号。13C-NMR谱图中,δ 102.43是α型异头C1的信号;δ 79.77是发生氧取代的C4的信号[25];δ 75.84、74.11、72.83 是 C5、C4、C3 的信号[26];δ 63.30是游离的C6信号。所以FPS2-1可能有α-(1→4)糖苷键链接方式。
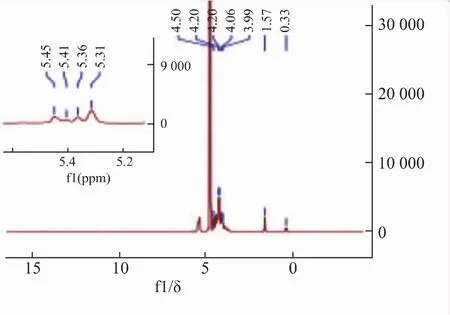
图9 FPS1-2的13H-NMR谱图Fig.9 13H-NMR spectrum of FPS1-2
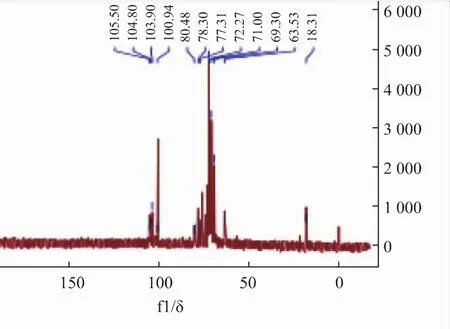
图10 FPS1-2的13C-NMR谱图Fig.10 13C-NMR spectrum of FPS1-2
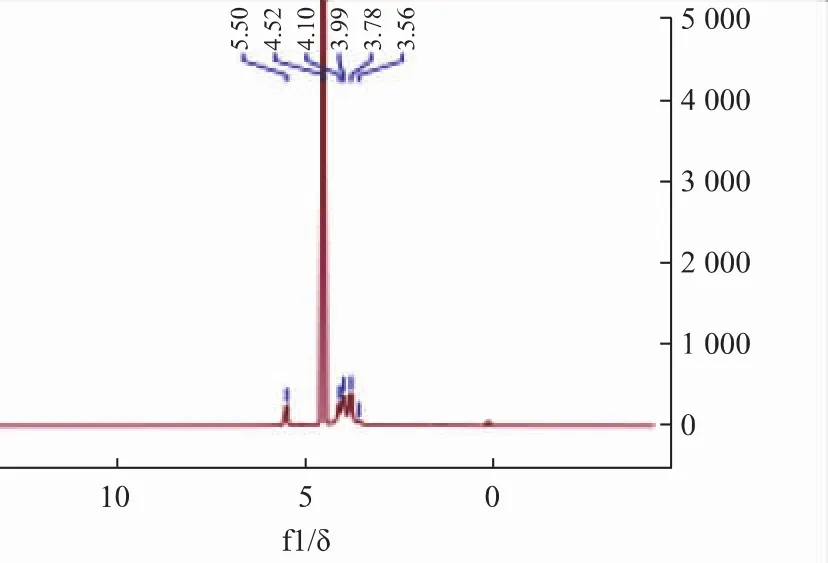
图11 FPS2-1的13H-NMR谱图Fig.11 13H-NMR spectrum of FPS2-1
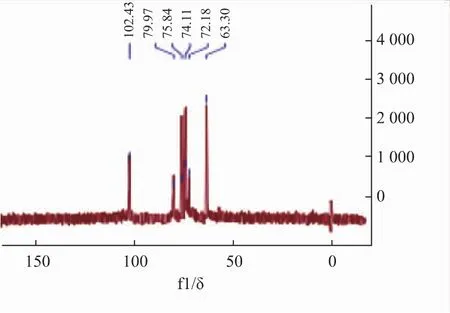
图12 FPS2-1的13C-NMR谱图Fig.12 13C-NMR spectrum of FPS2-1
3 结 语
从红缘拟层孔菌中提取出水提多糖 (FPS),碱提多糖(FPJ)。FPS经进一步分离纯化得到4个多糖级分,对4个多糖级分进行促进正常小鼠脾淋巴细胞的增殖试验。结果表明,四个级分在质量浓度为20、80、320 μg/mL时均有促脾淋巴细胞增殖活性,且 FPS1-2及FPS2-1具有一定量效关系,4个多糖级分中FP2-1的促脾淋巴细胞增殖活性最强。对FPS1-2和FPS2-1进行HPSEC分析,结果表明两个级分均为单一对称峰,说明FPS1-2和FPS2-1皆为均一多糖组分,其重均相对分子质量分别为9.1×103和3.02×105。FPS1-2含有5种单糖,分别为甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)和岩藻糖 (Fuc);FPS2-1含有4种单糖,分别为甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)和岩藻糖(Fuc)。红外、核磁共振的分析结果表明,FPS1-2可能有α-(1→6) 糖苷键链接方式,FPS2-1 可能有 α-(1→4)糖苷键链接方式。

