虫草头孢提取物Fr.8组分对HepG-2胰岛素抵抗的改善作用
韩一凤, 耿 燕*, 孟照敏, 杜 妍, 许泓瑜, 史劲松, 许正宏,2
(1.江南大学 药学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
胰岛素抵抗(Insulin Resistance,IR)是 2型糖尿病的重要发病机制之一[1-3],且伴随疾病产生发展的整个过程,亦常出现于肥胖、高血压、高血脂等代谢疾病中[2-3]。通常表现为胰岛素敏感性下降且胰岛素介导的葡萄糖利用率减弱。IR的发生部位主要有外周组织和肝脏,于外周组织中表现为:在脂肪组织和骨骼肌中,胰岛素促进其摄取、利用及储存葡萄糖的能力减弱;于肝脏中则表现为:胰岛素抑制肝糖输出的能力降低[4],而肝脏在机体的糖、脂代谢调节中起重要作用。肝脏胰岛素抵抗亦是2型糖尿病治疗的重要靶点,因此本实验主要针对肝细胞的胰岛素抵抗进行研究。
据国内外文献报道,虫草头孢(Cephalosporium sinensis)及其菌粉中含有氨基酸 (Amino acid)、腺苷 (Adenosine)、 甘露 醇 (Mannitol)、 虫草多 糖(Polysaccharide)、虫草酸(Cordyceps acid)及虫草素(Cordycepin)[5-6]。现代药理及毒理实验已证明,虫草菌粉提取物在抗菌、抗癌、抗炎、抗肿瘤、降血脂等方面具有独特功效[7],但对于其在改善胰岛素抵抗即减缓2型糖尿病方面的研究甚少[5,7]。
实验前期已从虫草头孢正己烷提取物中经硅胶柱层析分离得到Fraction 8(Fr.8)组分,体外实验初步评价其具有降糖活性。因此,作者以Fr.8组分为研究对象,采用稳定的体外高胰岛素诱导的HepG-2胰岛素抵抗模型评价其降糖活性,检测其作用于此细胞模型后相关基因转录水平及蛋白质表达水平的变化,探讨Fr.8组分具有降糖活性的作用机制,为虫草头孢减缓2型糖尿病的研究提供可靠的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 材料 虫草头孢菌粉:江苏神华药业有限公司提供;HepG-2细胞:江南大学金坚教授实验室馈赠。
1.1.2 试剂 胰岛素:购自阿拉丁;RPMI-1640细胞培养基、胎牛血清(FBS):购自美国Gibco公司;胰酶消化液、双抗 (青霉素-链霉素100×)、10%SDS、1 mol/L Tris-HCl、pH 6.8、1.5 mol/L Tris-HCl,pH 8.8:购自碧云天公司;MTT、葡萄糖检测试剂盒、2-NBDG:购自美国Sigma公司;细胞已糖激酶检测试剂盒、细胞丙酮酸激酶检测试剂盒:购自上海杰美基因科技有限公司;Trizol试剂、SYBR Green Master、蛋白裂解液:购自美国Roche公司;PAMPKα、P-AKT 抗体:购自 Cell Signaling Technology公司;IR、IRS、Glut2抗体:购自Abcam公司。
1.1.3 仪器 中低压柱层析:Grace公司;Multiskan MK3型酶标仪:德国Eppendorf公司;CO2细胞培养箱:Thermo公司;倒置显微镜:Nikon公司;RT-PCR仪、化学发光成像仪:Bio-Rad公司。
1.2 实验方法
1.2.1 Fr.8组分的制备 虫草头孢菌粉(2 kg)与正己烷质量体积比为1∶10浸提12 h后过滤得到澄清的滤液,重复浸提3次收集滤液,将滤液旋转蒸发去除正己烷后得到虫草头孢正己烷提取物103.4 g。通过薄层层析法确定提取虫草头孢正己烷的流动相为正己烷、乙酸乙酯。用40 g硅胶柱,流速20 mL/min,流动相正己烷和乙酸乙酯梯度洗脱,在乙酸乙酯洗脱比例为82%时收集馏分得到Fr.8组分1.29 g。1.2.2 HepG-2细胞培养 根据HepG-2细胞的生长状态,选择含有10%胎牛血清(FBS)及1%抗生素 (100 U/mL青霉素,100 μg/mL链霉素) 的RPMI-1640细胞培养基,置于37℃、5%CO2湿润环境的培养箱中培养细胞,待细胞融合至80%~90%时传代铺板,并选择处于对数生长期的细胞进行相关实验。
1.2.3 高胰岛素诱导的HepG-2胰岛素抵抗细胞模型的建立 选择处于对数生长期的细胞,分别以2×104个/孔和5×105个/孔的密度铺于 96孔板和 6孔板中,24 h后换无FBS培养基饥饿细胞24 h,每孔加含 0、0.01、0.1、1、5、10、50 μmol/L 胰岛素(设有空白细胞对照)的培养基作用于细胞36 h后,换无FBS培养基孵育细胞12 h,96孔板取上清培养液用葡萄糖检测试剂盒测每孔葡萄糖含量,与空白细胞组比较,计算各组的葡萄糖消耗量[8-9];6孔板中的细胞加裂解液后于冰上裂解30 min,用细胞刮将细胞刮下,参照试剂盒说明,根据酶偶联反应比色法定量检测细胞己糖激酶和丙酮酸激酶的活性。
1.2.4 MTT法检测细胞活力 选择处于对数生长期的细胞,以2×104个/孔的密度铺于96孔板,培养24 h 后换含有不同质量浓度 Fr.8 组分(0、12、25、50、100 μg/mL)的培养基孵育细胞24 h (每组6个复孔),弃去培养液,每孔加入含0.5 mg/mL MTT的培养基100 μL孵育4 h后,弃去废液,每孔加150 μL DMSO,用酶标仪在570 nm处测OD值[10]。细胞存活率的计算公式为:
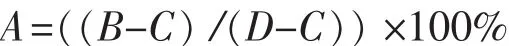
式中:A为细胞存活率,B为药物组OD值,C为空白组OD值,D为对照组OD值。
1.2.5 2-NBDG法测细胞葡萄糖摄取 将处于对数生长期的细胞,以2×104个/孔的密度铺于96孔黑色荧光板,24 h后用DPBS漂洗细胞三遍,换无血清的培养基饥饿细胞24 h,加不同浓度的胰岛素(0、0.01、0.1、1、5、10、50 μmol/L)作用细胞 36 h,每孔加入含终浓度为50 μmol/L的2-NBDG (荧光标记的葡萄糖类似物)[11-12]孵育1 h,DPBS漂洗细胞三遍后,换无血清的培养基于激发波长485 nm,发射波长 530 nm 处测荧光值[11,13]。
1.2.6 实时荧光定量PCR (RT-PCR)法检测相关基因的表达 采用Trizol试剂抽提细胞总RNA,将RNA反转录为cDNA,用SYBRGreen进行荧光定量PCR 反应, 用 2-△△t法[10]对 IR、IRS1、IRS2、Glut2、AMPKα mRNA的转录水平进行相对定量,采用的引物见表1。
1.2.7 蛋白免疫印迹 (Western Blotting)法检测相关蛋白质的表达 用预冷的DPBS漂洗细胞后,每皿加入100 μL蛋白质裂解液 (含蛋白酶及磷酸酶抑制剂),于冰上裂解30~40 min后,用细胞刮将细胞刮下,吹打均匀后收集于1.5 mL离心管中,12 000 g低温离心10 min,将蛋白质上清液移至新的1.5 mL EP管中,用BCA试剂盒测定不同样品的蛋白质质量浓度。经SDS-PAGE电泳后将分布于蛋白胶上的蛋白质湿法转膜至PVDF膜上,封闭后,4℃孵育一抗过夜,TBST洗膜3次后,室温孵育二抗1 h,ECL化学发光底物显色后拍照,用Image J软件分析蛋白质条带的灰度值,定量监测胰岛素抵抗相关蛋白 IR、IRS、Glut2及相关信号通路蛋白 p-AMPKα[14-15]、p-AKT[9,16]的表达。
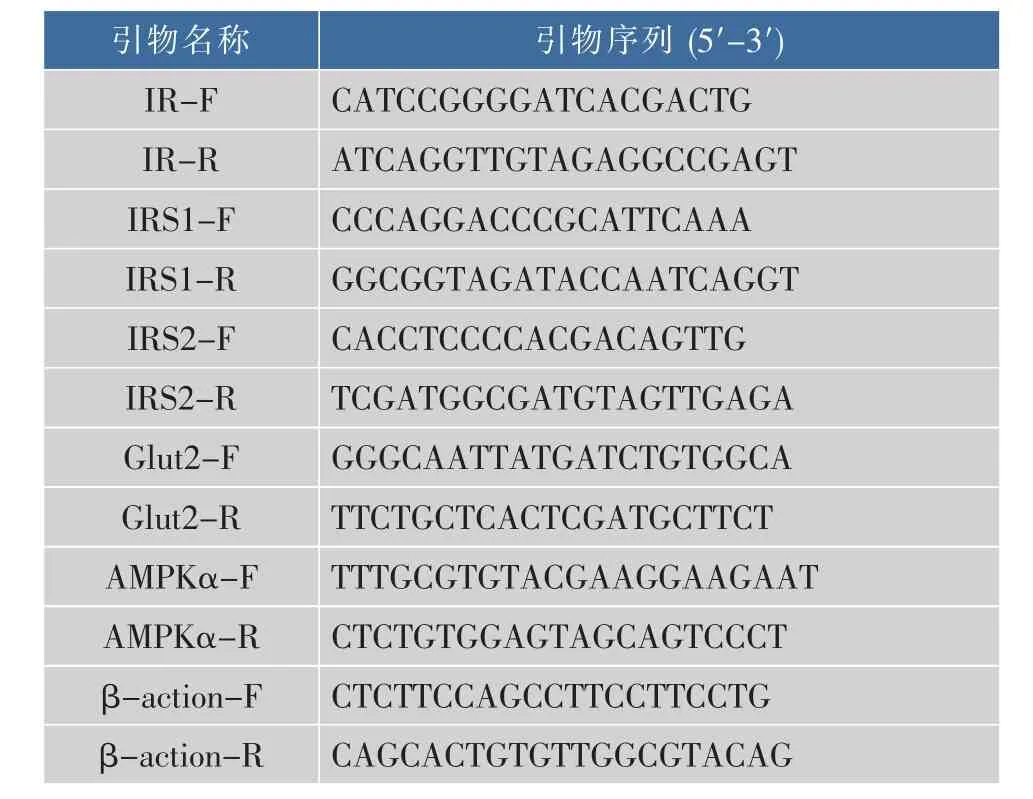
表1 胰岛素抵抗相关基因序列Table 1 Sequences of insulin resistance primers
1.2.8 数据统计 用One-Way ANOVA统计学分析实验结果,每组数据以平均值±标准偏差表示,p<0.05,与对照组相比,极显著水平表示为***p<0.01,与模型组相比,极显著水平表示为###p<0.01[10]。
2 结果与分析
2.1 高胰岛素诱导的HepG-2胰岛素抵抗细胞模型的建立
在无细胞毒性(<5 μmol/L)的胰岛素作用范围见图1(a)。通过检测细胞的葡萄糖消耗量、葡萄糖摄取量两个指标选择建立胰岛素抵抗细胞模型的胰岛素最佳作用剂量,通过检测胞内已糖激酶活性和丙酮酸激酶活性,验证此模型的可靠性。如图1(b)所示,不同浓度胰岛素(0、0.01、0.1、1、5 μmol/L)作用于HepG-2细胞后检测各组细胞的葡萄糖消耗量,5 μmol/L胰岛素诱导的胰岛素抵抗细胞(HepG-2/IR)与对照组细胞相比,葡萄糖消耗量有极显著的降低(***p<0.001);采用2-NBDG法检测各组细胞的葡萄糖摄取量,见图1(c)。5 μmol/L胰岛素诱导的胰岛素抵抗细胞 (HepG-2/IR)与对照组细胞相比,葡萄糖摄取量有极显著的减少 (***p<0.001);用酶偶联反应比色法试剂盒定量检测胰岛素诱导后的胰岛素抵抗细胞 (HepG-2/IR)的胞内已糖激酶活性和丙酮酸激酶活性见图1(d)-(e)。5 μmol/L胰岛素诱导的胰岛素抵抗细胞(HepG-2/IR)与对照组细胞相比,己糖激酶和丙酮酸激酶的活性均显著降低(**p< 0.01);因此,选择 5 μmol/L 胰岛素为HepG-2胰岛素抵抗细胞模型的最佳诱导浓度。
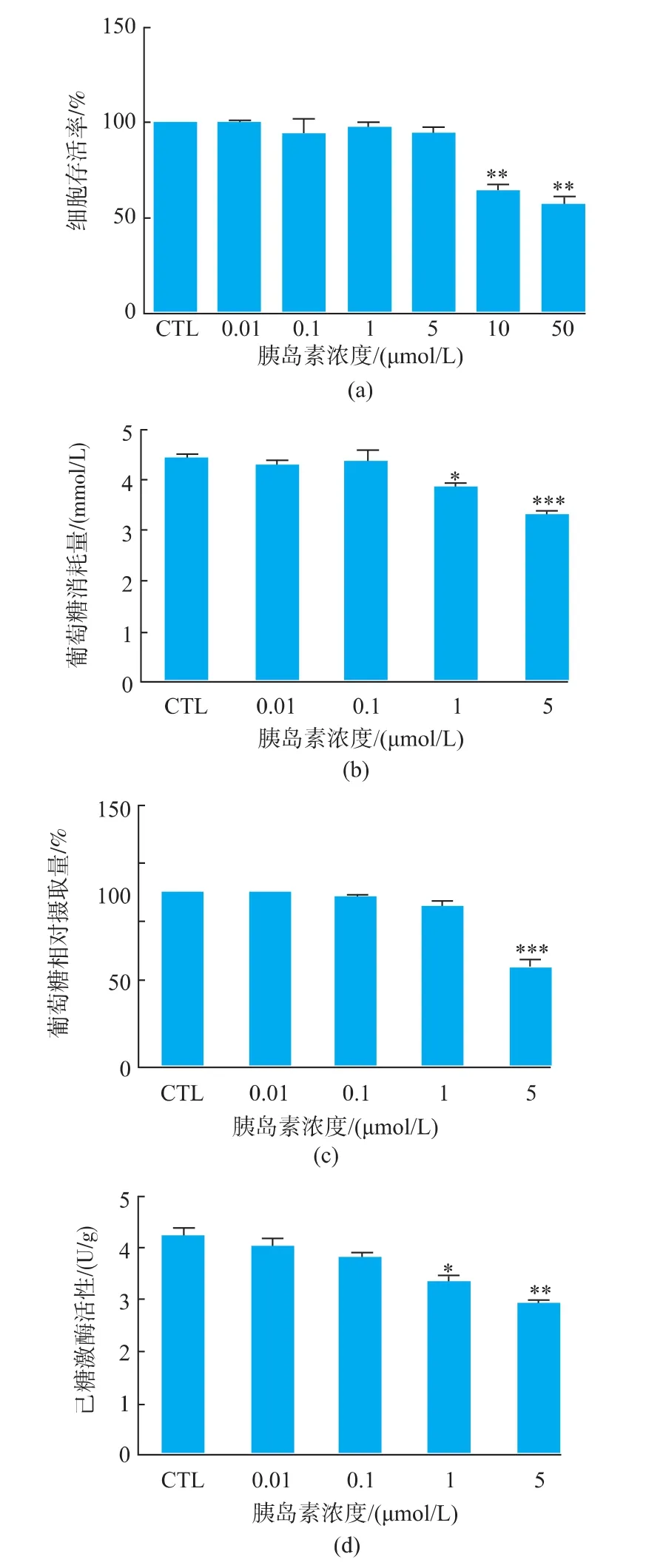
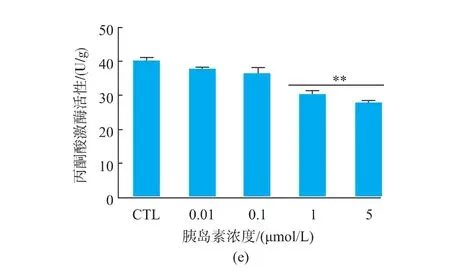
图1 HepG-2胰岛素抵抗细胞模型的建立Fig.1 Establishment of insulin resistance cell model in HepG-2
2.2 Fr.8组分的体外降糖活性评价
2.2.1 Fr.8组分对HepG-2细胞活力的影响 不同质量浓度(0、12、25、50、100 μg/mL) 的 Fr.8 组分作用于HepG-2细胞24 h后,MTT法测各组细胞活力,见图2。不同剂量的Fr.8组分对HepG-2细胞均无毒副作用,Fr.8组分与胰岛素共同作用于细胞后,仅100 μg/mL的Fr.8组分对HepG-2细胞的生长有19%的抑制,可进行后续实验。
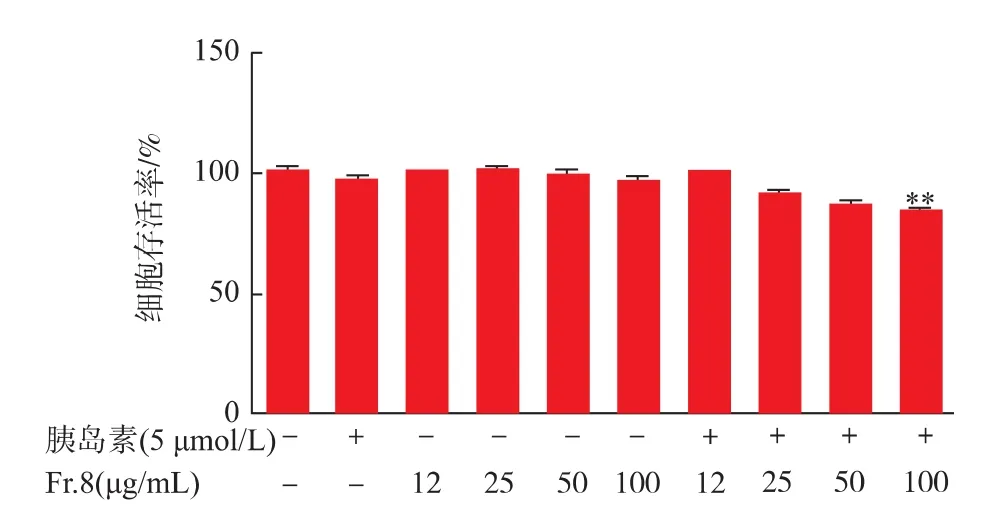
图2 不同质量浓度的Fr.8对HepG-2细胞存活率的作用Fig.2 Effects of different concentrations of Fr.8 on cell viability in HepG-2
2.2.2 Fr.8组分对HepG-2/IR细胞葡萄糖消耗及摄取的影响 不同质量浓度(0、12、25、50、100 μg/mL)的Fr.8组分作用于胰岛素抵抗细胞 (HepG-2/IR)后,通过检测细胞对葡萄糖的消耗量及摄取量变化,评价Fr.8组分于体外细胞具有显著的降糖活性。 如图 3(a)-(b)所示,Fr.8 组分作用于 HepG-2/IR细胞后,细胞对葡萄糖的消耗量及摄取量相比于模型组均显著提高(##p< 0.01,###p< 0.001),且具有明显的剂量依赖关系。
2.3 Fr.8组分改善HepG-2胰岛素抵抗作用机制初步探讨
胰岛素在细胞水平上是通过与靶细胞膜上的特异受体结合而启动的,这一特异受体即胰岛素受体(IR);胰岛素受体底物(IRS)是细胞内胰岛素反应的重要配体,IR可与IRS键合,激活相应的酶体,影响糖脂代谢;葡萄糖转运蛋白2(Glut2)是一种跨膜转运蛋白,主要存在于肝脏和胰腺β细胞膜上,是葡萄糖转运的理想载体;AMPK即AMP依赖的蛋白激酶,是糖脂代谢调节的关键蛋白质,目前也是糖尿病及其他代谢相关疾病的研究核心,其激活能改善由2型糖尿病引起的代谢失衡;AKT激酶是PI3K下游最重要的信号转导蛋白质,分布在肝脏AKT的作用主要是促进糖原合成、抑制糖异生、促进Glut2转位到细胞膜上,调节糖代谢。作者通过检测胰岛素抵抗相关基因转录及蛋白质表达水平的变化,初步探讨Fr.8组分改善HepG-2胰岛素抵抗的作用机理。
2.3.1 Fr.8组分对HepG-2胰岛素抵抗相关基因转录的影响 在基因水平上,采用qRT-PCR技术进一步检测Fr.8组分对于HepG-2胰岛素抵抗相关基因(IR、IRS1、IRS2、Glut2、AMPKα)转录的影响,结果见图4。5 μmol/L胰岛素作用于HepG-2细胞后可显著下调 IR、IRS1、IRS2、Glut2、AMPKα 基因的表达(***p<0.001)。 Fr.8 组分(12、25、50、100 μg/mL)显著上调 Glut2、AMPKα基因的表达 (###p<0.001), 且具有剂量相关性。 50、100 μg/mL的Fr.8组分亦可显著上调IR、IRS1及IRS2的表达(###p<0.001),且具有剂量依赖性。
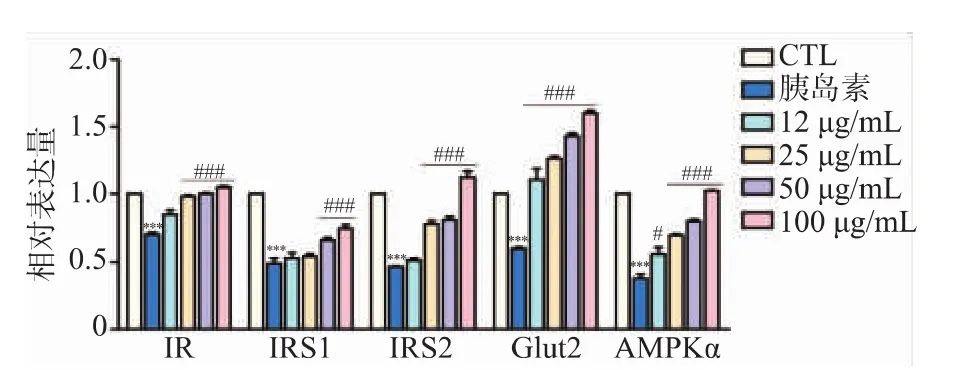
图 4 Fr.8组分对 IR、IRS1、IRS2、Glut2及 AMPKα 基因相对表达量的影响Fig.4 Effect of Fr.2 on the relative expression of IR、IRS1、IRS2、Glut2 and AMPKα mRNA
2.3.2 Fr.8组分对HepG-2胰岛素抵抗相关蛋白质表达的影响 在HepG-2/IR细胞中分别加入质量浓度为 12、25、50、100 μg/mL 的 Fr.8 组分,检测 IR、IRS、Glut2及p-AMPKα、p-AKT的表达情况, 结果见图5(a)。50 μg/mL的Fr.8组分可使IR蛋白质表达上调,与对照组相比提高了66.6%;同样,Fr.8组分有上调IRS表达的作用,且具有良好的剂量依赖关系,见图5(b)。随着Fr.8组分浓度提高,IRS蛋白表达量逐步增加,当Fr.8组分作用质量浓度达到100 μg/mL时,IRS蛋白质表达量提高到最大,与对照组相比提高了60.6%;Glut2占肝细胞葡萄糖载体蛋白的97%以上,Glut2在负责葡萄糖的转运的过程中起到非常重要的作用。如图5(c)所示,HepG-2/IR细胞Glut2的表达量显著下降(**p<0.01),与对照组相比,下调了20.3%,而经Fr.8组分作用后,Glut2的表达则上调8%~37.7%,从而达到改善胰岛素抵抗的效果。 如图 5(d)-(e)所示,模型组磷酸化蛋白p-AMPKα和p-AKT(Ser473)的表达与对照组相比显著降低(***p<0.001),这说明细胞产生胰岛素抵抗后,AMPKα和AKT蛋白质的磷酸化水平下降,而Fr.8组分作用于细胞后,明显提高了AMPKα和AKT(Ser473)磷酸化蛋白质的表达水平(###p< 0.001)。
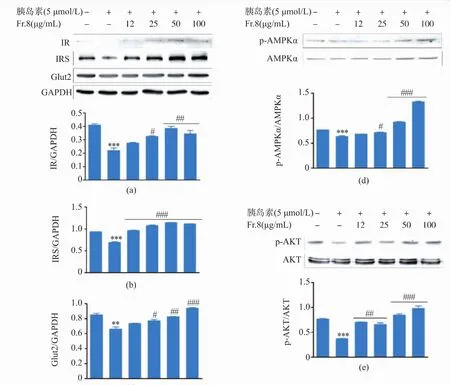
图 5 Fr.8对HepG-2/IR细胞IR、IRS、Glut2、p-AMPKα及p-AKT蛋白质表达的影响Fig.5 Effect of Fr.8 on protein expression of IR、IRS、Glut2、p-AMPKαand p-AKT in HepG-2/IR cells
已有文献报道,虫草头孢及其发酵产物可以改善化学诱导型大鼠糖尿病模型[17],且虫草多糖对于糖尿病的体外及体内治疗已经具有成熟的研究[18-20];而对虫草头孢中小分子化合物治疗糖尿病的研究并不多见,本研究为虫草头孢中小分子化合物治疗糖尿病提供了一定实验依据。研究结果显示,虫草头孢正己烷分离组分Fr.8可通过调节多个相关蛋白质的表达改善HepG-2胰岛素抵抗,这也表明虫草头孢正己烷分离组分Fr.8可能成为治疗糖尿病的潜力药物。
3 结语
2型糖尿病(T2DM)主要表现为胰岛素抵抗或胰岛素分泌不足,而胰岛素必须与受体结合并固定在细胞膜上,才有可能将细胞周围的葡萄糖运送到细胞中,葡萄糖一旦进入细胞,即被细胞所利用。因此,在同等血浆胰岛素水平时,胰岛素受体越多,胰岛素作用能力越强,组织细胞对胰岛素越敏感;反之,当胰岛素受体减少,胰岛素的作用能力会相应减弱,进而组织细胞会对胰岛素产生抵抗作用。
肝脏是糖脂代谢的主要场所,对于维持血糖稳定是必不可少的。因此,肝细胞的糖代谢紊乱对胰岛素抵抗的发生具有十分重要的意义,着重于肝脏胰岛素抵抗的研究具有一定的药理价值。作者采用的HepG-2细胞虽来源于肝癌细胞,但很大程度上保留了肝细胞的许多特性,其表面亦存在胰岛素受体,且受体数目与胰岛素的调节水平息息相关,当胰岛素受体数目减少到一定水平后,细胞就会对胰岛素产生抵抗作用。
作者构建了高胰岛素诱导的HepG-2/IR细胞模型,并运用此模型研究了虫草头孢正己烷提取物Fr.8组分的体外降糖活性。实验证明,Fr.8组分不但可促进HepG-2/IR细胞对葡萄糖的消耗,还可以提高HepG-2/IR细胞对葡萄糖的摄取,从而在一定程度上改善肝脏胰岛素抵抗。研究结果表明,Fr.8组分可使HepG-2/IR细胞对葡萄糖的消耗量和摄取量分别增加70.39%和83.70%。
通过对胰岛素抵抗相关基因转录及蛋白质表达的检测、分析,推测Fr.8组分的降糖活性与上调IR、IRS、Glut2、p-AMPKα 及 p-AKT 的表达有关。研究表明,Fr.8组分可显著增加IR及IRS的表达量,两者键合后再与胰岛素结合并固定在细胞膜上,既直接增强了胰岛素的作用能力,提高了胰岛素的敏感性,又间接维持了细胞周围的葡萄糖稳态。另外,Fr.8组分亦可上调p-AMPKα及p-AKT蛋白质的表达,从而促进Glut2的转位,起到改善2型糖尿病引起的代谢失衡作用。
因此,对虫草头孢提取物Fr.8组分进行体内降糖活性研究及进一步分离纯化,对2型糖尿病治疗药物的筛选意义重大。

