乳酸钠对单增李斯特菌生物被膜形成的抑制作用
付娇娇 , 王 旭 , 刘海泉 , 孙晓红 , 谢 晶 , 潘迎捷 , 赵 勇 *
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
单增李斯特菌(Listeria monocytogenes)是重要的革兰氏阳性食源性致病菌,可引发败血症、胃肠炎和脑膜炎等疾病,被WHO列为关系食品卫生安全的重要病源细菌之一[1]。单增李斯特菌在自然界广泛分布,能在多数固体表面形成生物被膜。细菌生物被膜(Bacterial biofilm,BF)是细菌自身分泌的胞外基质相互粘连形成的,有特定结构和功能的细胞群体[2-3]。自然界中大多数的细菌是以生物被膜状态存在的,细菌处于生物被膜状态可增强细菌对外界不利条件如干燥、极端的温度、抗菌素和消毒剂的抵抗力[4]。因此,在食品生产、加工、运输和保藏过程中,一旦发生细菌感染并形成生物被膜,常规杀菌方法便难以将其彻底清除,这给食品安全造成极大的隐患。可见,寻找如何有效预防和控制食品产业中细菌生物被膜形成的方法已刻不容缓。乳酸钠作为一种天然、无毒、稳定的食品防腐剂,在肉类工业中广泛应用,正越来越受到食品产业的重视[5]。研究表明,乳酸钠对肉及肉类食品中常见腐败菌和致病菌有较强的抑制作用,以延长食品货架期[6]。然而,关于研究乳酸钠对单增李斯特菌生物被膜形成的抑制作用尚未见报道。作者采用结晶紫染色法体外观察不同质量浓度(0、2.5、5、10、20 g/dL)乳酸钠对生物被膜形成的抑制效果,此外,使用实时定量荧光PCR检测与单增李斯特菌生物被膜形成相关基因(motB、mogR、degU、flgE、dnaK、prfA 及 sigB)的表达水平,从而探究乳酸钠对生物被膜形成的抑制作用。本研究为乳酸钠应用于单增李斯特菌生物被膜的预防和控制奠定理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 菌株 单增李斯特菌野生型菌株WaX12由作者所在实验室于生猪肉中分离而得,血清型为1/2a,经过形态学分析、生化特性以及分子生物学鉴定,由上海海洋大学农业部水产品贮藏保鲜质量安全风险评估实验室保藏。
1.1.2 主要试剂和仪器 戊二醛、结晶紫、无水乙醇、磷酸缓冲液(PBS)及98%浓硫酸:均购自上海国药化学试剂有限公司;氯化钾:购自天津市鼎盛鑫化工有限公司;苯酚:购自上海展云化工有限公司;福林-酚、lowry reagent:均购自 Sigma 公司;MTT染料、碘化丙啶PI染料及SYBR GreenⅠ染料:均购自上海索莱宝生物科技有限公司;脑心浸液培养基(BHI培养基)、PALCAM培养基:均购自北京陆桥技术有限责任公司;24孔板、96孔微孔板:均购自Corning公司;动物总RNA快速提取试剂盒(Trizol-离心柱型):购自上海捷瑞生物工程有限公司;FastStart Universal SYBR Green Master(ROX):购自麦约尔生物技术有限公司;PrimeScriptTM RT Reagent Kit,日本TakaRa公司;BioTeK酶标仪:美国柏腾仪器有限公司;离心机、金属浴、PCR扩增仪:美国Eppendorf公司;振荡培养箱:上海知楚仪器有限公司;JYP2-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;LSM710型激光扫描共聚焦显微镜:德国蔡司公司;NOVA NanoSEM230型超高分辨场发射扫描电子显微镜UHR FE-SEM:美国FEI公司;E-1045型离子溅射仪 Ion Sputter:日本Hitachi公司;7500 Fast Real-Time PCR System扩增仪:美国Applied Biosystems公司;BD FASSCalibur流式细胞仪:美国BD公司。
1.2 方法
1.2.1 生物被膜的形成与测定 参照文献[7]的方法并稍作改进。具体步骤:将WaX12菌株在PALCAM选择性培养基平板上划线,37℃静置过夜培养。挑取单菌落至5 mL BHI液体培养基于37℃、180 r/min振荡培养7~8 h至OD600nm为0.6左右。配制终质量浓度分别为 0、2.5、5、10、20 g/dL 乳酸钠的BHI培养基,将菌悬液与培养基按体积比1∶99(将10 μL 菌悬液接种于 990 μL 培养基), 按 1 mL/孔加入24孔细胞培养板中,测定培养48 h形成的生物被膜。24孔板用封口膜封口,防止培养基蒸发。设3个平行样,以无菌BHI为空白对照。培养结束后,小心弃去孔中的培养基,用无菌PBS缓冲液洗涤3次,以除去尚未形成生物被膜的浮游菌体。室温干燥45 min后,向每个样品孔内加入1 mL 0.1%结晶紫溶液,染色30 min。染色结束后,用无菌PBS缓冲液洗涤3次。室温风干后,加入1 mL 95%的乙醇溶液脱色30 min,移取200 μL洗脱液于96孔微孔板,最后用酶标仪检测生物被膜菌的光吸收值(OD600nm)。不同浓度乳酸钠对单增李斯特菌WaX12生物被膜形成的抑制率计算公式:

其中,CV(Cristal violet staining)为结晶紫染色法定量生物被膜的形成量,对照为不添加乳酸钠,x为乳酸钠的质量浓度。
1.2.2 胞外多糖 (Polysaccharide)及胞外蛋白质(Extracellular protein)的测定 菌株按1.2.1培养,测定WaX12菌株在37℃条件下培养48 h的生物被膜胞外多糖及胞外蛋白质的相对含量。参照文献[8]方法并稍作改进。具体步骤如下:培养结束后,首先用酶标仪测定菌液OD595nm的光吸收值。然后小心弃去孔中的培养基,用无菌PBS缓冲液洗涤3次,以除去尚未形成生物被膜的浮游菌体。加入1 mL 0.01 mol/L的氯化钾溶液重悬5 min,然后每个样品孔超声5 s,间隙5 s,循环5次。超声结束后,将菌液转移至1.5 mL无菌离心管内,于4℃条件下,转速为 4 000 g/min,离心 20 min。随后用直径 0.22 μm的滤膜过滤上清液,以除去杂质。
胞外多糖的测定:吸取100 μL滤液于1.5 mL无菌离心管内,加入200 μL 98%的浓硫酸,室温静置30 min。随后加入25 μL 6%的苯酚溶液,置于90℃ 金属浴中,温育5 min。移取200 μL样品于96孔微孔板内,最后用酶标仪检测OD490nm的光吸收值,计算比值OD490nm/OD595nm即为样品多糖相对含量。
胞外蛋白质的测定:吸取40 μL滤液于1.5 mL无菌离心管内,加入 200 μL lowry reagent溶液(lowry法蛋白质浓度测定试剂),室温静置10 min。然后加入20 μL福林-酚溶液,室温静置30 min。移取200 μL样品于96孔微孔板内,最后用酶标仪检测OD750nm的光吸收值,计算比值OD750nm/OD595nm即为样品胞外蛋白质的相对含量。
1.2.3 MTT法检测生物被膜内细菌细胞活性 配制终质量浓度分别为0、5 g/dL乳酸钠的BHI培养基,按1.2.1方法,于37℃下培养48 h形成的生物被膜。参照文献[9]方法并稍作改进。具体步骤如下:先将形成的生物被膜经PBS洗涤3次,以去除未附着的细胞;加入1 mL新鲜BHI培养基和100 μL预先配制的终质量浓度为5 mg/mL MTT染液,于37℃避光温育1 h,然后在通风橱内加入1 mL二甲基亚砜溶解沉淀30 min,最后用酶标仪检测OD570nm的光吸收值。
1.2.4 激光共聚焦显微镜 (Confoeal laser scanning microscopy,CLSM)观察生物被膜结构 配制终质量浓度分别为0 g/dL和5 g/dL乳酸钠的BHI培养基,按1.2.1方法,于37℃培养48 h形成的生物被膜,参照文献[7]方法并稍作改进。具体步骤如下:先将形成的生物被膜经PBS洗涤3次,以去除未附着的细胞;再用4%戊二醛溶液固定30 min,PBS溶液洗涤3 次,然后用预先配制好的 SYBRGreenI(1:500000)染料于暗室中染色30 min,最后用PBS溶液洗涤3次,以除去多余的染料。立即取片,在CLSM下观察。
1.2.5 扫描电镜 (Scanning electron microscopy,SEM)观察生物被膜结构 配制终质量浓度分别为0 g/dL和5 g/dL乳酸钠的BHI培养基,按1.2.1方法,于37℃下培养48 h形成生物被膜,参照文献[7]方法并稍作改进。具体步骤如下:先将形成的生物被膜经PBS洗涤3次,以去除未附着的细胞;再用4%戊二醛溶液固定2 h。固定结束后,分别用体积分数为30%、50%、70%、90%、100%无水乙醇进行梯度脱水 (30%、50%、70%、90%无水乙醇依次脱水一次,每次10 min,100% 无水乙醇脱水2次),于室温下过夜干燥,在SEM下观察。
1.2.6 流式细胞仪(Flow cytometry,FCM)检测生物被膜内细菌细胞膜完整性 配制终质量浓度分别为0 g/dL和5 g/dL乳酸钠的BHI培养基,按1.2.1方法,于37℃下培养48 h形成的生物被膜。参照文献[7]方法并稍作改进。具体步骤如下:先收集生物被膜菌体,用PBS洗涤一次,加入预冷的70%乙醇固定,置于4℃下固定2 h。离心弃去固定液,然后用PBS重悬5 min。重悬结束后,使用400目的筛网过滤一次,之后离心5 min,转速为1 000 r/min,弃去PBS。最后加入终质量浓度为10 μg/mL的PI染液,置于4℃条件下避光染色30 min。染色结束后,立即使用流式细胞仪进行检测。使用FlowJo 7.6软件分析实验结果,分析所得Mean值即为荧光信号强度。
1.2.7 总RNA的提取与反转录cDNA 菌体收集:按1.2.1方法,分别收集WaX12菌株于37℃培养48 h的浮游态菌体和生物被膜态菌体,用于总RNA的提取。RNA提取与反转录cDNA:利用动物总RNA快速提取试剂盒(Trizol-离心柱型)试剂盒操作步骤提取总RNA,贮存在-80℃冰箱。RNA的浓度采用BioTek酶标仪测定,完整性通过1%的琼脂糖凝胶电泳检测。每个样品中200 ng总RNA用于反转录,反转录反应按试剂盒说明书操作,产物cDNA置于-20℃备用。
1.2.8 荧光实时定量PCR(qRT-PCR) 选择了与鞭毛合成及运动相关的基因 flgE、motB、degU及mogR;主要毒力调控因子prfA、热激蛋白转录因子dnaK[10]及主要压力应答因子sigB[11]。引物由上海生工生物有限公司合成,序列见表1。2-ΔΔCT方法用于比较不同样本之间基因的表达量变化。Gap作为管家基因[12]。利用 FastStart Universal SYBR Green Master(ROX)方法进行荧光实时定量PCR。应用7500 Fast Real-Time PCR System扩增仪操作。不含cDNA模板的体系作为阴性对照。做三次独立的实验,每个样品做3个平行。

表1 荧光实时定量RT-PCR基因引物序列Table 1 List of primer sequences used in qRT-PCR
1.3 数据处理
采用Origin 8.0、SPSS17.0软件处理,对相关数据进行统计分析。
2 结果与讨论
2.1 不同质量浓度乳酸钠对单增李斯特菌WaX12生物被膜形成的影响
将不同质量浓度的乳酸钠(0、2.5、5、10、20 g/dL)处理单增李斯特菌WaX12,48 h后采用结晶紫法测定生物被膜的形成情况,结果见图1。结果表明,相比于对照组,质量浓度为2.5、5、10、20 g/dL的乳酸钠对单增李斯特菌WaX12生物被膜的抑制率分别为 8.34%(p<0.05)、32.2%(p<0.01)、46.6%(p<0.01)和55.2%(p<0.01)。可见,乳酸钠可有效抑制单增李斯特菌WaX12生物被膜的形成。

图1 不同质量浓度乳酸钠对单增李斯特菌WaX12生物被膜形成的影响Fig.1 Effets of sodium lactate at different concentrations on L.monocytogenes biofilm formation
2.2 显微镜观察乳酸钠对单增李斯特WaX12生物被膜结构的影响
为进一步研究乳酸钠对单增李斯特菌生物被膜形成的抑制效果,选取5 g/dL乳酸钠处理单增李斯特菌WaX12进行后续研究。首先,利用CLSM与SEM观察其在37℃下培养48 h后的生物被膜结构,结果见图2。观察图2(a)可知,与对照组相比,经5 g/dL乳酸钠处理之后的生物被膜密度显著降低。未经乳酸钠处理的对照组生物被膜的厚度为28.70 μm,而5%乳酸钠处理组生物被膜的厚度显著减少,降至15.19 μm。此外,进一步通过SEM观察WaX12菌株生物被膜的超显微结构,结果发现对照组可形成立体且致密的成熟生物被膜结构,而5 g/dL乳酸钠处理组的生物被膜结构明显变稀疏,由小菌落相互交联而成。以上结果表明,5 g/dL乳酸钠可有效抑制单增李斯特菌WaX12生物被膜的形成,与上述结晶紫定量结果相一致。

图2 显微镜观察5 g/dL乳酸钠对单增李斯特菌WaX12生物被膜结构的影响Fig.2 CLSM and SEM images of biofilms formed by L.monocytogenes with 5%sodium lactate(right) and without(left)
2.3 乳酸钠对单增李斯特菌WaX12生物被膜胞外多糖及胞外蛋白质形成的影响
细菌在形成生物被膜的过程中,其分泌的胞外物质主要为胞外多糖和胞外蛋白质。这些胞外物质不仅能增强微生物细胞对外界环境因素的抵抗能力,而且在细胞初始粘附及维持生物被膜稳定中起着关键作用。因此,研究了5 g/dL乳酸钠对单增李斯特菌WaX12生物被膜胞外多糖及蛋白形成的影响,结果见图3。从图3可以看出,经5 g/dL乳酸钠处理之后,胞外多糖及蛋白质的相对含量均显著降低(p<0.01);与对照组相比,胞外多糖的相对含量降低了33.9%,而胞外蛋白质的相对含量降低了56.1%。可见,乳酸钠对胞外蛋白质形成的抑制效果更明显。综上所述,乳酸钠可有效抑制单增李斯特菌WaX12胞外物质的形成,从而降低了其生物被膜的形成。

图3 乳酸钠质量浓度对单增李斯特菌WaX12生物被膜胞外多糖及蛋白质形成的影响Fig.3 Polysaccharidesand extracelluar proteinsin biofilm of WaX12 with 5%sodium lactate and without
2.4 乳酸钠对单增李斯特菌WaX12生物被膜内细菌细胞活性的影响
利用MTT法检测5%乳酸钠对单增李斯特菌WaX12生物被膜内细菌细胞活性的影响,结果见图4。经5 g/dL乳酸钠处理之后,单增李斯特菌WaX12生物被膜内细菌细胞活性显著降低(p<0.01),且抑制率达到56.4%,可进一步表明其抑制WaX12菌株生物被膜形成的效果显著。
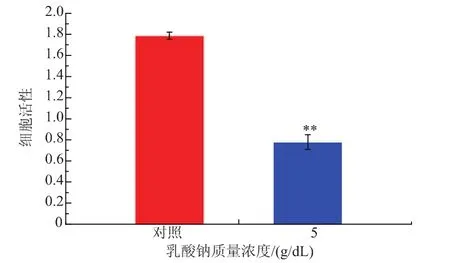
图4 乳酸钠质量浓度对单增李斯特菌WaX12生物被膜内细菌细胞活性的影响Fig.4 Effects of sodium lactate on viable cells in biofilm of WaX12 with 5%sodium lactate and without
2.5 乳酸钠对单增李斯特菌WaX12生物被膜内细菌细胞膜完整性的影响
利用流式细胞仪检测5 g/dL乳酸钠对单增李斯特菌WaX12生物被膜内细菌细胞膜完整性的影响,结果见图5。经5 g/dL乳酸钠处理的WaX12菌株生物被膜内细菌细胞PI信号峰发生右移,信号强度显著增大(图5(c))。可见,乳酸钠可显著降低WaX12菌株生物被膜内细菌细胞膜的完整性,从而抑制其生物被膜的形成。
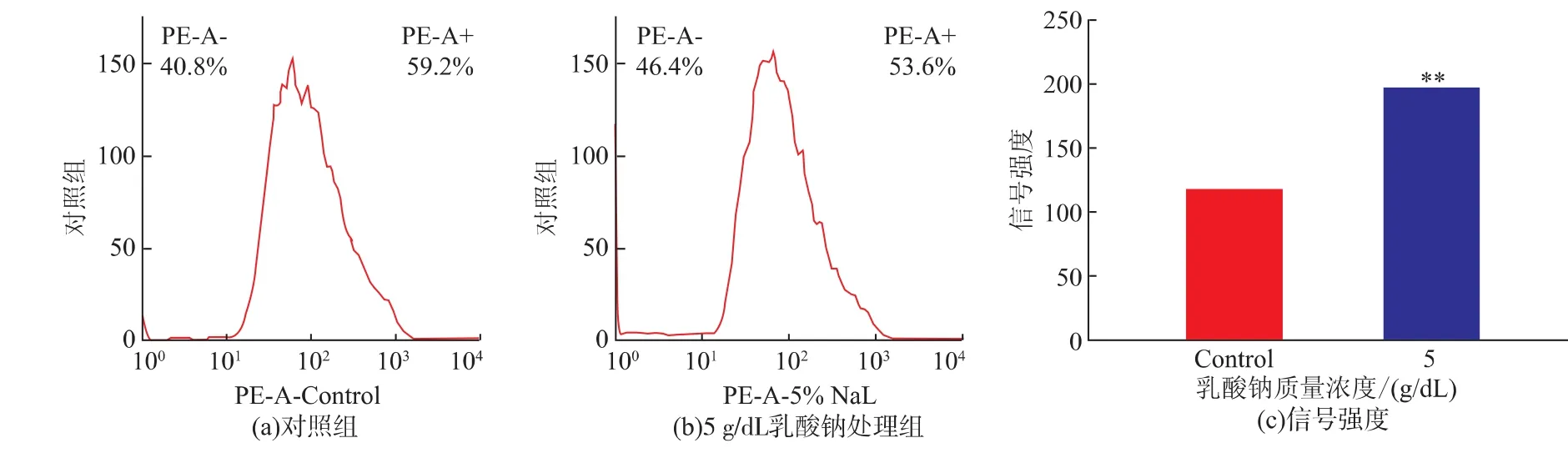
图5 流式细胞仪分析乳酸钠对单增李斯特菌WaX12生物被膜内细菌细胞膜完整性的影响Fig.5 Flow cytometry analysis of effects of Sodium lactate on membrane integrity of L.monocytogenes biofilm cells
2.6 乳酸钠对单增李斯特菌WaX12生物被膜相关基因表达量的影响
采用荧光实时定量PCR法测定了单增李斯特菌WaX12生物被膜相关基因的mRNA表达水平,见图6。从图6可以看出,与对照组相比较,经5 g/dL乳酸钠处理过的生物被膜状态下的WaX12菌株,一些与生物被膜相关的基因表达量下调,主要为鞭毛合成及运动相关基因 motB、mogR、degU、flgE;热激蛋白转录因子dnaK及主要毒力调控因子prfA。实时定量PCR结果表明,乳酸钠可通过下调单增李斯特菌WaX12生物被膜相关基因的表达以抑制其生物被膜的形成。

图6 乳酸钠对单增李斯特菌WaX12的生物被膜相关基因表达量的影响Fig.6 Effects of Sodium lactate on expression of biofilmassociated genes in L.monocytogenes WaX12 biofilm cells
3 结语
乳酸钠作为一种常见防腐剂可抑制多种腐败菌和致病菌的生长,其在减少胴体污染、降低细菌总数方面具有明显的效果[13]。细菌生物被膜是细菌为适应自然环境的一种生命现象,生物被膜态的细菌具有极强的抗药性、抗吞噬及抗趋化作用,普通的清洗和消毒无法达到除菌的效果[14]。因此,如何控制食品产业中细菌生物被膜的形成变得尤为重要。目前,国内外研究乳酸钠对细菌生物被膜的作用尚未见报道,尤其对乳酸钠作用机理以及应用方面仍有待研究。
单增李斯特菌易在食品加工材料表面聚集形成生物被膜,与浮游菌相比,其生物被膜内细菌对外界的环境刺激敏感性显著降低,尤其是对抗菌剂的敏感性[15]。早期研究发现,作为生物被膜骨架的EPS是微生物自身代谢产物,是构成生物被膜三维结构的关键因子[16-17]。胞外多糖及胞外蛋白质在细胞初始粘附及维持生物被膜稳定中起着关键作用,Sutherland[18]等研究混合菌属生物被膜结构发现,只要存在能合成胞外多糖的微生物菌属,就能形成成熟稳定的生物被膜,而Branda[19]等研究表明,假单胞菌细胞结合型胞外蛋白CdrA可促进更多的细胞与胞外多糖结合,从而加快其生物被膜的形成。作者研究了5 g/dL乳酸钠对其生物被膜胞外多糖及胞外蛋白质形成的影响,发现其相对含量分别降低了33.9%(p<0.01)和 56.1%(p<0.01);同时,显微镜观察结果表明,单增李斯特菌在该NaL质量浓度处理下无法形成成熟稳定的生物被膜结构;与对照组相比,其生物被膜结构明显稀疏,由微菌落交联而成,且厚度减少了47.1%(p<0.01)。由上述结果可知,乳酸钠能够通过降低单增李斯特菌生物被膜胞外多糖和胞外蛋白质的形成以抑制其新生物被膜的形成。根据本研究使用MTT法检测单增李斯特菌生物被膜内细菌的细胞活性,该方法能够检测到生物被膜深部较低密度细菌的活性,具有操作简便、经济、灵敏度高等优点[20]。我们发现,5 g/dL乳酸钠可显著降低单增李斯特菌生物被膜内细菌的细胞活性,其抑制率达到56.4%(p<0.01),可见其对单增李斯特菌生物被膜形成的抑制效果显著。利用流式细胞仪技术评价了该质量浓度下的乳酸钠对单增李斯特菌生物被膜内细菌细胞膜完整性的影响。荧光染料PI(碘化丙啶)是一种可用于DNA染色的细胞核染色试剂,虽然不能通过活细胞膜,但能穿过破损的细胞膜而对核染色[21]。结果显示,经 5 g/dL乳酸钠处理的单增李斯特菌生物被膜内细菌细胞膜的完整性显著降低。根据上述结果可知,乳酸钠可抑制膜内细菌细胞活性及破坏细胞膜的完整性,从而抑制新生物被膜的形成。
研究表明,细菌粘附贯穿在整个生物被膜系统的不同阶段,菌体的粘附能力可能决定着生物被膜持续形成和发展的命运[22]。Lemon[23]等研究发现,在单增李斯特菌细胞初始粘附阶段,鞭毛运动对生物被膜的形成起着至关重要的作用。在研究乳酸钠对单增李斯特菌生物被膜相关基因表达量影响的实验中发现,经5 g/dL乳酸钠处理后,与鞭毛合成及运动相关的基因 motB、mogR、degU、flgE表达量均出现了下调。鞭毛的趋化运动可使浮游的单增李斯特菌向有营养物质的表面游动,增强细菌与接触表面的粘附性,从而有助于细菌形成结构稳定的生物被膜[24]。近年来,研究主要毒力基因prfA在单增李斯特菌生物被膜形成过程中的调节机制也是一大热点,这对于揭示其致病原理具有重要的意义。目前,已有大量研究证明转录调节子prfA是正向调控单增李斯特菌生物被膜形成的因子之一,并且发现单增李斯特菌的绝大多数毒力基因的转录表达都受到prfA的调控[25]。张强等[26]通过比较野生型菌株EGD、prfA基因突变型菌株生物被膜形成能力的差异,发现与EGD株相比,prfA基因突变型菌株形成生物被膜的能力明显降低。相比于对照组,我们发现5%乳酸钠可显著降低毒力基因prfA的表达水平。此外,已有研究表明,热激蛋白转录因子dnaK也可促进单增李斯特菌生物被膜的形成;同样,经5 g/dL乳酸钠处理之后,其表达量显著降低。综上所述,我们推测乳酸钠可能通过下调这些与生物被膜相关基因的表达,从而在一定程度上抑制生物被膜的形成,但其具体的抑制机理仍需进一步的研究。
本研究首先采用结晶紫染色法考察了不同浓度(0、2.5、5、10、20 g/dL)乳酸钠对单增李斯特菌生物被膜形成的抑制效果,发现其抑制率分别为8.34%、32.2%、46.6%、55.2%。进一步研究5 g/dL乳酸钠抑制单增李斯特菌生物被膜形成的抑制作用,结果发现,经5 g/dL乳酸钠处理后,单增李斯特菌生物被膜结构明显稀疏,且厚度减少;该质量浓度下的乳酸钠可显著降低生物被膜胞外多糖和胞外蛋白质的形成,同时抑制膜内细菌细胞活性及降低细胞膜的完整性。最后,实时定量PCR结果表明,乳酸钠可通过下调单增李斯特菌生物被膜相关基因的表达以抑制其生物被膜的形成。乳酸钠作为常用防腐剂以有效抑制单增李斯特菌生物被膜的形成,具有极高的潜在应用价值。

