pH响应型透明质酸胶束的制备及其药物传递性能
宋家鸿, 徐珊珊, 张曼悦, 刘 潇, 许菲格, 朱栋琪, 陈荆晓, 陈敬华
(江南大学 药学院,江苏 无锡 214122)
用聚合物胶束包载疏水性抗肿瘤药物能够有效增加药物溶解性,并能利用纳米粒子独特的增强渗透滞留(EPR)效应,改善药物在体内的分布,提高药物在肿瘤组织中的蓄积,提高治疗效果并且降低毒副作用[1-5]。利用肿瘤细胞表面异常过表达的抗原及受体,在纳米粒子表面修饰对应的抗体和配体,可进一步提高纳米粒子对肿瘤细胞的选择性,实现主动靶向治疗[6-8]。
透明质酸(Hyaluronic acid,HA)是一种生物相容性良好的天然糖胺聚糖,能够识别多种肿瘤细胞表面过表达的CD44受体[9-11],因而广泛用于构建药物载体。有研究表明,苯硼酸在弱碱性环境下可与含1,2-二醇结构的多糖形成酸敏感硼酸酯键。由于肿瘤部位具有pH偏低的特点,因而可以用硼酸酯键制备pH-敏感型药物载体[12-14]。
作者以HA为亲水性主链,硼酸衍生化脱氧胆酸(Boronate modified deoxycholic acid,AD)为疏水基团,基于硼酸酯键制备两亲性材料HAAD,进而通过自组装制备胶束用于DOX的包载和靶向传递见图1。利用肿瘤细胞表面过表达的CD44受体和肿瘤组织偏酸的性质,实现载药胶束对药物的靶向传递以及快速释放,提高治疗效果。
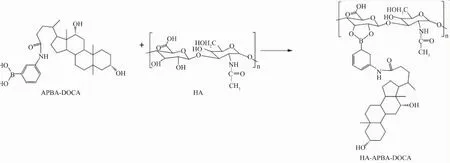
图1 HAAD的合成路线Fig.1 Synthesis routes of HAAD conjugate
1 材料与方法
1.1 材料
1.1.1 材料与试剂 HA(相对分子质量5 000):购自山东华熙福瑞达医药集团公司;氨基苯硼酸(APBA):购自上海安耐吉化学有限公司;脱氧胆酸(DOCA)和三乙胺(TEA):购自国药集团化学试剂有限公司;1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(EDAC)和 N-羟基琥珀酰亚胺(NHS):购自阿拉丁试剂有限公司;阿霉素·盐酸盐 (DOX·HCl):购自浙江海正制药有限公司;胰酶:购自Sigma-Aldrich公司;DMEM细胞培养基:购自Life Technologies公司;胎牛血清(FBS):购自 Hyclone 公司;其它试剂均为分析纯,使用前纯化。
1.1.2 仪器 Avance III型核磁共振波谱仪:德国Bruker公司制造;JEM-2100透射电镜:日本JEOL公司制造;Zetasizer Nano ZS电位及粒度分析仪:英国Malvern公司制造;Multiskan GO酶标仪:美国Thermo公司制造;DMIL倒置荧光显微镜:德国Leica公司制造;FACScan流式细胞仪:美国BD公司制造。
1.1.3 细胞 人乳腺癌细胞(MCF-7)和非洲绿猴肾成纤维细胞 (COS7):购自中国科学院保藏中心(上海)。
1.2 方法
1.2.1 AD的制备 称取的 DOCA(1 g,2.55 mmol)溶于5 mL新蒸DMF中,于冰浴下加入EDAC(474 mg,3.06 mmol)和 NHS(351 mg,3.06 mmol)搅拌 1 h活化羧基,然后将 APBA(263 mg,1.70 mmol)加入上述溶液并在氮气保护下于室温搅拌反应24 h。待反应结束后,将反应溶液浓缩并用去离子水沉淀,过滤收集产生的黄色沉淀,并通过碱性氧化铝柱层析分离获得 AD(二氯甲烷∶甲醇=10∶1),通过核磁共振氢谱验证结构。
1.2.2 HAAD的制备 称取100 mg的HA溶于6 mL甲酰胺,将3 mL含有263.4 mg AD的DMF溶液(MAD∶M双糖=4∶1)加入到上述溶液中,并调节溶液pH为10.0,之后置于室温下反应24 h。待反应结束后用pH 10.0的缓冲液透析1 d去除有机溶剂,冷冻干燥后用DMSO洗去未反应的AD,再次干燥得到产品。通过核磁共振氢谱验证结构并计算AD的取代度。根据AD标曲测定其含量,AD含量 (%)=(WAD/WHAAD)×100。
1.2.3 载药HAAD胶束的制备 称取6 mg的DOX·HCl溶于1 mL甲酰胺中,并加入1 mL TEA,避光搅拌过夜脱除盐酸盐。然后将其加入到5 mL含有30 mg HAAD的甲酰胺溶液中,避光搅拌1 h。最后将其装入透析袋(相对分子质量3 500)避光透析24 h,冷冻干燥获得载药HAAD胶束。
1.2.4 HAAD胶束的表征 将HAAD和载药HAAD溶于PBS中(pH 7.4),配制成1 mg/mL的溶液,通过粒径仪测定它们的粒径分布以及ζ-电位,并用透射电镜观察其形貌。
1.2.5 载药量和包封率的测定 通过扫描阿霉素在有机试剂(V甲酰胺∶VDMF=2∶1)和 PBS 中的全波长,发现其分别在480 nm和497 nm处有最大吸收[15]。用梯度稀释法测量不同DOX质量浓度下吸光值后,以阿霉素的质量浓度为横坐标,吸光值(A)为纵坐标,经过拟合后绘制阿霉素在有机试剂和PBS中的标准曲线。线性回归方程式为:
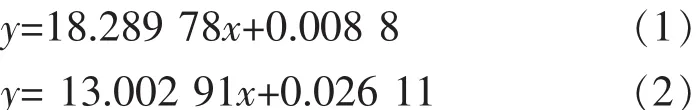
其中,式(1)为阿霉素在PBS中的标准曲线,式(2)为阿霉素在甲酰胺/DMF(V/V=2∶1)中的标准曲线。
将载药HAAD胶束溶于甲酰胺/DMF(V/V=2∶1)中,质量浓度0.05 mg/L,测定其在480 nm处的吸光值。

1.2.6 体外药物释放实验 将4 mL载药HAAD胶束(1 mg/mL)分成两组,分别装入透析袋(相对分子质量3 500)中,浸没于 5 mL PBS中(pH 7.4和pH 5.0)。在37℃、200 r/min摇床下进行药物释放实验,每隔一定时间取样,测其在497 nm下的紫外吸光值,同时更换新鲜PBS,每组实验3个平行。
1.2.7 体外细胞毒性实验 将COS7细胞和MCF-7细胞以每孔8 000个细胞接种于96孔板中,在37℃、5%CO2的培养箱中培养过夜后,分别加入不同质量浓度的载药HAAD胶束,空白HAAD胶束和游离DOX,培养48 h后用噻唑蓝(MTT)比色法测定其在570 nm下的吸光(OD)值,计算细胞存活率。

1.2.8 细胞摄取实验 将COS7细胞和MCF-7细胞以每孔3×104个细胞接种于24孔板中,在37℃、5%CO2的培养箱中培养过夜后,加入等阿霉素量的载药HAAD胶束和游离DOX(质量浓度1 μg/mL),3 h后移去培养基,用PBS洗涤3次后用4%的多聚甲醛溶液固定15 min,吸去多聚甲醛后加入200 μL的 DAPI(200 ng/mL)溶液孵育 15 min,PBS 充分洗涤后用荧光倒置显微镜观察。
1.2.9 流式细胞仪分析 将COS7细胞和MCF-7细胞以每孔1×105个细胞接种于6孔板中,在37℃、5%CO2的培养箱中培养过夜后,加入等阿霉素量的载药HAAD胶束和游离DOX(质量浓度1 μg/mL),3 h后移去培养基,将细胞收集于500 mL PBS中,用流式细胞仪分析细胞内DOX的荧光强度。
2 结果与分析
2.1 HAAD的制备
AD的核磁共振氢谱见图2。与图2(a)相比较,图2(b)中7.19~7.89处出现了APBA上苯环的峰,7.94处出现了酰胺键的峰,而11.87处DOCA上羧基的峰消失了,这说明AD已经成功制备。另外,HAAD 的核磁图谱(图 3)在 0.71~1.94和 7.0~8.0处分别出现了DOCA甾环和苯环的特征峰,通过263 nm处的AD标曲计算得出每100个双糖分子含有27个AD分子,见图3。
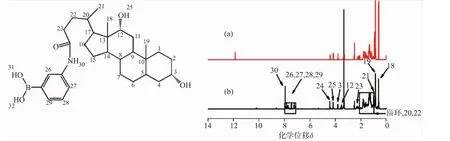
图2 DOCA(a)与AD(b)在DMSO中的核磁共振氢谱Fig.2 1H-NMR of(a) DOCA and(b) AD in DMSO
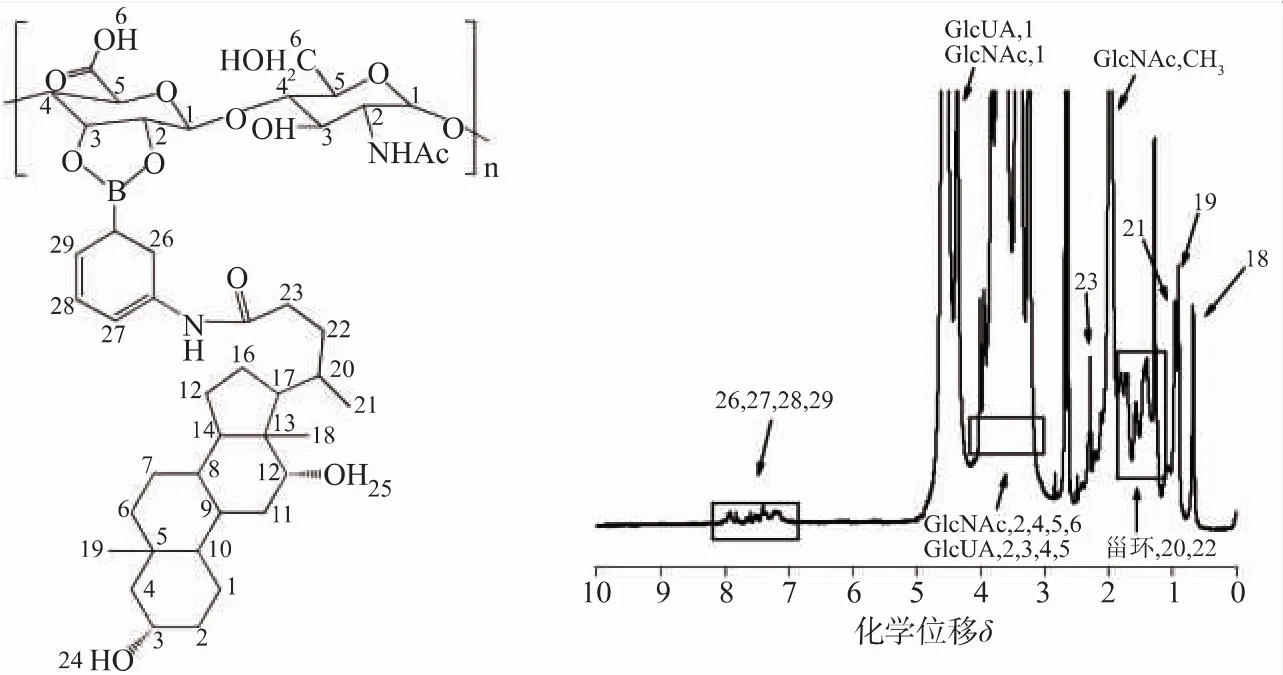
图3 HAAD在D2O/DMSO(V/V:1/1)中的核磁共振氢谱Fig.3 1H-NMR of HAAD in D2O/DMSO(V/V:1/1)
2.2 纳米粒子的表征
由于疏水性抗肿瘤药物阿霉素被包裹于胶束核心内,因此通过动态光散射测得的HAAD胶束的粒径由载药前的171 nm增大到246 nm,见图4。透射电镜观察到HAAD胶束为均匀分散的球状结构,见图5。由于电镜观测的是干燥状态下的胶束,其平均尺寸要小于DLS测得的水合粒径。另外,HAAD胶束的ζ-电位为-23 mV,这表明胶束表面带有负电荷,并且ζ-电位绝对值较大,说明其具有良好的稳定性。由于胶束表面带负电,因而还可以有效避免血浆蛋白的吸附,延长血液循环时间。
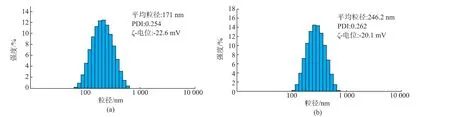
图4 HAAD与载药HAAD的粒径分布及ζ-电位Fig.4 Size distributions and ξ-potential of HAAD and DOX-loaded HAAD

图5 HAAD胶束的透射电镜图Fig.5 TEM image of HAAD micelles
2.3 体外药物释放
载药HAAD胶束的载药量(DL)和包封率(EE)分别测得为9.15%和45.74%,说明该载体有较良好的载药能力。体外药物释放实验分别在pH 7.4和pH 5.0的PBS中进行,pH 7.4用于模拟体内正常组织环境,而pH 5.0则用于模拟肿瘤组织微环境。如图6所示,在pH 5.0组中,HAAD的药物释放速率相对较快,在初始的10 h内累积释放药物63.86%,48 h后达到86.61%。而在pH 7.4组中,10 h和48 h的累积药物释放率分别为40.59%和66.01%。产生这一差异的主要原因是在酸性环境下,HAAD胶束的硼酸酯键会断裂,导致HA与AD解离,而造成药物快速泄漏。另一方面,阿霉素在酸性pH下较好的溶解性也使得阿霉素能够更快地从透析袋内部扩散到外部。这一结果证明了HAAD胶束可以实现在肿瘤内部的pH-敏感性释放。
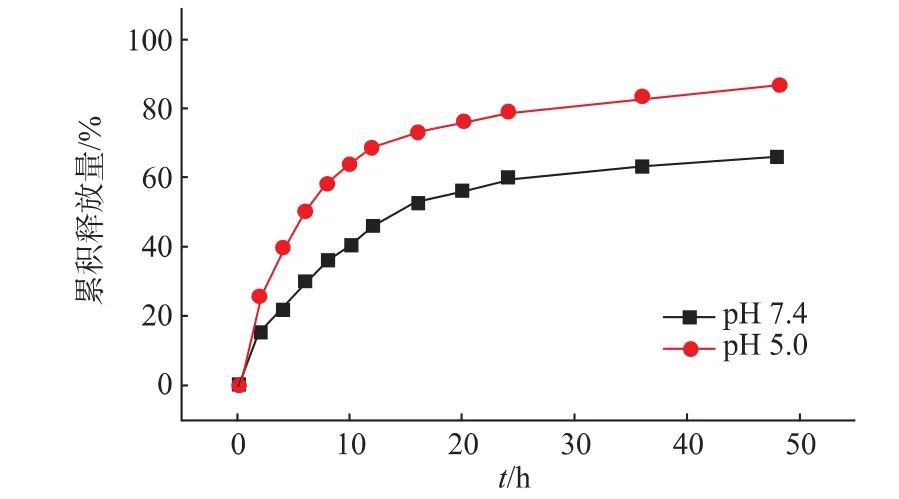
图6 HAAD在pH 7.4和pH 5.0环境下的体外药物释放Fig.6 In vitro drug release profiles of HAAD at pH 7.4 and pH 5.0
2.4 体外细胞毒性
良好的生物相容性是药物载体的必要条件之一,作者研究了空白胶束载体对COS7和MCF-7细胞的细胞毒性。如图7所示,由于APBA被包裹在胶束核心内部,APBA与HA形成的硼酸酯键避免了硼酸与细胞的直接接触,减小了硼酸的毒性,因此空白HAAD胶束即使质量浓度达到300 mg/L时,细胞存活率仍然超过了80%,这表明所制备的材料具有较好的生物相容性。
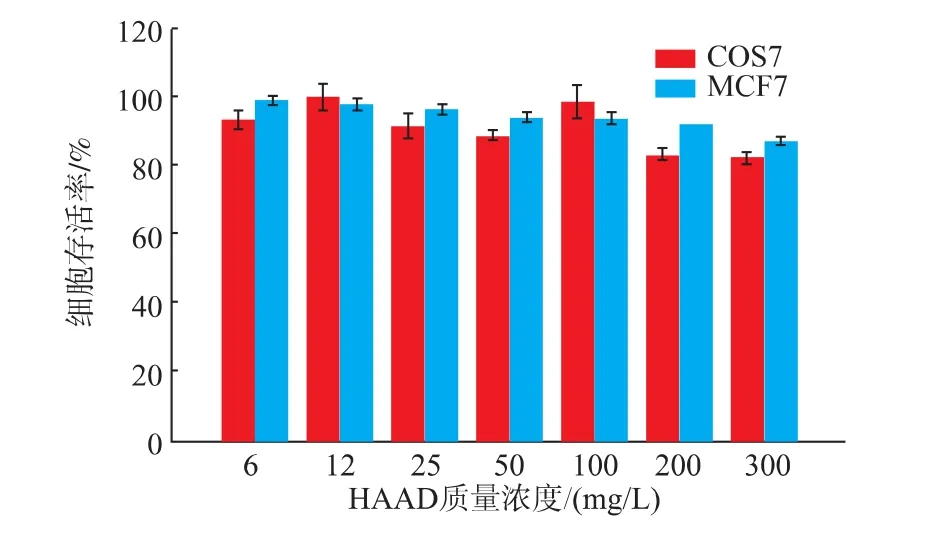
图7 HAAD对MCF-7细胞和COS7细胞48 h的体外细胞毒性Fig.7 In vitro cytotoxicity of HAAD against MCF7 and COS7 cells after 48 h
载药HAAD胶束的细胞毒性见图8。对于MCF-7细胞,载药HAAD胶束与DOX对细胞的半数致死量(IC50)分别为0.37 mg/L和0.31 mg/L。由于HA能够有效识别MCF-7细胞表面过表达的CD44受体,增加了MCF-7细胞对载药胶束的摄取量,并在MCF-7细胞内部酸性环境下,硼酸酯键发生水解并释放出包载的DOX,对细胞的生长产生了抑制作用,因此载药HAAD胶束展现了与DOX相似的细胞毒性。而对于COS7细胞,载药HAAD胶束对细胞的半数致死量要远大于DOX。这是因为COS7细胞表面不具有过表达的CD44受体,因而HAAD胶束被细胞摄取的量相对较低,因而胶束对COS7细胞抑制毒性相对较小。
2.5 细胞摄取
载药HAAD胶束和游离DOX与细胞共培养3 h后,用倒置荧光显微镜观察细胞对HAAD的摄取情况。如图9所示,红色荧光为DOX,蓝色荧光为细胞核,a为MCF-7细胞对载药胶束的摄取图,b为MCF-7细胞对游离阿霉素的摄取图,c为COS7细胞对载药胶束的摄取图,d为COS7细胞对游离阿霉素的摄取图。在CD44过表达的MCF-7细胞中,可以观察到与游离DOX组同样强烈的红色荧光,而在CD44非过表达的COS7细胞中,HAAD胶束组的红色荧光要远远弱于游离DOX组。为了更加直观地表现载药HAAD胶束在MCF-7细胞和COS7细胞中摄取量的差异,使用流式细胞仪对细胞摄取情况进行了定量分析,结果见图10。与载药HAAD胶束共同孵育3 h后,MCF-7细胞内的荧光强度要明显强于COS7细胞,说明载药HAAD胶束可以通过受体介导的内吞作用被CD44过表达的乳腺癌细胞有效摄取,从而抑制肿瘤细胞的生长,而对于COS7这样的正常细胞,载药HAAD胶束并不能被有效摄取,所以其对COS7细胞的毒性要远小于游离阿霉素,这与细胞毒性的结果相符。
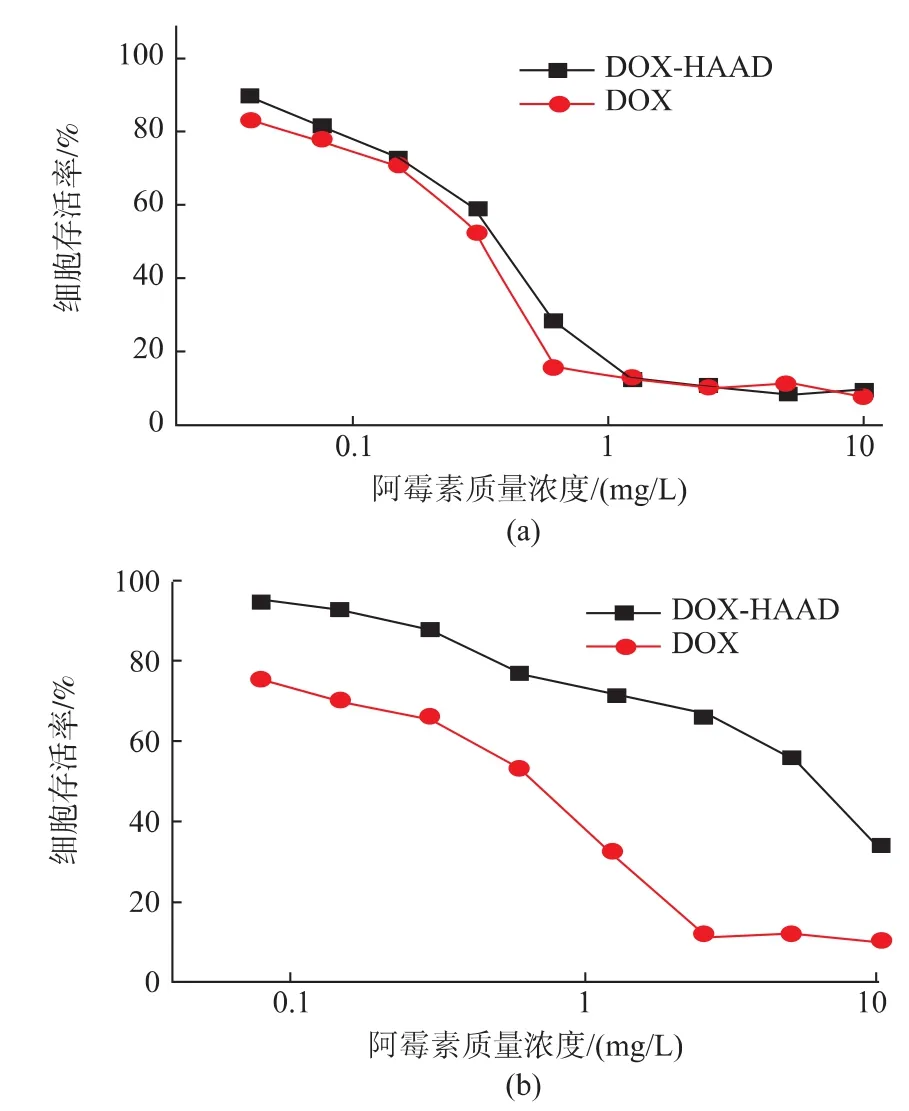
图8 载药HAAD对 (a)MCF-7细胞和 (b)COS7细胞48 h的体外细胞毒性Fig.8 In vitro cytotoxicity of DOX-loaded DOX against(a) MCF7 cells and(b) COS7 cells after 48 h
3 结 语
本研究成功制备了具有酸敏感的两亲性材料HAAD,其在水溶液中可以自组装形成大小均一、分散性良好、表面带有负电荷的球形胶束。载药HAAD胶束在酸性环境中由于硼酸酯键断裂会造成胶束的解离并快速释放出阿霉素,表现出pH响应的释药行为。此外,胶束能够靶向识别CD44受体过表达的MCF-7细胞,从而增强细胞摄取效率,而对正常的COS7细胞毒性较小,体现了药物传递的选择性,这种敏感靶向型胶束在临床应用方面有着广阔的应用前景。
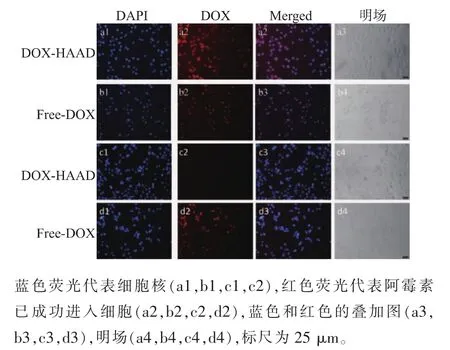
图 9 载药 HAAD,DOX 与 (a,b) MCF-7 细胞和(c,d)COS7细胞共培养3 h的荧光照片Fig.9 Fluorescent images of(a,b) MCF-7 cells and(c,d)COS7 co-cultured with DOX and DOX-loaded micelles for 3 h
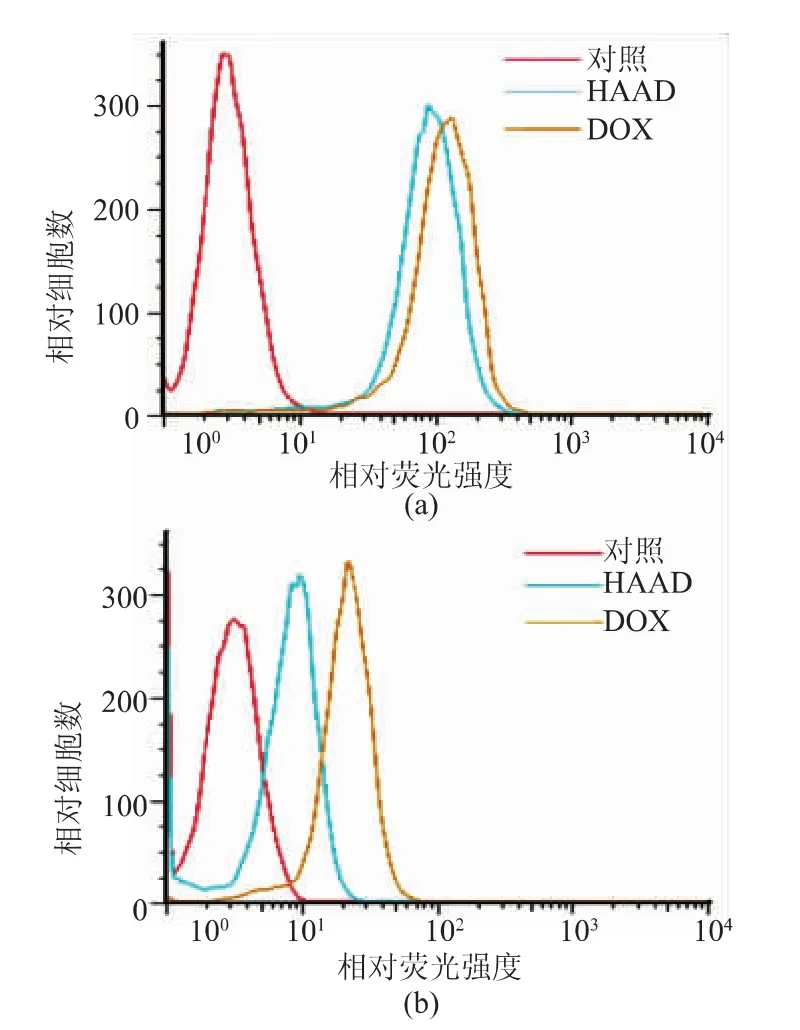
图10 3 h时流式细胞仪分析HAAD被(a)MCF-7和(b)COS7细胞摄取的结果Fig.10 Flow cytometry analysis of HAAD uptake by(a)MCF7 and(b) COS7 cells at 3h

