点突变提高甲酸脱氢酶(CbFDH)的酶活和催化效率
郑俊贤, 王子渊, 杨套伟, 张 显, 徐美娟, 饶志明
(江南大学 生物工程学院,江苏 无锡 214122)
甲酸脱氢酶 (Formate dehydrogenase,FDH,EC 1.2.1.2)属于D-2-羟基酸脱氢酶类,催化甲酸氧化成CO2,同时伴随着NAD+还原为NADH[1-2]。大多数的甲基营养型微生物中都含有甲酸脱氢酶,如可以利用甲醇的酵母菌以及一些细菌、真核生物、高等植物等[1]。它是一种非常保守的酶,在所有来源的酶中,绝对保守的氨基酸残基有60个[2],且对于一些进化距离比较远的微生物物种如:Pseudomonas sp.101、Hansenula polymorpha 和 Solanum tuberosum 来源的FDH,其氨基酸序列同源性高达45%,而与催化或辅酶和底物结合相关的氨基酸残基在FDH中更为严格保守[3]。因此,参考大多数物种在关键区域的氨基酸序列,利用同源序列比对,对某种来源的FDH进行改造,具有较高的可靠性。
FDH催化还原NAD+的反应关键在于增强了NAD+的C4N部分的亲电性质。反应中,负氢离子脱离甲酸并攻击NAD+的带正电荷亲电C4N部分,结果产生了两种中性物质CO2和NADH[4]。该反应需要在避免水分子干扰的密闭环境中进行,同时FDH的结构也为此提供了良好的疏水中心[4-5]。
随着蛋白质结晶技术的发展,越来越多的FDH三维结构得到解析,对深入探索蛋白质结构和功能之间的联系有着重要的作用;另外,对FDH催化机理的研究也在不断增多,在酶催化过程中起关键作用的氨基酸残基位点也多有报道[6-8],这有利于通过理性设计并利用蛋白质工程对FDH的特性进行改造。已报道对FDH的改造主要集中在以下几个方面:改变辅酶特异性[9-11]、提高酶活[12-13]、提高酶的稳定性等方面[14-15]。
由于FDH的催化反应具有不可逆、底物廉价和副产物容易去除等优势,因此常被用作辅酶NADH再生酶与其他氧化还原酶组合用于羟基酸、手性醇、氨基酸等重要光学活性化合物的生物转化生产,而这些产品广泛应用于食品、医药及各种添加剂中[16]。最具代表性的是来源于博伊丁假丝酵母(Candida boidinii)的甲酸脱氢酶CbFDH,在上世纪已经被用来与亮氨酸脱氢酶偶联用于手性L-叔亮氨酸的工业化生产[17]。然而,野生型CbFDH酶活低,与亮氨酸脱氢酶、乳酸脱氢酶及乙醇脱氢酶等组合时,辅酶NADH再生供应不足,造成产品转化效率不高[18]。
作者通过多种来源的甲酸脱氢酶序列比对获得关键保守位置的差异点 (第93位氨基酸残基),该位点位于底物的通道入口,其疏水性可能会影响FDH的催化活性,因此,对存在差异的CbFDH的V93位点进行疏水性改造及分析,同时对获得的突变体酶进行酶学性质研究及动力学参数研究。其中突变体酶V93I在酶活、比酶活和催化效率上均有所提高,该酶进一步被用于L-正缬氨酸的不对称合成,结果表明了该突变体酶能够提高体系的转化效率从而缩短底物完全转化的时间,具有较强的开发和应用潜力。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 表达宿主菌E.coli BL21和重组菌E.coli BL21/pET28a-fdh:由作者所在实验室保存;表达质粒pET-28a(含卡那霉素抗性):购自Novagen公司。
1.1.2 主要试剂 PrimeSTAR®HS DNA聚合酶、限制性内切酶、E×Taq DNA聚合酶:均购于TaKaRa公司(大连);ClonExpress II One Step Cloning Kit试剂盒:购于南京诺唯赞;胶回收试剂盒、质粒快速提取试剂盒:均购于Generay公司;Bradford法蛋白质浓度测定试剂盒:购于生工(上海)生物工程有限公司;酵母提取物、胰蛋白胨:购于OXOID(英国);其他均为国产分析纯。
1.1.3 培养基 LB液体培养基(组分g/L):酵母提取物 5, 胰蛋白胨 10,NaCl 10;pH 7.0,121 ℃灭菌20 min;LB固体培养基为在液体培养基基础上添加质量浓度20 g/L的琼脂粉。
1.2 方法
1.2.1 基因定点突变和重组质粒的构建 以实验室已构建的重组质粒pET28a-fdh为模板,设计点突变引物,见表1。通过重叠延伸PCR引进突变点[19]。

表1 基因克隆及定点突变引物Table 1 Primers used for site-directed mutagenesis and gene cloning
按照ClonExpress II One Step Cloning Kit试剂盒说明书,将重叠延伸得到的PCR产物及表达质粒pET28a的双酶切(BamHI和HindIII)产物按一定的比例混合连接,然后导入感受态E.coli BL21中,挑单克隆提取质粒,并进行测序。保存含经测序验证正确的重组质粒的菌株。
1.2.2 突变体酶的表达和纯化 重组菌接种于10 mL含卡那霉素抗性的LB液体培养基中培养12 h。然后以1%的接种体积分数将其接至50 mL含卡那霉素抗性的LB液体培养基中培养4 h,条件为37℃、180 r/min。之后加入终浓度为0.8 mmol/L的IPTG进行诱导,诱导条件为30℃、160 r/min,诱导时间为16 h。离心收集细胞,并用 PBS(pH 7.5,浓度为0.05 mol/L)缓冲液洗涤2次后悬浮。然后使用超声破碎仪对细胞进行破碎,温度控制在4℃。将破碎液在4℃、14 000 r/min条件下离心20 min去除细胞破碎杂质,用于纯化。
蛋白质纯化的方法是采用镍柱亲和层析,具体参照文献[13]所述方法。
1.2.3 突变体酶酶活的测定 突变体酶酶活测定采用紫外分光光度法测定[13,20]。反应预混液中含有浓度为0.167 mmol/L甲酸钠溶液 (由PBS浓度为0.05 mol/L,pH 7.5配制)和浓度为 1.67 mmol/L NAD+。加入10 μL适量稀释的待测样品,启动反应并计时,在340 nm下每30秒记录一次吸光值。以不同浓度的NADH做标准曲线,计算每分钟产生的NADH的量。酶活定义为:每分钟产生摩尔质量为1 μmol NADH所需的酶量为1个酶活单位。
1.2.4 突变体酶的酶学性质研究 最适温度:在pH 7.0条件下,将10 μL适量稀释纯酶液添加到反应预混液中,将反应体系分别置于 35、40、45、50、55℃下反应,按1.2.3.所述方法测定酶活。设定最高酶活为100%,计算各个温度下的相对酶活,获得该酶的最适反应温度。
最适pH:将10 μL适量稀释纯酶液添加到不同pH的缓冲溶液中(pH 5.0~6.0,浓度为0.05 mol/L的柠檬酸-柠檬酸钠缓冲液;pH 7.0~8.0,浓度为0.05 mol/L 的 PBS 缓冲液;pH 9.0~10.0,浓度为 0.05 mol/L 的 Tris-HCl缓冲液;pH 10.0~11.0, 浓度为0.05 mol/L的甘氨酸-氢氧化钠缓冲液),于30℃下测定酶活。设定最高酶活为100%,计算各个pH下的相对酶活,获得该酶的最适反应pH。
温度稳定性:将适量稀释纯酶液于60℃下孵育,每2分钟取样。在最适条件下测定酶活,以初始酶活为100%,计算处理后各样品的相对酶活,考察突变体酶的温度稳定性。
pH稳定性:将适量稀释纯酶液加入到pH 3~12的缓冲溶液中(其中pH 3.0~5.0,浓度为0.05 mol/L的柠檬酸-柠檬酸钠缓冲液;pH 11.0~12.0,浓度为0.05 mol/L的Na2HPO4-NaOH缓冲液,其余缓冲液同最适pH)于30℃下孵育1 h,然后在最适条件下测定各样品的剩余酶活。以初始酶活为100%,计算处理后各样品的相对酶活,考察突变体酶的pH稳定性。
1.2.5 动力学参数测定 对于底物NAD+的米氏常数Km测定,固定甲酸钠的浓度为200 mmol/L,配制不同浓度的NAD+溶液,加入适量纯酶液,在最适条件下检测反应初速度。同样地,对于底物甲酸的米氏常数Km测定,固定NAD+的浓度为10 mmol/L配制不同浓度的甲酸钠溶液,加入适量纯酶液,在最适条件下检测反应初速度。利用Origin 8.0软件拟合相应测得的数据,从而获得两个底物的Km和kcat值。
1.2.6 圆二色谱分析 野生型酶CboFDH和突变体酶的圆二色性分析在圆二色谱仪(MOS-450/AF-CD-STP-A)上进行。将待测样品用超纯水稀释至质量浓度为100 μg/mL,然后加入一个1 nm光径的适量比色皿中,使用圆二色谱仪在光谱范围为190~250 nm的紫外光谱区扫描蛋白质样品,扫描速度为120 nm/min。扫描结果在Dichroweb服务器上进行分 析 (http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)。
1.2.7 三维结构模拟及分析 CbFDH的三维结构PDB(5dn9)文件从RCSB数据库获得。使用Discovery Studio 2.5分析突变体酶的分子内相互作用力的改变情况。利用PYMOL软件进行结构处理和图形制作。
1.2.8 L-正缬氨酸的不对称合成 L-正缬氨酸的不对称合成体系为25 mL的转化体系,其中含有:浓度为20 mmol/L的2-氧代戊酸,浓度为20 mmol/L的甲酸胺,浓度为0.3 mmol/L的NAD+,体积酶活为2 U/mL的亮氨酸脱氢酶及质量浓度为0.1 mg/mL的CbFDH或者是V93I。转化条件为pH 7.5(浓度为0.05 mol/L的磷酸盐缓冲液),温度为30℃,每间隔0.5小时取一次样。底物和产物的浓度测定采用HPLC,具体方法参见文献[21]。
2 结果与分析
2.1 突变位点的选择
如图1,通过比对7种不同来源的甲酸脱氢酶,分 别 来 源 于 Glycine max、Arabidopsis thaliana、Thiobacillus sp、Mycobacterium vaccae、Ancylobacter aquaticus、Pseudomonas sp.101 和 Candida boidinii。发现其中来源于C.boidinii的甲酸脱氢酶(CbFDH)的第93位氨基酸残基为缬氨酸(V)而其余6种来源的甲酸脱氢酶均为异亮氨酸(I)。同时该位点位于CbFDH的一个保守序列AGI/VGSDH区域中。有研究表明,氢质子的转移需要避免水分子的干扰,而FDH的催化本质就是NAD+和甲酸离子之间的质子转移[4]。通过对CbFDH的PDB(5dn9)模型进行分析发现,V93位点正好位于CbFDH的底物通道入口,保护着酶的催化反应中心,见图2。而CbFDH反应中心入口的疏水性极有可能会影响NAD+的质子接收及NAD+的结合,从而影响CbFDH的酶活和催化效率。因此,我们选择对V93位点的疏水性进行改造,设计了 4个突变体酶 V93I、V93A、V93L和V93G,其中氨基酸疏水性由大到小排序为:Ile>Val>Leu>Ala>Gly。

图1 不同来源的甲酸脱氢酶氨基酸序列比较Fig.1 Sequences alignment of formate dehydrogenase from different bacteria

图2 Candida Boidinii来源的甲酸脱氢酶的三维结构分析Fig.2 Three-dimensional structure analysis of formate dehydrogenase from Candida boidinii
2.2 突变体酶的构建、表达及纯化
利用重叠延伸PCR获得突变体酶基因,通过ClonExpress II One Step Cloning Kit将突变基因连接到表达载体pET28a(+)上,获得重组质粒pET28a-V93I、pET28a-V93L、pET28a-V93A 和pET28a-V93G,并通过PCR和测序验证质粒的正确性。然后将正确的重组质粒导入到E.coli BL21获得重组菌株 E.coli BL21/pET28a-V93I、E.coli BL21/pET28a-V93L、E.coli BL21/pET28a-V93A 和E.coli BL21/pET28a-V93G。
按照1.2.2所述方法诱导表达,然后离心收集细胞,用超声破碎仪破碎并离心去除细胞破碎沉淀,破碎上清液即为重组菌表达后的粗酶液。进一步利用镍柱纯化,得到突变体酶和野生型的纯酶样品。所有样品经处理后,进行SDS-PAGE电泳分析,见图3。得到的突变体酶的蛋白质相对分子质量大小为 40 300,符合 CbFDH 利用载体 pET28a(+)表达后的大小。同时可以看出,除了V93I,其余突变体酶的蛋白质质量浓度比野生型酶有所下降。进一步对突变体酶的酶活、比酶活及蛋白质质量浓度进行测定,结果见表2。表明突变体酶V93I的体积酶活为19.37 U/mL,比野生型提高34.7%,比酶活为6.39 U/mg,相比野生型提高22.6%。突变体酶V93A和V93相比野生型,酶活分别降低66%和92.9%,比酶活分别下降26.1%和79.8%。而V93G已经完全失活,在之后酶学性质研究中将不再涉及。上述结果可以看出,CbFDH酶活随着V93位氨基酸残基疏水性的增强而提高 (突变体酶V93L除外),其中V93I的酶活和比酶活均为最高,相比野生型酶更加有优势。

图3 突变体酶及野生型酶纯化后的蛋白质SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified protein of the wild-type enzyme and its variants

表2 突变体酶的酶活及比酶活测定Table 2 Determination of enzyme activity and specific activity of mutant enzyme
2.3 突变体酶的酶学性质研究
对甲酸脱氢酶野生型及其突变体酶的最适pH进行研究,结果见图4。表明突变体酶V93I的最适pH与野生型保持一致,均为9,而突变体酶V93A、V93L最适pH为7。

图4 突变体酶和野生型酶的最适pHFig.4 Optimal pH of the wild-type enzyme and its variants
同时对甲酸脱氢酶野生型及其突变体的最适温度进行研究,结果见图5。突变体酶V93I与V93A的最适温度与野生型酶相同,均为45℃,而突变体酶V93L的最适温度有所下降,为40℃。

图5 突变体酶和野生型酶的最适反应温度Fig.5 Optimal temperature of the wild-type enzyme and its variants
将突变体酶和野生型CbFDH孵育在不同pH溶液中1 h后,在最佳条件下测定残余酶活来研究突变体酶的pH稳定性。突变体酶V93I在酸性和碱性条件下的pH稳定性强于野生型,而另外两个突变体酶V93A和V93L则稍微有些下降,特别是V93L在碱性条件下稳定性下降的幅度相对较大,见图6。

图6 突变体酶和野生型酶pH稳定性Fig.6 pH stability of the wild-type enzyme and its variants
由于甲酸脱氢酶在55℃下比较稳定,24 h内基本不失活[13],因此为了在最短的时间能确定突变体酶的稳定性是否提高,我们在60℃下测定野生型酶及其突变体酶的热稳定性,结果见图7。除了突变体酶V93A的热稳定性相比野生型略强外,其他两个突变体的热稳定性则有所下降,但是不是特别明显。

图7 突变体酶和野生型酶的温度稳定性Fig.7 Thermostability of the wild-type enzyme and its variants
2.4 圆二色谱分析突变前后CbFDH二级结构
利用圆二色谱分析检测突变体酶和野生型酶,比较突变体酶的二级结构是否发生变化,结果见图8。野生型酶及其突变体酶的远紫外圆二色光谱(190~250 nm)基本一致,同时将圆二色谱数据提交到在线服务(Dichroweb server)分析,结果表明突变体酶的二级结构(α-螺旋、β-折叠、无规卷曲等)均未发生明显变化,说明V93位点突变基本不会对CbFDH的二级结构造成影响。
图8 突变体酶和野生型酶的圆二色谱分析Fig.8 Circular dichroism (CD) analysis of wild-type enzyme and its variants
2.5 突变体酶动力学参数分析
甲酸脱氢酶及其突变体酶的米氏动力学参数测定,结果见表3。突变体酶V93A和V93I对NAD+的Km值相比野生型基本没有发生变化,而突变体酶V93L对NAD+的Km值则比野生型高3倍左右,说明V93L对底物NAD+的亲和力明显下降。而对于甲酸的Km值,突变体酶V93I和V93L变化不大,而突变体酶V93A却比野生型高8倍左右,说明其对底物甲酸的亲和力明显下降。相比之下,突变体酶V93I对NAD+的催化效率是野生型酶的2.33倍 (即提高了133%),说明突变体酶V93I相比野生型和其他突变体更加具有优势。
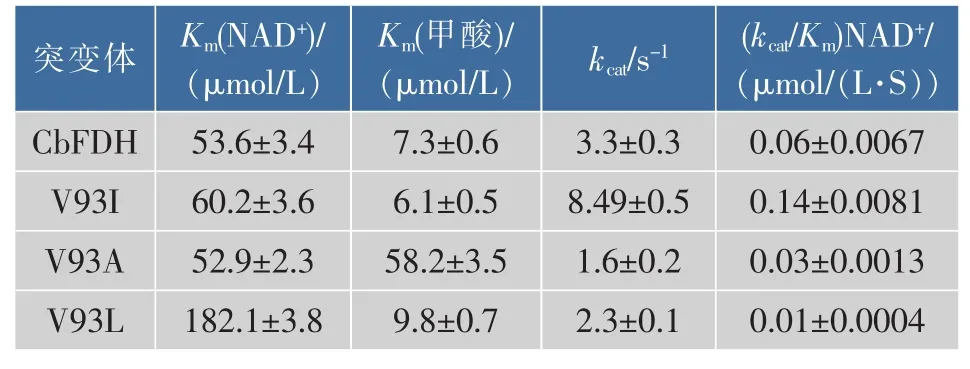
表3 突变体酶和野生型酶的动力学参数Table 3 Kinetics analysis of the wild-type enzyme and its variants
2.6 突变体酶三维结构分析
根据 CbFDH 的三维结构(PDB:5dn9),利用软件将其对应的V93进行突变,获得相关突变体酶的三维模型,然后对这些模型的突变位点进行分析,由于突变的氨基酸残基侧链变化的是甲基基团的增减,经分析后发现突变没有引起相关氢键和离子键的变化。酶活测定表明,突变体酶的酶活随着第93位氨基酸残基疏水性的增强而提高,而突变体酶V93L的活性反而下降。由图9(c)可以看出,突变体酶V93L的第93位Leu的γ-碳原子上的两个甲基基团空间位阻过大,阻碍了NAD+的结合,进而造成该突变体酶对NAD+的亲和力明显下降,从而也导致酶活下降。而对于突变体酶 V93A(图 9(d)),由于第93位氨基酸侧链甲基的减少,使得反应中的疏水保护下降,可能影响了反应中心的氢质子转移,从而导致对甲酸的亲和力下降,进一步酶活也随之降低。对于正向突变体酶V93I,如图9(b)所示,可以看出其第93位氨基酸的γ-碳原子相比野生型酶(图9(a))多了一个甲基基团,该基团位于这个位置不仅使得底物通道入口的连接更加坚固,同时也进一步加强了反应中心的疏水性,这可能是该酶催化效率和酶活提高的主要原因。
结合酶学性质中的最适pH、最适温度以及稳定性研究表明,第93位氨基酸的变化主要是影响到酶对底物NAD+的结合能力和酶反应中心疏水环境的强弱,从而使得酶活和相应动力学参数发生改变,而对其他性质影响不大。

图9 突变体酶及野生型酶三维结构分析Fig.9 There-dimensional structure analysis of wild-type enzyme and its variants
2.7 突变体酶用于L-正缬氨酸的不对称合成
由于突变体酶V93I的酶活和催化效率都比野生型CbFDH高,因此为了进一步探索突变体酶V93I在应用上是否也比野生型CbFDH更有优势,我们利用不对称还原2-氧代戊酸合成L-正缬氨酸体系来进行验证,结果见图10。在突变体酶V93I作为辅酶的情况下 (其他条件都一样),浓度为20 mmol/L的底物2-氧代戊酸完全转化时间由原来野生型酶的2 h缩短到了1.5 h,说明突变体酶V93I在辅酶NADH再生方面的能力确实比野生型酶CbFDH强,有待进一挖掘使用。

图10 突变体酶V93I和野生型酶作为辅酶再生酶用于L-正缬氨酸的不对称合成Fig.10 Asymmetric synthesis of L-norvaline using mutant enzyme V93I and wild-type enzyme for NADH regeneration
3 结 语
作者通过定点突变对野生型酶CbFDH底物通道入口的氨基酸残基位点(V93位点)的疏水性进行改造,获得的最佳突变体酶V93I的比酶活提高22.6%、催化效率(NAD+)提高了133%。在应用于L-正缬氨酸不对称合成的转化体系中,相比野生型酶CbFDH,同等条件下的突变体酶V93I能够提高体系的转化效率、缩短底物完全转化的时间,具有较强的开发和应用潜力。

