6-磷酸葡萄糖酸脱氢酶在产油细菌浑浊红球菌PD630脂质积累中的作用
张冬冬, 赵利娜, 昝新艺, 唐 鑫, 宋元达
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
在过去的几十年里,由于能源紧缺及化石能源工业对环境造成的污染,人们对能够生产大量可再生能源的产油微生物产生了极大的研究兴趣[1]。同时,来自微生物发酵生产的脂肪酸还是交通燃料和化工产品(表面活性剂、润滑剂)合成的前体,因此十分有必要研究和开发一些能够高产脂的微生物菌株[2]。在燃气工程附近污染土壤中发现的浑浊红球菌 PD630(Rhodococcus opacus PD630),在以葡萄糖酸为碳源、氮源限制的条件下,可以合成高达细胞干质量76%的脂质[3-4]。相关研究报道:以甜菜糖浆和蔗糖为混合碳源连续培养R.opacus PD630时,其菌体的生物量能够达到37.4 g/L,且脂质含量高达51.9%[5]。由此可见,产油细菌R.opacus PD630能够作为生产生物柴油的潜在菌株[6-8]。此外,由于其全基因组序列已公布[9]和完善的遗传操作系统[9-12],R.opacus PD630已经成为研究产油细菌细胞代谢与脂质合成机制的模式菌株[13]。同时,也增加了R.opacus PD630利用廉价可再生原料(如木质纤维素水解产物)[14-15]进行发酵生产 “高价值单细胞油脂”的可能性以及成为其它特殊应用的潜在菌株[12,16]。
目前,产油微生物脂质合成的途径已经基本明确:一个关键步骤是提供生物脂质合成所需的必要前体乙酰辅酶A,另一个关键步骤是提供辅助因子还原力NADPH[17]。NADPH不仅是微生物脂质合成的必需还原力,也是激发菌体内大多数酶促反应的动力,其中包括DNA、RNA和蛋白质等生物大分子的合成[18-20]。在研究NADPH的产量与实际通过氧化磷酸戊糖路径(oxPPP)碳流量之间的关系时,发现在许多真核及原核微生物中oxPPP是产生NADPH的一条主要途径[20-23]。而且,已有很多研究基于增加oxPPP的碳流量来提高NADPH的产量,如直接过表达oxPPP相关的酶[23-26];或间接增加oxPPP的碳流量,敲除磷酸葡萄糖异构酶[27-28]或磷酸果糖激酶[29-30]等。研究表明,在R.opacus PD630中葡萄糖-6-磷酸脱氢酶(G6PDH)不仅控制着oxPPP同时还控制着 Entner-Doudoroff(ED)路径[13,31]。 作者所在实验室前期的13C代谢流量分析表明:在高氮和低氮两种不同的产脂培养条件下,R.opacus PD630对oxPPP和ED路径的偏好性不同,在高产脂的培养条件下,通过oxPPP的碳流量是通过ED路径碳流量的5倍左右,而6PGDH正是导致这两种路径流量产生变化最主要的原因,因此6PGDH很有可能是影响其脂质积累的一个关键节点。
为了研究6PGDH在产油细菌R.opacus PD630脂质积累中的作用,作者将编码6PGDH的基因gnd在R.opacus PD630中过表达,并分析过表达重组菌株脂质含量的变化,以期进一步获得产油细菌R.opacus PD630脂质积累的分子机制。
1 材料与方法
1.1 菌株、培养条件及质粒
实验所用菌株和质粒见表1。大肠杆菌Top10(Escherichia coli Top10)于37℃摇床200 r/min在Luria-Bertani(LB)培养基中进行培养。R.opacus PD630(DSMZ44193)[3]于 28 ℃、200 r/min,在 LB 培养基或含有微量元素SL6[32]的MSM[33]培养基中进行培养。 葡萄糖(10 g/L)作为碳源,NH4Cl(1 g/L)用作氮源,细胞在250 mL摇瓶中进行培养,其中含有50 mL MSM培养基。调节活化菌株的浓度使得所有发酵培养接种的初始菌体浓度相同。培养48、72、96 h后离心收集菌体,用NaCl(0.9 g/dL)洗涤菌体细胞两次,之后冷冻干燥至恒质量或直接于-80℃储藏用于下一步的实验分析。对于E.coli Top10和R.opacus PD630选择培养所用的抗体终质量浓度均为50 μg/mL的卡那霉素(Km),发酵培养基中所用的诱导剂为乙酰胺终质量浓度为0.5 g/dL[11]。固体培养基通过加入1.5 g/dL的琼脂来制备。
1.2 重组质粒的构建
通过NCBI网站查找出,R.opacus PD630中有5种同源基因gnd编码6PGDH。由于基因gnd是同源过表达,提取R.opacus PD630的基因组为模板,利用相对应的引物进行PCR扩增从其基因组中分离得到目的基因片段,上下游引物分别含有BamHI和XbaI酶切位点。扩增得到的PCR产物经过1 g/dL琼脂糖凝胶电泳后进行胶回收,同时质粒pJAM2分别加入BamHI和XbaI进行双酶切,酶切后的DNA片段和PCR产物分别按一定比例混合,利用T4连接酶进行连接,得到重组质粒pJAM2/gnd1、pJAM2/gnd2、pJAM2/gnd3、pJAM2/gnd4 和 pJAM2/gnd5。 重组质粒中目的基因片段位于乙酰胺酶(ace)启动子下游,将以上构建得到的重组质粒用化学法转化到E.coli Top10的感受态细胞中,在添加有50 μg/mL Km的LB固体平板上于37℃培养12~16 h,随机选取每一种重组菌株的转化子进行PCR验证,验证正确的阳性转化子送至上海桑尼生物科技有限公司进行基因测序验证。之后将测序正确的重组质粒电击转化至R.opacus PD630,得到过表达gnd的重组菌株。本实验所有的菌株及质粒见表1,所有的引物见表2。
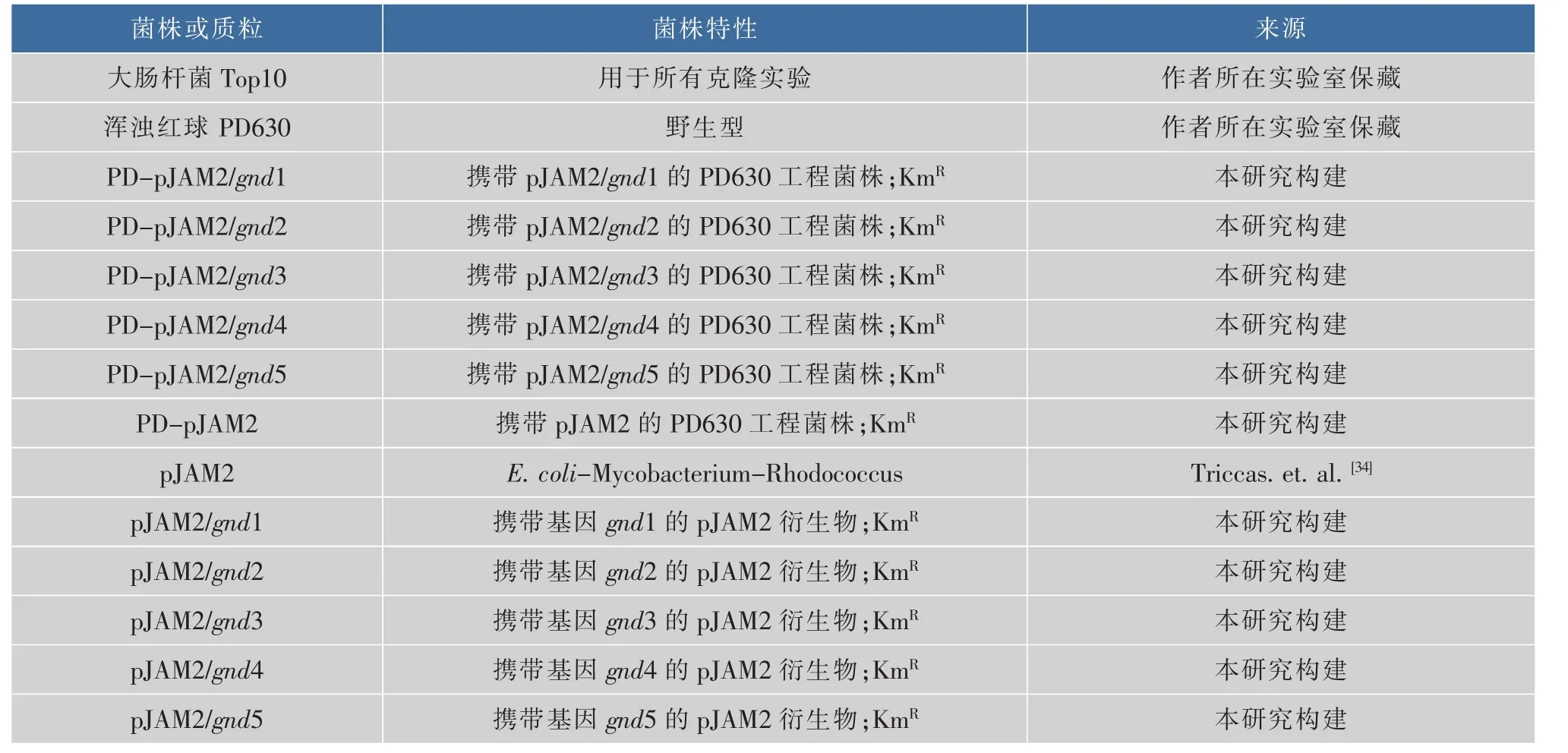
表1 本研究所有的菌株及质粒Table 1 Strains and plasmids used in this study
1.3 R.opacus PD630的电击转化
R.opacus PD630的电击转化所用感受态细胞的制作方法:从划线平板上挑取单菌落于含有0.85 g/dL甘氨酸和1 g/dL蔗糖的LB培养基中培养,当其OD值达到0.6时,在4℃条件下离心收集菌体,冰浴10 min,离心后用预冷的无菌水洗涤一次,再用10 g/dL预冷甘油重悬菌体后分装至1.5 mL的无菌EP管中,于-80℃保存。电击转化方法在Kalscheuer等[12]报道的基础上做一些优化。具体方法为:100 μL感受态细胞与 5 μL DNA混合后,40℃水浴5 min,冰上放置10 min后立即转移至电极间隙尺寸为2 mm的预冷电击杯中进行脉冲电击(电击条件:25 μF,2.4 kV/cm,600 Ω)。 电击之后的混合液转接至1mLLB培养基中,在28℃下培养4h,之后取少量菌液均匀涂布到含50 μg/mL Km的LB固体选择性培养基中培养3~5 d得到阳性转化子,用对应的引物MF/MR(扩增目的基因)和aceF/aceR(扩增乙酰胺酶启动子基因)进行菌液PCR验证。
1.4 脂质分析
离心收集48、72、96 h的菌体并用0.9 g/dL的NaCl溶液清洗两次,置于-80℃预冷,之后进行冷冻浓缩干燥。准确称取冷冻干燥之后的菌粉8~10 mg于4 mol/L的盐酸中水解,之后用氯仿/甲醇(体积比2∶1)进行萃取,为定量分析加入正十三烷酸(C13∶0)作为内标,质量分数 10%的盐酸/甲醇对其进行甲酯化处理。甲酯化之后的样品取10 μL进行气相分析,气相程序设置为:起始温度为60℃,以10℃/min的速度升温到120℃,停留3 min,再以5℃/min的速度升温到190℃,之后以4℃/min的速度升温至220℃,停留20 min,N2作为载气,流量为3 mL/min。

表2 本研究用到的引物名称及序列Table 2 Oligonucleotides used as PCR primers in this study
1.5 相关基因转录水平及酶活力的分析
对于过表达重组菌株gnd基因转录水平的分析,收集48、72、96 h的菌体,4℃条件下离心收集发酵培养的菌体,收集的菌体立即于-80℃保存用于后续转录水平分析。RNA的提取和cDNA的分析所用的方法基于Hoynes等[35]建立方法的基础上做一些改进。为了定量分析,用能够在相近菌种Rhodococcus jostii RHA1中稳定表达的DNA聚合酶IV作为内参[36]。转录水平倍数的计算根据Schmittgen和Livak[37]建立的公式计算得出。
6PGDH酶活力的分析测定所用的细胞粗提取物用Tang等[38]改进过的标准方法。离心收集菌体用去离子水清洗两遍,在液氮下进行研磨之后用BufferA (100 mmol/L KH2PO4/KOH,pH 7.5 含有 20 g/dL甘油,1 mmol/L盐酸苯甲脒和1 mmol/L DTT)悬浮。提取悬浮液于4℃、10 000 g离心30 min,上清液用作酶活力的测定。蛋白质质量浓度用Bradford[39]法确定。
2 结果与讨论
2.1 gnd过表达重组菌株的构建
由NCBI公布的R.opacus PD630的全基因组序列,可以查找到编码6PGDH的同源基因有5个,将它们分别命名为 gnd1(894 bp)、gnd2(1 455 bp)、gnd3(1 452 bp)、gnd4(912 bp)和 gnd5(882 bp)。图1是质粒pJAM2,含有乙酰胺酶启动子,其下游有BamHI和XbaI两个酶切位点供插入目的基因,并且带有可作为选择性标记的Km抗性基因。以R.opacus PD630的基因组为模板,利用对应的引物体外扩增出目的基因片段,克隆到质粒pJAM2上,获得过表达6PGDH的重组质粒pJAM2/gnd1、pJAM2/gnd2、pJAM2/gnd3、pJAM2/gnd4 和 pJAM2/gnd5。然后,通过电击转化的方法将这些重组质粒及空质粒pJAM2分别转化到R.opacus PD630中,再将这些转化子在含Km的选择性培养基上培养,以获得所需的过表达重组菌株和对照菌株。

图1 用于携带目的基因的质粒pJAM2的结构Fig.1 Structure of plasmid pJAM2-gene for target geneoverexpressing in R.opacus PD630
为了验证目的基因是否成功转入R.opacus PD630中,以MF/MR和aceF/aceR为引物,重组菌株和对照菌株的基因组为模板进行PCR验证,其PCR扩增片段结果见图2。由图2可知,目的基因已经成功转入R.opacus PD630中。选取每个过表达基因的3个转化子进行发酵培养,每个过表达重组菌株中产脂量最高的一株 (命名为PD-pJAM2/gnd1、PD-pJAM2/gnd2、PD-pJAM2/gnd3、PD-pJAM2/gnd4、PD-pJAM2/gnd5 和对照菌株 PD-pJAM2)用于后续实验。

图2 转化子的PCR验证Fig.2 PCR confirmation of transformants
2.2 gnd过表达重组菌株脂质积累的分析
为了分析gnd过表达重组菌株脂质积累的情况,将筛选出的过表达重组菌株分别在MSM培养基中进行发酵培养,收集48、72、96 h的菌体用于提取脂质。过表达重组菌株和对照菌株的总脂肪酸质量分数见图3。从图3可以看出,各个过表达重组菌株的总脂肪酸质量分数与对照菌株相比均有显著的提高。脂质质量分数增加最多的菌株是PD-pJAM2/gnd3,其总脂肪酸质量分数在48 h时高达31.98%,比对照菌株提高了27.8%。而且,过表达重组菌株的总脂肪酸质量分数随着培养时间的增加而逐渐降低,重组菌株的生物量在48 h(对数生长期的后期)时,其总脂肪酸质量分数达到最高,与之前Hernández等[10]的研究结果相符。

图3 在24、48、72 h不同时间点过表达菌株和对照菌株的总脂肪酸质量分数Fig.3 Totalamountoffattyacidscontentin the overexpressing strains and controlstrain at 24,48,72 h
由此可见,过表达gnd能够促进R.opacus PD630的脂质积累。之前已有很多研究发现,oxPPP是脂质生物合成所需还原力NADPH的主要来源,在产油真菌高山被孢霉[10]和卷枝毛霉[24]中过表达oxPPP相关酶的重组菌株脂质含量均提高了20%以上;也有很多在原核生物中研究oxPPP相关酶对NADPH的影响[40-42]。有研究表明,在大肠杆菌中过表达G6PDH比过表达6PGDH能够更有效地产生NADPH[20]。然而在R.opacus PD630中以葡糖糖为碳源的培养条件下通过G6PDH的碳流量高达90%以上[13],因此过表达G6PDH达到增加NADPH产量的空间不大。作者通过过表达6PGDH来增加脂质合成所需的还原力NADPH,实验结果也证明过表达6PGDH能够促进了R.opacus PD630的脂质积累量,这为我们进一步研究R.opacus PD630脂质合成机制提供了可靠的依据。
2.3 gnd过表达重组菌株6PGDH酶活力及gnd转录水平的分析
为了分析过表达重组菌株6PGDH酶活性的情况,分别收集了 48、72、96 h的菌体对其进行6PGDH酶活力的测定,结果见图4。由图4可知,过表达重组菌株的6PGDH酶活力显著高于对照菌株,且随着培养时间的延长其酶活力不断增加。

图4 在 24、48、72 h不同时间点过表达菌株和对照菌株6PGDH的酶活性Fig.4 Activities of 6PGDH in the overexpressing strains and control strain at 24,48,72 h
为了分析研究gnd过表达重组菌株gnd的转录水平,提取重组菌株和对照菌株的RNA进行RT-qPCR分析,结果见图5。由图5可知,重组菌株的gnd转录水平均较对照菌株提高了4~10倍。通过对过表达重组菌株脂质脂质积累量、酶活和转录水平的综合分析,目的基因gnd在过表达重组菌株中能够正常地转录与翻译,并且过表达重组菌株通过提高6PGDH酶活力以产生更多的还原力NADPH,从而促进其脂肪酸的合成。

图5 在24、48、72 h不同时间点过表达菌株和对照菌株gnd1,gnd2,gnd3,gnd4 和 gnd5 的表达水平Fig.5 Expression levels of gnd1,gnd2,gnd3,gnd4 and gnd5 genes in the overexpressing strains and control strain at 24,48,72 h
3 结语
本研究R.opacus PD630过表达重组菌株中6PGDH酶活力及编码基因gnd的转录水平较对照组均有所提高,且脂质积累量较对照组也提高了20%~30%。这些结果都表明在R.opacus PD630中,由6PGDH产生的NADPH能够促进其脂肪酸的生物合成,从而使R.opacus PD630能够积累更多的脂肪酸,也为更好地了解其脂质生物合成的机制提供了依据。我们还需要进一步研究在R.opacus PD630中其它能够产生还原力NADPH的酶对脂质积累的作用,从而增大其成为第二代生物柴油生产菌株的可能性。

