阻塞性睡眠呼吸暂停低通气综合征患者血清HIF-1α、EPO 水平与认知的相关性
罗婧 郭军红
1山西医科大学(太原030001);2山西医科大学第一医院(太原030012)
亚致死性缺氧事件可以改善组织、器官对致死性缺氧损伤的耐受性产生脑保护效应,被称为缺氧预处理(hypoxic preconditioning,HPC)。目前,缺氧预处理的神经保护作用被认为涉及多因素、多机制共同参与[1-2]。缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)可促进细胞对一些应激性损伤产生适应[3-5]。促红细胞生成素(erythropoietin,EPO)可在星形胶质细胞和神经元中表达[6],能减少缺氧缺血损伤,发挥脑保护作用[7-11]。阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)主要特点是间歇性低氧,在形式上类似缺氧预处理模型。本实验采用OSAHS 人群作为HPC 模型,观察不同程度的OSAHS 人群体内HIF-1α及EPO的含量变化,不同程度的OSAHS 人群认知功能损害情况,并对HIF-1α及EPO 的含量变化与认知功能损害的相关性进行分析。
1 对象与方法
1.1 研究对象2018年1月至2018年7月就诊于山西医科大学第一医院呼吸内科,并行多导睡眠图检测确诊为OSAHS 患者60 例,诊断标准符合2011年中华医学会呼吸病学分会OSAHS诊治指南,并依据呼吸暂停低通气指数(apnea-hyponea index,AHI)分为轻度组(5 次/h ≤AHI<15 次/h),中度组(15次/h ≤AHI<30次/h)和重度组(AHI ≥30次/h)。每组患者各20 例,年龄20 ~76 岁。选取同期健康体检者20 例为对照组。所有病例均排除慢性阻塞性肺疾病、肺间质纤维化、哮喘、肺叶切除术后及其他长期慢性缺氧者、严重心力衰竭、严重精神障碍、急慢性感染性疾病、恶性肿瘤、结核病、结缔组织病、代谢性疾病及肝、肾功能不全、脑血管意外。80 例研究对象均符合入选条件和排除条件进入研究,并征得所有研究对象的知情同意。本研究通过山西医科大学第一医院医学伦理委员会批准。
1.2 研究方法
1.2.1 多导睡眠监测(polysomnography,PSG)被检查者检查前2 天内不得服用镇静催眠药、饮茶、饮酒及咖啡等。2 周内未患有上呼吸道感染性疾病。每个研究对象在监测当天不睡午觉,来院后休息30 min,测量身高、体质量,在睡眠呼吸实验室按平时生活习惯入睡。用多导睡眠监测仪对受试者自晚21 时至次日晨7 时行至少7 h 监测,监测指标:口鼻气流、胸腹运动、脑电图、心电图、眼动图、下颌肌电图、鼾声、体位、腿动、SaO2,晨起后再次测量动脉血压并做好记录。
1.2.2 认知功能评定采用IQCODE 量表对受试者进行认知功能评估,量表评估认知功能损害,包括近期记忆力和远期记忆力、空间和时间定向力、计算力、学习能力及执行能力情况。
1.2.3 血液标本准备抽取次日晨醒后患者外周静脉血,2 mL 放置含乙二胺四乙酸试管中混匀,4 ℃,3 000 r/min 离心15 min,取上层血清置于-80 ℃冰箱中冷冻保存。
1.2.4 HIF-1α 浓度测定应用双抗体夹心ELISA法检测。人HIF-1α 定量检测试剂盒购自cloudclone公司,操作步骤按照说明书。
1.2.5 EPO 浓度测定应用双抗体夹心ELISA 法检测。人EPO 定量检测试剂盒购自cloud-clone 公司,操作步骤按照说明书。
1.3 统计学方法应用SPSS 21.0对数据进行统计分析,计量资料的统计描述采用均数±标准差进行表示,计数资料的统计描述采用频数、百分比进行描述;疾病危险因素的分析,首先进行单因素分析,根据资料类型选用秩和检验。多因素分析时,选取单因素分析有统计学意义的因素,根据资料类型选用累积Logistics回归进行分析。计量指标之间相关关系的研究采用pearson秩相关分析。临界值的选取,采用ROC曲线进行分析,P <0.05差异有统计学意义。
2 结果
2.1 各组临床资料比较单因素分析:各组年龄、体质量指数、性别、吸烟、饮酒、收缩压、舒张压方面,差异无统计学意义(P>0.05);AHI、血氧饱和度差异有统计学意义(P<0.001,表1)。累积Logistics回归分析:疾病严重程度分为4 类,以疾病严重程度为应变量,以单因素分析有意义的因素最低血氧饱和度和AHI 得分情况为自变量,应用累积Logistics 回归对疾病严重程度进行多因素分析,首先对变量进行赋值(表2),分析结果显示最低血氧饱和度和AHI 对疾病严重程度有影响(表3)。OSAHS 患者疾病程度越重,体内缺氧水平越高,提示采用OSAHS 人群作为HPC 模型是合理的。
表1 OSAHS 影响因素单因素分析Tab.1 Single factor analysis of the influencing factors of OSAHS ±s,例

表1 OSAHS 影响因素单因素分析Tab.1 Single factor analysis of the influencing factors of OSAHS ±s,例
Z年龄(岁)性别(男/女)吸烟(有/无)饮酒(有/无)体质量指数(kg/m2)收缩压夜间平均值(mmHg)舒张压夜间平均值(mmHg)AHI 分段(轻/中/重度)最低血氧饱和度正常44.35±15.15 14/6 10/10 11/9 26.76±3.12 125.80±17.89 79.80±12.07 20/0/0 0.88±0.04轻度49.80±10.02 15/5 11/9 11/9 27.40±4.69 131.60±16.59 84.00±11.11 20/0/0 0.82±0.05中度50.35±12.27 16/4 11/9 12/8 28.18±3.30 130.30±20.16 85.45±10.78 0/20/0 0.73±0.14重度50.80±10.89 15/5 10/10 12/8 28.55±3.16 131.50±10.34 86.30±7.79 0/0/20 0.62±0.15-1.38-0.35 0.00-0.32-1.45-1.18-1.65-6.25-5.40 P 值0.17 0.73 1.00 0.75 0.15 0.24 0.10 0.00 0.00

表2 变量赋值表Tab.2 Variable assignment table
2.2 各组血清HIF-1α和EPO 水平比较重度组、中度组血清HIF-1α、EPO 水平高于轻度组、正常组血清HIF-1α、EPO水平(图1、2)。HIF-1α、EPO参与了缺氧预处理的应激过程,且与缺氧程度呈正相关(rHIF-1α=0.95,rEPO=0.89,表4)。

表3 最低血氧饱和度和AHI 累积Logistics 回归分析Tab.3 Minimum blood oxygen saturation and AHI cumulative logistic regression analysis

图1 各组血清HIF-1α 水平比较Fig.1 Comparison of serum HIF-1α levels in each group

表4 HIF-1α、EPO 与各组的相关性分析Tab.4 Correlation analysis between HIF-1α,EPO and each group
2.3 各组IQCODE 评分比较重度组、中度组IQCODE 总分高于轻度组、正常组的IQCODE 总分,IQCODE 总分在各组之间差异有统计学意义(P<0.001)。认知功能的损害主要体现在远期记忆力、学习能力方面。近期记忆力、空间和时间定向力、计算力、执行能力各组间差异无统计学意义(P>0.05,表5)。提示OSAHS 患者较正常人存在一定的认知功能损害,主要体现在远期记忆力和学习能力方面。

图2 各组血清EPO 水平比较Fig.2 Comparison of serum EPO levels in each group
2.4 HIF-1α和EPO 水平与IQCODE 评分及各亚相评分的相关性分析经spearman 秩相关分析,HIF-1α和EPO 水平均与远期记忆力、IQCODE 总分呈正相关(P<0.05,表6)。
2.5 HIF-1α、EPO 水平与认知功能评估的受试者工作特征曲线分析对OSAHS 组的认知功能与HIF-1α、EPO 水平进行受试者工作曲线(receiver operating characteristic cure,ROC)分析,当EPO=182.775 时,曲线下面积最大为0.80,可以作为临界点,当EPO ≥182.775 时,认知功能评分较高,认知功能损害较为严重(图3、表7)。当HIF-1α=67.44时,曲线下的面积最大为0.81,可以作为临界点,可以认为当HIF-1α ≥67.44 时,认知功能评分较高,认知功能损害较为严重(图4、表8)。当EPO ≥182.775,HIF-1α ≥67.44 时,提示其对认知功能损害的诊断有一定的准确性。
表5 各组IQCODE 各项评分比较Tab.5 Comparison of IQCODE scores of each group ±s
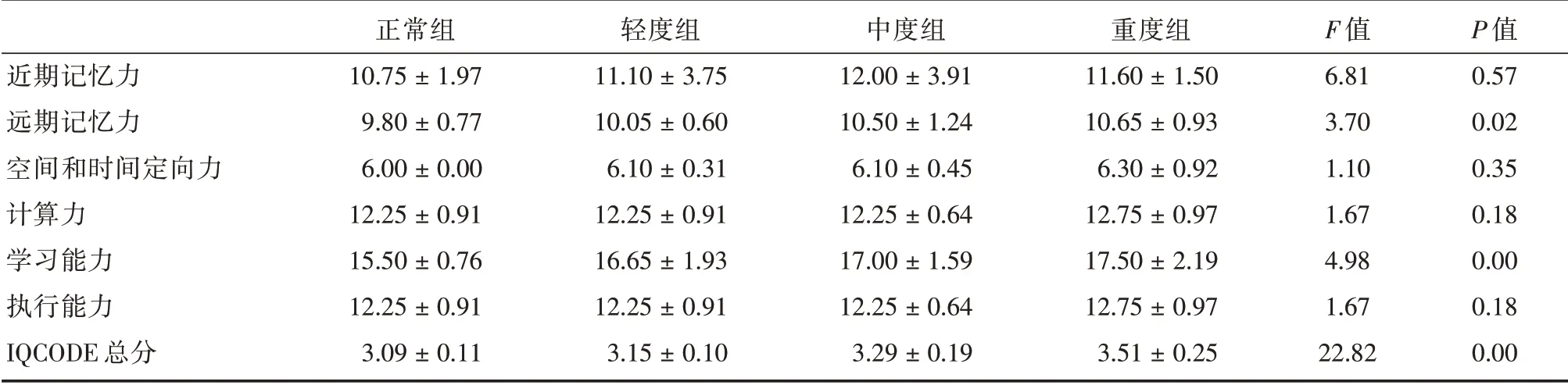
表5 各组IQCODE 各项评分比较Tab.5 Comparison of IQCODE scores of each group ±s
近期记忆力远期记忆力空间和时间定向力计算力学习能力执行能力IQCODE 总分正常组10.75±1.97 9.80±0.77 6.00±0.00 12.25±0.91 15.50±0.76 12.25±0.91 3.09±0.11轻度组11.10±3.75 10.05±0.60 6.10±0.31 12.25±0.91 16.65±1.93 12.25±0.91 3.15±0.10中度组12.00±3.91 10.50±1.24 6.10±0.45 12.25±0.64 17.00±1.59 12.25±0.64 3.29±0.19重度组11.60±1.50 10.65±0.93 6.30±0.92 12.75±0.97 17.50±2.19 12.75±0.97 3.51±0.25 F 值6.81 3.70 1.10 1.67 4.98 1.67 22.82 P 值0.57 0.02 0.35 0.18 0.00 0.18 0.00

表6 HIF-1α、EPO 与IQCODE 各项评分的相关性分析Tab.6 Correlation analysis between HIF-1α,EPO and IQCODE scores
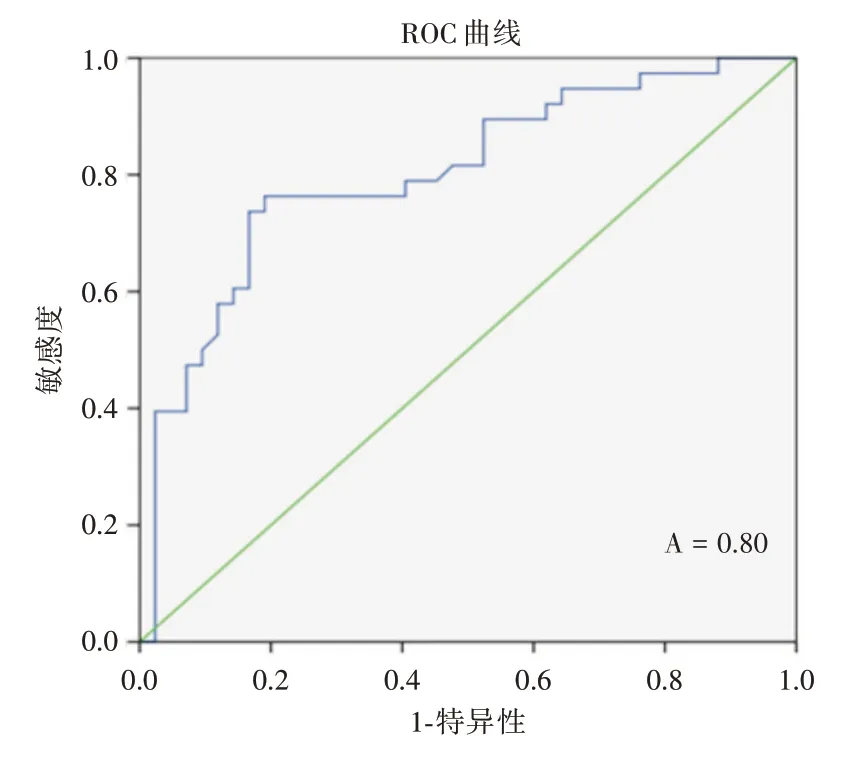
图3 EPO 与认知功能损害的ROC 曲线Fig.3 ROC curve of EPO and cognitive impairment

表7 曲线下的面积Tab.7 Area under the curve
3 讨论
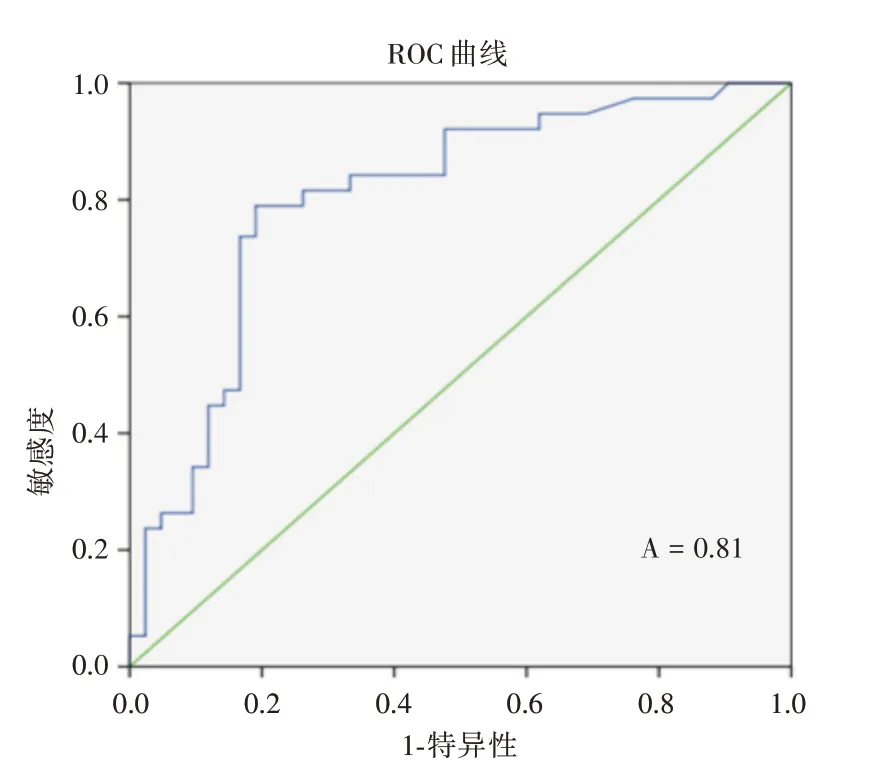
图4 HIF-1α 与认知功能损害的ROC 曲线Fig.4 ROC curve of HIF-1α and cognitive impairment

表8 曲线下的面积Tab.8 Area under the curve
HIF-1α是一种氧敏感性转录调节因子,通过激活下游血小板内皮生长因子、诱导型NO合成酶、EPO 等转录因子的表达,在缺氧预适应中发挥重要作用。ZHU 等[12]实验证实,HPC 增加新生动物和成年动物脑组织中HIF-1α的表达,与本实验结果一致。QIAO 等[13]报道通过间歇性缺氧实验建立高海拔环境模型小鼠,与对照组小鼠相比,可诱导HIF-1α表达增加,在随后三根血管闭塞引起的脑缺血后,表现出更强的认知功能。而加入HIF-1α抑制剂则可完全阻断HIF-1α的生成及预缺氧的保护作用。以上结果显示,HIF-1α的连续激活,是缺氧预处理加速小鼠脑缺血后认知功能恢复所必需的。
EPO 最初被认为是受缺氧调节的造血生长因子,由肾脏分泌,调节血液中红细胞的生成[14]。近年来研究发现,星形胶质细胞和神经元中也有EPO 合成[2]。体内外实验表明,脑缺血缺氧时,受HIF-1 刺激内源性EPO 及EPOR 表达增加[15-17]。杨清洁等[18]实验提示,EPO 的神经保护作用可能通过激活JAK/STAT 信号转导途径减少神经元凋亡实现的。RONDON 等[19]认为,炎症机制参与认知功能减退过程,而EPO 通过降低脑中IL-6 致炎因子起到认知保护作用。另外研究提示[20]EPO 增加TGF-β1 的表达,激活缺血半暗带血管内皮细胞与碱性成纤维细胞生长因子,二者同巨噬细胞一起诱导血管增生,减轻认知功能障碍严重程度,促进认知功能恢复。
本研究结果提示,OSAHS 患者的HIF-1α、EPO水平高于对照组,且OSAHS 程度越重,HIF-1α、EPO 水平越高,提示HIF-1α、EPO 参与缺氧反应的应激过程,与既往研究结果相符。在一定程度上OSAHS 患者认知功能障碍的严重程度与HIF-1α和EPO 水平存在相关性,且当HIF-1α ≥67.44,EPO ≥182.775 时,即中重度OSAHS 患者认知功能损害较严重。血清HIF-1α 和EPO 可能是OSAHS患者认知障碍程度的一个初步判断的生化指标。当HIF-1α<67.44,EPO<182.775 时,即当患者处于轻度OSAHS 及以下时,患者缺氧程度较轻,HIF-1α 和EPO 由于其神经保护作用,患者认知功能未见明显损害。提示要对OSAHS 患者进行积极治疗,改善缺氧,降低HIF-1α和EPO 水平至临界值以下,防止患者出现认知功能损害。本研究提示,OSAHS 患者的认知功能损害主要体现在远期记忆力和学习能力方面。当患者出现远期记忆力、学习能力下降时,提示患者可能的认知功能损害,应及时予以干预,对提高OSAHS 患者生存质量有重要意义。

