黄芪三萜皂苷对心肌重构细胞模型的保护作用
寿鸿飞 刘晶 刘天龙 张铭杰 刘小雷
1乌兰察布市中心医院药剂部(内蒙古乌兰察布012000);2内蒙古医科大学附属医院药剂部(呼和浩特010030);3内蒙古医科大学药理学教研室(呼和浩特010110)
心肌重构是心脏在多种病理刺激下出现的结构和功能改变,以心室容积增加、心肌纤维化及心脏舒张和收缩功能障碍作为主要的临床症状[1]。心肌重构是最常见的高血压靶器官损害,其作为独立危险因素伴随在进行性心衰和梗死性心律失常的整个病理变化中[2]。目前,虽然多种基因、蛋白及非编码RNA 被报道与心肌重构的发生相关,但心肌重构的发病机制尚不明确,临床上仍以控制血压为主要的治疗手段[3-5]。虽然降压治疗能够显著地降低高血压患者发生心肌重构的风险,但很多高血压患者在较好控制血压的条件下仍会出现心肌重构表型,说明控制血压对心肌重构的防治效果并不理想[6]。因此,系统地研究心肌重构的干预手段对于有效地预防和治疗高血压心衰具有重要的意义。
黄芪是蒙古黄芪干燥的根,具有止汗、滋补和利尿等功效,为内蒙古自治区的道地药材[7]。目前,临床上有近百种与黄芪有关的中、蒙药方剂和中成药广泛地用于心血管疾病的预防和治疗,如芪冬颐心口服液、芪参胶囊及当归黄芪汤等[8-9]。黄芪三萜皂苷(Astragalus triterpenoid,AST)是黄芪的重要活性成分,其具有抗炎、抗凋亡、抗氧化应激及保护内皮功能等作用,但关于AST 对心肌重构的保护作用及机制目前还鲜有关注[10-11]。文献报道显示,炎症反应、心肌细胞凋亡、氧化应激及内皮功能障碍与心肌重构的发生有着密切的关系,因此,笔者推测AST 可能对心肌重构具有保护作用[12]。本研究以AST 为研究对象,在体外系统地研究其对心肌重构的保护作用及机制,这对于寻找心肌重构新的干预靶点和治疗手段具有重要的意义。
1 材料与方法
1.1 实验细胞及药物乳小鼠的原代心肌细胞和心肌成纤维细胞由本课题组分离和培养;重组人血管紧张素II(A9525)购于Sigma 公司;AST(781-200311,纯度>98%)购于中国生物制品鉴定所。
1.2 心肌细胞和心肌成纤维细胞的分离及培养依据文献报道的方法分离和培养原代心肌细胞和心肌成纤维细胞,在细胞水平研究AST 对AngII诱导心肌细胞肥大和心肌成纤维活化的保护作用[13]。简言之,使用0.062 5%的胰酶在37 ℃不断搅拌下对心肌组织进行逐次消化,每次消化5 min,每次消化完成后将含有细胞的消化液加入到10%FBS 的DMEM/高糖培养基中以终止胰酶活性。消化完成后,合并收集的细胞悬液,1 000 ×g 离心5 min。使用含10%FBS 的DMEM/高糖培养基重悬细胞并将细胞接种于10 cm 皿中,在37 ℃,2.5%CO2的条件下进行差速贴壁2 h。差速贴壁完成后,贴壁的心肌成纤维细胞继续使用含10%FBS 的DMEM/高糖培养基进行培养,48 h 后传代得到心肌成纤维细胞。未贴壁的心肌细胞直接以5 ×103个/孔和1 × 105个/孔的浓度分别接种于12 孔板和6 孔板中,48 h 后更换培养基并观察心肌细胞搏动情况。
1.3 心肌重构细胞模型的建立及AST 干预本部分实验共设3 个实验组,即Blank 对照组,AngII 诱导组及AST 干预组。将心肌细胞和心肌成纤维细胞培养48 h 后,更换FBS-free DMEM/高糖培养基饥饿细胞24 h以进行同步化。同步化后,Blank组细胞更换新的FBS-free DMEM/高糖培养基继续培养,AngII 组细胞使用含有10-6mol/L AngII 的FBSfree DMEM/高糖培养基诱导心肌细胞肥大和心肌成纤维细胞活化,AST 干预组细胞先使用含有100 μmol/LAST 的FBS-free DMEM/高糖培养基预处理细胞90 min,预处理结束后,更换含有10-6mol/L AngII 和100 μmol/L AST 的FBS-free DMEM/高糖培养基。12 孔板细胞培养24 h 后提取RNA 以检测相关因子的表达水平,6 孔板细胞培养48 h 后提取蛋白以检测Wnt 信号通路关键蛋白β-Catenin 的表达水平。
1.4 心肌细胞鬼笔环肽染色培养心原代肌细胞48 h 后,按1.3 描述的方法使用AngII 诱导心肌细胞肥大并使用AST 进行干预。AST 干预48 h 后,弃去培养基并使用37 ℃预热的PBS 清洗贴壁细胞2 次。每孔加入3.7%的多聚甲醛200 μL 室温固定心肌细胞10 min,固定完成后使用PBS 洗涤心肌细胞2 次。弃掉培养板中的PBS,每孔加入200 μL 荧光标记的鬼笔环肽染色剂,室温避光反应20 min。染色完成后,DAPI 封片并在荧光显微镜下观察和拍照,使用Image J 软件检测心肌细胞表面积。
1.5 Real-time PCR检测相关因子的表达水平设计和合成用于检测心肌细胞和心肌成纤维细胞中α-SMA、Col1α1、Col3α1、ANP、BNP、TGF-β、Wnt-1、Wnt-3α、fz2、Dvl1、Dvl2 表达水平的上、下游引物,利用Real-time PCR 检测上述因子的表达水平。以GAPDH 作为内参,采用Quante Studio Soft 1.3 软件通过2-△△Ct法进行相对定量分析。
1.6 Western Blot 检测使用Western Blot 检测心肌细胞中Wnt 信号关键蛋白β-Catenin 及成纤维细胞中α-SMA、Col1α1 及Col3α1 的表达水平。Western Blot实验操作依据文献记录的方法进行[14]。使用10%的分离胶和浓缩胶对蛋白进行电泳,电泳完成后进行转膜,转膜条件为300 mA,80 min。转膜完成后,切下含有目的条带NC 膜,使用5%脱脂牛奶室温封闭1 h。封闭完成后,将抗体加入到含有相应目的条带的孵育盒中,4 ℃孵育过夜,抗体的稀释倍数为1 000,抗体稀释液为TBST。一抗孵育完成后,TBST 清洗NC 膜3 次,每次5 min。加入HRP 标记的羊抗兔二抗,室温孵育1 h后进行显色。
1.7 统计学方法采用SPSS 19.0 软件进行统计分析。计量资料采用± s 表示,统计方法采用单因素方差分析,组间比较采用SNK 法。P<0.05 表示差异具有统计学意义。
2 结果
2.1 AST 对AngII 诱导的心肌细胞肥大具有显著的保护作用10-6mol/L AngII 诱导心肌细胞24 h后,AngII 诱导组细胞ANP 和BNP 的表达水平分别是正常心肌细胞的2.4 倍和3.1 倍,而两者在AST干预组心肌细胞中的表达水平分别是正常心肌细胞的1.23 倍和1.36 倍,组间比较具有显著差异(P <0.05,图1A)。心肌细胞鬼笔环肽染色结果显示,AngII 诱导组心肌细胞的表面积是正常心肌细胞的2.5倍,而AST 干预组心肌细胞的表面积是正常心肌细胞的1.13 倍,组间比较具有显著性差异(P <0.05,图1B)。上述结果说明,AST 对AngII 诱导的心肌细胞肥大具有显著的保护作用。
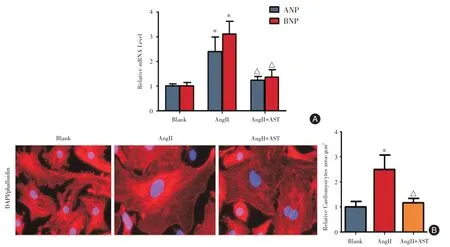
图1 AST 对AngII 诱导的心肌细胞肥大的保护作用Fig.1 Protective effect of AST on AngII-induced cardiomyocyte hypertrophy
2.2 AST 对AngII 诱导的心肌成纤维细胞活化具有显著的保护作用qPCR 检测结果显示,AngII诱导心肌成纤维细胞24 h 后,α-SMA、Col1α1 和Col3α1 在心肌成纤维细胞中的表达水平显著增加,其相对表达量分别是正常心肌成纤维细胞的3.25 倍、2.17 倍及2.2 倍,而AST 干预组心肌细胞中三者的相对表达水平分别是正常心肌细胞的1.31 倍、1.23 倍及1.05 倍,组间比较差异具有统计学意义(P <0.05,图2A),相似的结果也被Western Blot 检测所证实(P <0.05,图2B)。上述结果说明,AST 对AngII 诱导的成纤维细胞表型转化和活化具有显著的抑制作用。

图2 AST 对AngII 诱导的心肌成纤维细胞活化的保护作用Fig.2 Protective effect of AST on AngII-induced fibroblast activation
2.3 AST 对AngII 诱导的Wnt 信号在心肌细胞中的活化和TGF-β在心肌成纤维细胞的表达具有显著地抑制作用qPCR 结果显示,AngII 诱导心肌细胞和心肌成纤维细胞24 h 后,Wnt-1、Wnt-3α、fz2、Dvl1 和Dvl2 在心肌细胞及TGF-β在心肌成纤维细胞中的表达水平显著增加,而AST 对此有显著地抑制作用(P <0.05,图3A、B)。Western blot 结果显示,AST 对AngII 诱导的β-Catenin 在心肌细胞中的表达具有显著的抑制作用(P <0.05,图3B、C)。上述结果说明,AST 对AngII 诱导的心肌细胞肥大的保护作用与其抑制Wnt 信号活化有关,而AST 对AngII 诱导的成纤维细胞活化的保护作用与其抑制TGF-β表达有关。

图3 AST 对Wnt 信号通路相关蛋白在心肌细胞中的表达和TGF-β 在心肌成纤维细胞中的表达具有显著地抑制作用Fig.3 inhibitive effect of AST on expression level of Wnt related protein in cardiomyocyte and TGF-β in Fibroblasts
3 讨论
本研究初步在体外验证了AST 对AngII 诱导心肌重构的保护作用,结果显示,AST 对AngII 诱导的心肌细胞肥大和心肌成纤维细胞的活化具有显著的抑制作用,这与其抑制AngII 诱导的Wnt 信号在心肌细胞中的活化和TGF-β在心肌成纤维细胞中的表达有关。
A 型心房钠尿肽(ANP)和B 型尿钠肽(BNP)是一种由心房合成、贮存和分泌的活性多肽,具有强大的利钠、舒张血管、降低血压和对抗肾素-血管紧张素系统和抗利尿激素作用。当心脏压力负荷和容量负荷增加时,心房会反射性的合成和分泌ANP 和BNP 以减轻前、后负荷和改善心功能。因此,ANP 和BNP 常作为判断心功能是否受损的标志物在很多心肌重构相关的研究中被检测[15]。本研究发现,在10-6mol/L AngII 刺激心肌细胞24 h后,ANP 和BNP 的表达水平显著增加,而AST 对此有显著的抑制作用,说明AST 对AngII 诱导的心肌细胞损伤具有保护作用。此外,在长期的机械压力和其它病理因素刺激下,心脏成纤维细胞逐渐转化为肌成纤维细胞,转化后,其增殖活性、α-SMA 和胶原合成能力显著增加,大量的胶原堆积在细胞外基质(ECM)而影响心脏的正常结构和功能。因此,本研究检测的成纤维细胞α-SMA、col1α1 和col3α1 表达水平常作为病理条件下成纤维细胞活化的标志物,而AST 对AngII 诱导的成纤维细胞的活化具有显著的抑制作用[16]。
Wnt 信号在心肌发育和病理性心肌重构的发生过程中扮演重要的角色,特别是经典的Wnt/GSK-3β/β-Catenin 通路已被证实参与多种病因诱导的心肌重构[17]。Wnt 是一种分泌型脂质修饰的糖蛋白,其能够与细胞表面受体Frz receptor 结合,通过经典的Wnt 途径和非经典的Wnt 途径调节心肌细胞的发育和肥大反应。β-Catenin 是细胞中重要的钙离子依赖型第二信使,胞质中的β-Catenin常与其它蛋白相互作用形成复合物及被磷酸化失去稳定性而被降解[18]。当Wnt 分泌增加时,其与细胞表面受体相互作用后将活化GSK-3β,活化的GSK-3β将抑制β-Catenin 复合物的形成和磷酸化而稳定β-Catenin,非磷酸化的β-Catenin 进入细胞核作为重要的转录调节因子促进多种与心肌重构有关的基因表达[19]。在本研究中,AngII 诱导心肌细胞24 h 后,Wnt 信号相关蛋白Wnt-1、Wnt-3α、fz2、Dvl1 和Dvl2 表达水平显著增加,而AST 对此有显著的抑制作用,说明AST 对AngII 诱导的心肌细胞Wnt 信号的活化具有显著的抑制作用。
TGF-β信号通路在AngII 和压力诱导的病理性心肌纤维化中扮演重要的角色。研究显示,TGF-β能够通过Wnt/β-catenin 信号通路促进心肌的纤维化和与纤维化相关基因的表达[20-21]。体外研究显示,TGF-β能够通过抑制MMP 的表达及促进MMP抑制基因的表达直接诱导细胞外基质的沉积[22]。β-Catenin 作为是TGF-β信号的重要下游因子,其能够有效地调节胶原和其他ECM 的表达[21]。本研究发现,AST 对AngII 诱导的TGF-β在心肌成纤维细胞中的表达具有显著的抑制作用,这可能是其保护心肌纤维化的重要机制。
本研究发现,AST 在体外对AngII 诱导的心肌重构具有显著的保护作用,但体外研究与体内研究尚存在很大的差异。因此,下一步将在动物水平验证AST 对心肌重构的保护作用并通过心肌组织转录组测序寻找AST 保护心肌重构的干预靶点。

