Caspase-3 基因过表达抑制LN-18 人神经胶质瘤细胞移植瘤生长
葛风 蒋云召 王泳
无锡市第三人民医院神经外科(江苏无锡214000)
神经胶质瘤是目前临床上最常见脑肿瘤,约占所有颅内原发肿瘤的一半,每年新增约14 万病例,65 岁以上人群发病率明显增高[1]。由于晚期肿瘤浸润性生长,与脑组织间无明显边界,难以做到全部切除,一般都主张综合治疗,患者5年生存期不足20%[2]。针对神经胶质瘤发病率高、复发率高和病死率高的特点,有必要探索新的治疗手段,以延长其生存期和改善患者生存质量。细胞凋亡与神经胶质瘤进展密切相关,如何诱导神经胶质瘤细胞凋亡已成为近年来研究热点。caspase-3 蛋白是促细胞凋亡关键酶,通过调节凋亡信号通路传导,促进细胞凋亡[3]。本研究构建caspase-3 基因过表达慢病毒载体,并转染LN-18 人神经胶质瘤细胞,观察caspase-3 蛋白过表达对LN-18 人神经胶质瘤细胞移植瘤生长作用的影响,为caspase-3 蛋白在神经胶质瘤治疗应用提供实验依据。
1 材料与方法
1.1 实验材料人LN-18 人神经胶质瘤细胞购自上海榕柏生物技术有限公司;胎牛血清、细胞培养基、青霉素-链霉素、细胞培养耗材和胰蛋白酶均购自美国赛默飞生命科技公司;FITC 标记的TUNEL 细胞凋亡检测试剂盒购自上海生物工程有限公司;鼠抗人单克隆caspase-3 抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗鼠IgG 均购自美国Abcom 公司;兔抗鼠β-actin 单克隆抗体购自美国sigma 公司。蛋白电泳仪为美国Bio-Rad 公司产品。上海吉玛基因公司提供caspase-3 基因相关产品和慢病毒载体。
1.2 构建caspase-3 转染慢病毒在线搜索caspase-3 基因信息,设计模板序列基因,上游引物序列:5′-CCCGAATAAGAGAGAACCAAC-3′,下游序列:5′-CATTCCTTATATGTCTCCGTAC-3′,PCR 反应条件:预变性(94 ℃)2 min;变性(94 ℃)45 s,退火(55 ℃)25 s,延伸(72 ℃)35 s,共35 次循环,延伸(72 ℃)6 min,抽提GV128 质粒,利用自失活型慢病毒包装系统,将包装质粒pHelper1.0、pHelper2.0和caspase-3 基因载体质粒共转染239T 细胞,转染48 h 后,1 000 r/min 高速离心,收集含caspase-3 基因慢病毒颗粒细胞上清液,-80 ℃保存备用。
1.3 体外转染LN-18人神经胶质瘤细胞待细胞融合至90%,0.25%胰蛋白酶消化,1 000 r/min 离心收集细胞,细胞重悬后以1 × 105个/mL 接种48 孔板。LN-18 人神经胶质瘤细胞最佳转染复数为150,设置3 组,其中添加5 μg/mL Polybrene 和50 μL caspase-3 基因重组病毒上清液为转染组,添加5 μg/mL Polybrene + 50 μL 阴性对照病毒上清液为对照组和不添加病毒上清液为空白组,37 ℃孵育10 h,更换细胞培养液,继续孵育。
1.4 免疫印迹法检测caspase-3 蛋白表达蛋白裂解液收集蛋白,检测样品总蛋白浓度(BCA 法),高温致蛋白变性,80 V SDS 聚丙烯酰胺凝胶电泳分离蛋白并转膜2 h,5%牛血清蛋白封闭1 h,切割薄膜,加入1∶300 鼠抗人单克隆caspase-3 抗体,4 ℃孵育过夜,加入1∶1 000 HRP 标记羊抗鼠二抗室温孵育30 min,1∶1 000稀释β-Actin 作为内参,显色定影,软件分析杂交条带。
1.5 构建LN-18 人神经胶质瘤移植瘤裸鼠模型待LN-18 细胞生长至对数期,胰蛋白酶消化细胞,离心收集细胞,1640 培养基重悬细胞(密度1×108个/mL),将上述细胞悬液注射至裸鼠背部皮下,200 μL/只,细胞数量约2 × 107个,共设转染组、对照组和空白组,每组5 只裸鼠,每3 天记录肿瘤大小情况,比较各分组瘤块体积,瘤块测量用长径(a)×短径(b)表示,单位cm,肿瘤体积=0.5×a×b2,接种21 d 后处死实验动物,取出瘤块,测量对比各组肿瘤体积。
1.6 肿瘤组织内细胞凋亡测定取出各分组肿瘤组织,甲醛固定,石蜡包埋,切片机制备5 μm 蜡块切片,梯度酒精法脱蜡入水,置于0.2%曲拉通溶液破膜10 min,PBS 缓冲液清洗3 遍,加入25 μL TUNEL 细胞凋亡检测液,25 ℃避光孵育60 min,PBS 缓冲液清洗3 遍,荧光显微镜下观察并拍照,利用IPP 软件测定各组荧光积分光密度(integral optical density,IOD),以空白组为对照计算相对IOD 值。
1.7 统计学方法以(± s)表示实验结果,采用单因素多样本方差分析比较多组间均值,采用t 检验比较两组间均值差异,P <0.05 为差异有统计学意义。
2 结果
2.1 细胞转染效率测定慢病毒载体可携带多种荧光标记,体外转染LN-18 人神经胶质瘤细胞72 h,流式细胞仪上样检测细胞转染率达到83.7%(图1 A),倒置显微镜下观察转染LN-18 人神经胶质瘤细胞(图1B),荧光显微镜下观察到满视野绿色荧光分布(图1C),证实其具备后续实验应用的可行性。
2.2 caspase-3蛋白表达转染组、对照组和空白组caspase-3 蛋白相对表达量分别为(1.259 ± 0.238)、(0.181±0.079)和(0.147±0.069),转染组caspase-3蛋白水平显著增加(P <0.001),对照组与空白组差异无统计学意义(P >0.05,图2)。

图1 体外慢病毒转染LN-18 人神经胶质瘤细胞Fig.1 LN-18 human glioma cells were transfected by lentivirus in vitro
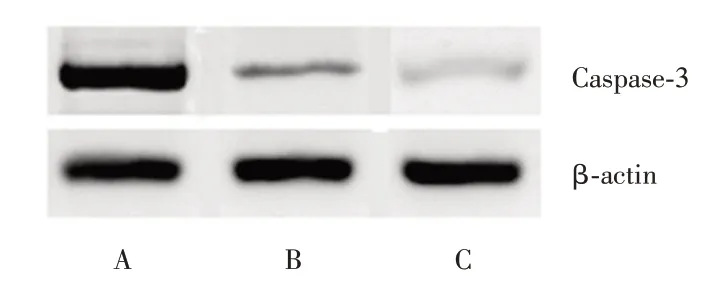
图2 各组Caspase-3 蛋白表达Fig.2 The expression of Caspase-3 protein in each group
2.3 肿瘤生长曲线测定每隔3 d 测量各组肿瘤生长体积,对比各分组肿瘤体积随时间变化情况,至皮下移植21 d,转染组、对照组和空白组瘤块体积分别为(0.52 ± 0.17)、(2.61 ± 0.22)和(2.38 ±0.19)cm3,(F=104.241,P=0.021 89),表明肿瘤生长受到明显抑制(图3)。
2.4 细胞凋亡分析本研究采用FITC 标记凋亡信号,当绿色信号越高时,表明细胞凋亡越明显。移植皮下成瘤21 d 后,转染组、对照组和空白组荧光强度分别为(6 572±1 319)、(908±199)和(875 ± 262),转染组细胞凋亡数目显著高于空白组和对照组,差异具有统计学意义(图4,P <0.001)。
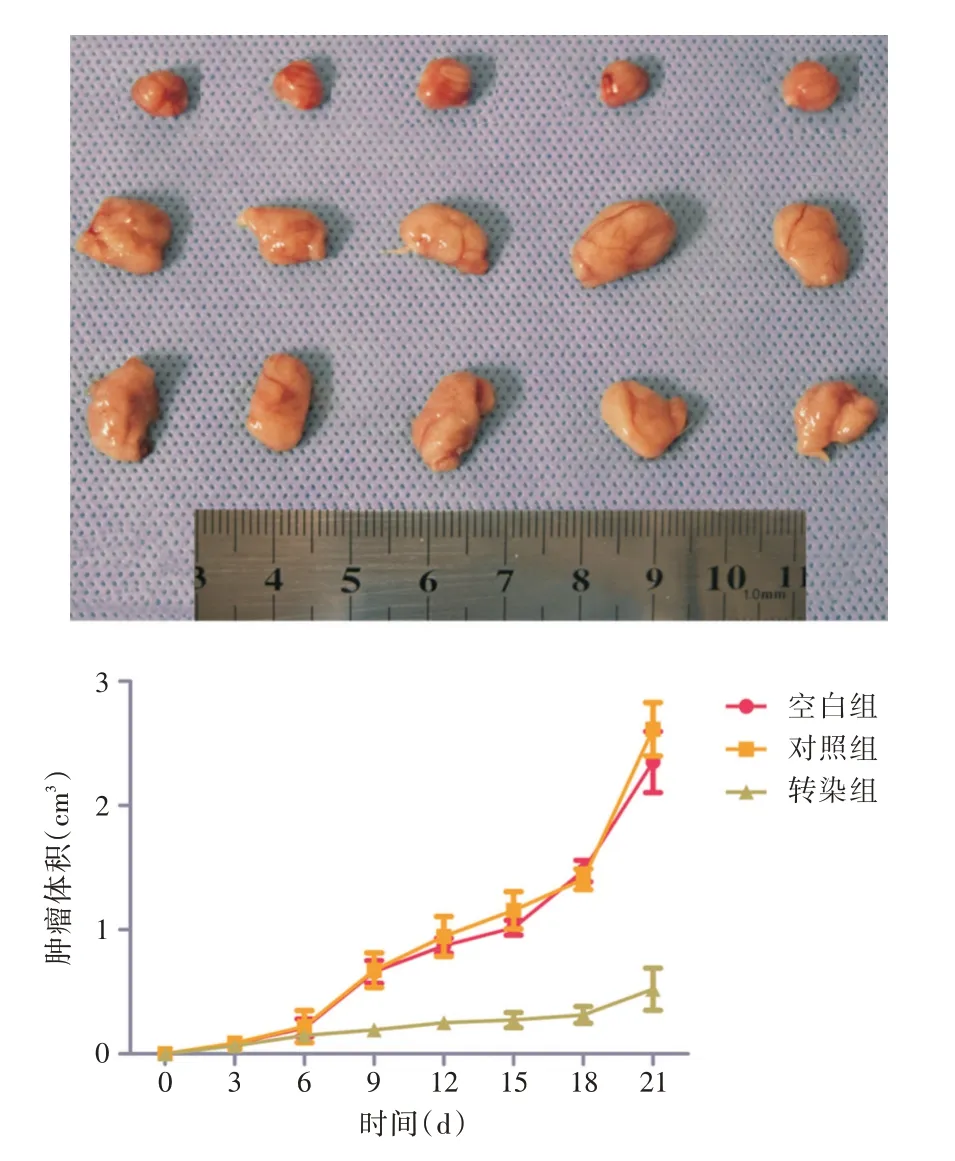
图3 肿瘤生长体积测定Fig.3 Tumor growth volume determination

图4 细胞凋亡率测定(×100)Fig.4 The measurement of cell apoptosis
3 讨论
细胞凋亡是细胞自主程序性死亡,其中涉及多种基因的激活、表达以及调控,在肿瘤发生发展过程中起着重要作用[4]。细胞凋亡与肿瘤细胞分化程度、肿瘤组织学分级、淋巴转移程度和肿瘤临床分期均存在显著相关性[5]。诱导肿瘤细胞凋亡被认为是治疗癌症的创新思路。细胞凋亡均伴随着caspase 基因激活和异常表达,caspase-3 蛋白是细胞凋亡信号传导关键环节,活性caspase-3 可降解相应的胞浆胞核底物,诱导细胞凋亡,当caspase-3 活性受到抑制,则出现细胞凋亡异常,从而诱发肿瘤[6]。caspase-3 蛋白在神经胶质瘤组织中高表达,阳性率达到78.85%(41/52),而正常组织caspase-3 蛋白阳性率仅15.38%(2/13)[7]。同时,药物诱导的神经胶质瘤细胞凋亡常常伴随着caspase-3基因激活和caspase-3 蛋白高表达,暗示其为诱导神经胶质瘤细胞死亡过程中的一项重要环节[8]。另外,神经胶质瘤肿瘤分期越高,caspase-3 蛋白阳性表达率越低,这提示caspase-3 蛋白表达水平与神经胶质瘤恶性程度及患者预后呈负相关[9]。基于以上事实,拟利用基因工程技术促caspase-3 蛋白过表达,则有望治疗神经胶质瘤。
慢病毒属是反转录病毒科下的一种分支,可产生更加稳定的体外转染效果,通过细胞表面受体和慢病毒膜糖蛋白相互作用进入宿主细胞,可使其持续表达目的蛋白[10]。脂质体和质粒是目前实验室常用转染剂,其操作方法简单,但两者细胞转染率均较低,生物安全性不高,且存在较明显细胞毒性[11-12]。与之相比,慢病毒转染效率明显升高,且与转染靶细胞类型密切相关,通常可达50%~80%[13]。笔者利用慢病毒转染LN-18 人神经胶质瘤细胞,体外转染实验中,利用流式细胞仪检测GV128 慢病毒载体转染效率高达83.7%,笔者推测这种高转染效率与本研究选用的LN-18 细胞类型密切相关,LN-18 胶质瘤细胞活性强,其慢病毒转染率随之升高。观察caspase-3 基因过表达对于移植瘤生长的影响是本研究的重点和难点。既往有学者采用慢病毒瘤体注射方式,但这种方式存在试剂浪费,注射不均匀,体内转染效率低且无法准确检测等诸多缺陷[14-15]。本研究在体外预先利用caspase-3 基因过表达慢病毒转染LN-18 人神经胶质瘤细胞,随后再皮下注射移植成瘤,则可避免慢病毒瘤体注射缺陷,使实验过程变得更为清晰和可控。体内结果证实,转染组细胞凋亡率明显增加,肿瘤生长体积明显受到抑制。
综上,通过基因重组技术构建caspase-3 基因过表达慢病毒载体,体外转染人LN-18 人神经胶质瘤细胞,可显著促进LN-18 人神经胶质瘤细胞凋亡,明显抑制肿瘤生长,具有良好的神经胶质瘤治疗应用潜力。

