莱菔硫烷抑制前列腺癌细胞增殖及迁移的实验研究
刘小明 周葳 杨补
1广州医科大学附属第五医院骨科一区(广州510799);2广州医科大学附属第三医院骨科一区(广州510150);3中山大学附属第三医院脊柱外科(广州510630)
前列腺癌是欧美等发达国家最常见的男性恶性肿瘤。近年来,随着我国人民生活水平的提高,前列腺癌的发病率呈现上升趋势,且往往发现时已为进展期[1]。莱菔硫烷(sulforaphane,SFN)是一种富含于十字花科植物内的天然化合物,人类日常饮食中的白菜、花菜、芥菜等十字花科植物中都含有SFN。SFN 也是十字花科植物中苦味的主要来源,研究发现SFN 对多种昆虫有致死毒性,在植物体内,可能是作为一种防止动物啃咬的保护性的物质[2]。进年来的研究发现SFN 有多种生物活性作用,例如保护心肌[3-4]、抑制肿瘤发生等[5]。早年的流行病学研究发现食用十字花科植物可以降低多种肿瘤的发生率,进一步研究发现SFN 为十字花科植物中主要的抗肿瘤因子[7]。目前国外研究证实SFN 可能通过诱导凋亡等途径抑制多种肿瘤细胞的生长[6-9]并对多种肿瘤细胞增殖有明显的抑制作用[10-11]。但目前其对前列腺癌的作用及其作用机制尚不明确。本研究拟进一步探寻SFN 对前列腺癌细胞的作用。
1 材料及方法
1.1 材料人前列腺癌细胞株均购自美国ATCC公司:BPH(良性前列腺增生上皮细胞株),22-RV1(前列腺癌原位肿瘤),PC3(骨转移灶细胞株),DU145(脑转移灶细胞株)LNCap(盆腔淋巴结转移灶)。SFN 购自美国西格玛奥德里奇公司。细胞培养所用胎牛血清及PRMI medium 1640 培养基购自美国Gibco 公司。CCK8 细胞增殖检测试剂盒购自中国凯基生物公司。PI 染色试剂及Transwell 小室购自美国BD 公司,primary rabbit anti-Bax 单克隆抗体及primary rabbit anti-Bcl-2 单克隆抗体购自美国CST 公司,Rabbit anti-GAPDH 多克隆抗体购自中国博奥森公司。HRP-goat anti-rabbit IgG 购自中国杰特伟公司。ECL 发光试剂盒及NC 膜购自美国Millipore 公司。实验动物为4 ~5 周BALB/C雄性裸鼠,购自中山大学实验动物中心。免疫组化试剂盒购自中杉金桥公司。
1.2 细胞培养前列腺癌细胞株陪养均采用10%FBS 及90% PRMI medium 1640 培养基,37 ℃、5%CO2环境陪养。取对数生长期细胞进行实验。
1.3 细胞增殖实验SFN 根据实验中相应浓度培养基稀释。取对数生长期BPH,22RV1,PC-3,DU145 及LNCap 细胞悬液,接种于96 孔板,每孔接种2 000 个细胞,200 μL 培养基,实验设每孔分别含有0、5、10、20 μmol/L SFN。加药后48 h CCK8法测定细胞增殖率。Graphpad Prism 5.0 软件绘制生长图。实验过程重复3 次。
1.4 细胞周期试验取对数生长期PC-3、DU-145及LNCap 细胞悬液,接种于6 孔板,每孔接种数为2×105个细胞,各细胞孔分别加入0、10、20 μmol/L SFN。加药后48 h 胰酶消化细胞,PBS 洗2 遍后70%冰乙醇重悬,-30 ℃固定24 h。离心后PBS 清洗2 遍,行PI 染色后流式细胞仪检测,Flowjo7.6 软件分析结果,ModFit LT 5.0 软件分析细胞周期。实验过程重复3 次。
1.5 迁移试验采用孔径0.8 μmol/L transwell 小室及24 孔板铺板,LNcap 及DU145 细胞各105铺小室内,各孔分别加入0、10、20 μmol/L SFN,铺板后48 h 后PBS 清洗小室1 遍,4 ℃甲醇固定20 min 后行结晶紫染色,去除上室细胞,倒置显微镜观查,每孔随机选取3 个视野细胞计数。实验重复3 次。
1.6 Western blotSFN 各0、10、20 μmol/L 处理48 h 后 的PC3、DU145 及LNCap 细 胞 提 取 总 蛋 白行Western blot 检测。采用SDS-PAGE 蛋白电泳,NC 膜转膜后5%脱脂奶粉TBS-T 封闭1 h 后一抗及二抗孵育。ECL 发光试剂盒检测目的蛋白表达,GAPDH 为内参校准。Western 实验结果采用Imagine J 软件量化,Graphpad Prism 5.0 软件绘制量化图。
1.7 动物实验裸鼠随机分为对照组及实验组各7 只,建模方法采用左侧背部皮下接种5 × 105个PC-3 细胞(悬液50 μL,含25 μL PBS,25 μL matrigel)。建模后2 周开始予以药物干预:实验组每隔2 天给予50 μg SFN(10 μL)瘤体内注射,对照组予以10 μL PBS 瘤体内注射。接种后每周测量肿瘤最长径(a)及横径(b),肿瘤体积按V=1/2ab2计算。接种后6 周处死动物,完整取下瘤体10%中性甲醛溶液固定。
1.8 组织实验皮下瘤组织常规行HE染色。免疫组化采用胃蛋白酶修复法,操步骤按试剂盒说明操作,染色后常规树脂封片后倒置显微镜拍片,免疫组化结果由3 名高年资病理科医生盲法评分,评分标准为0-无信号,1-轻度表达,2-中度表达,3-高度表达。评分为随机选取3 个镜下观察视野,计算每组的平均得分。
1.9 统计学方法克隆形成实验、细胞周期实验及迁移实验结果采用方差分析,免疫组化评分采用Kruskal-Wallis秩和检验。P <0.05代表差异具有统计学意义。
2 结果
2.1 SFN对前列腺癌细胞增殖的影响SFN对5种前列腺癌细胞株增殖均表现出了明显的抑制作用(P<0.05),对转移灶细胞株LNcap(盆腔淋巴结转移),PC3(骨转移)及DU145(脑转移)的抑制作用明显高于增殖率较低的BPH(原位增生)及22RV1(原位癌)细胞株(图1)。
2.2 SFN 对前列腺癌细胞周期及迁移能力的影响3种转移灶细胞株SFN处理后均诱导出明显的G0期停滞,G2/M明显缩短(图2)。SFN对DU145 及LNcap 细胞株迁移能力表现出明显抑制(P<0.05,图3)。
2.3 SFN 对Bax/Bcl-2 蛋白表达的影响Western blot 结 果 示PC3、DU145 及LNCap 均 表 达Bax 及Bcl-2,SFN 显 著 降 低DU145 及LNCap 的Bcl-2 表达,促进Bax 表达(图4)。
2.4 SFN 对小鼠体内肿瘤生长的影响两组动物操作中均无死亡及感染,术后6 周两组动物均存活良好。实验组术后3 周开始肿瘤体积明显小于对照组(P<0.05,图5),组织学HE 染色示两组肿瘤细胞均呈现染色较浅的大核细胞,部分细胞呈现多核形态。实验组肿瘤组织部分可见空泡及凋亡,对照组细胞生长出现极性紊乱,瘤内血管生成明显。免疫组化结果示Bax/Bcl-2均为细胞质内表达,实验组Bax 表达较对照组增高(P<0.05),Bcl-2 表达较对照组降低(P<0.05,图6)。

图1 SFN 对不同侵袭力前列腺癌细胞株增殖的影响Fig.1 The effects of SFN on PCa cells proliferation(CCK8 test)
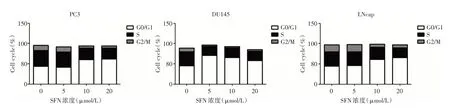
图2 SFN 对前列腺癌细胞株增殖周期的影响Fig.2 The effects of SFN on PCa cells proliferating cycle

图3 SFN 对LNCap、DU145 细胞迁移能力的影响Fig.3 The effects of SFN on LNcap and DU145cells migration
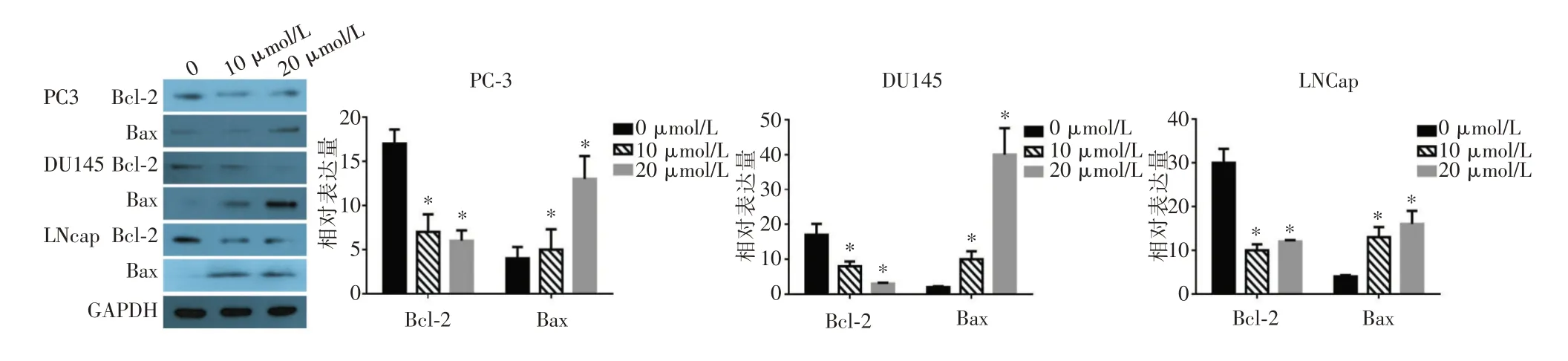
图4 不同浓度SFN 对各细胞株Bax/Bcl-2 蛋白表达的影响Fig.4 The effects of different concentrations of SFN on PCa cells Bax/Bcl-2 expression

图5 SFN 对荷瘤小鼠肿瘤大小的影响Fig.5 The effects of SFN on tumorigenesis of tumor mouse model
3 讨论
本研究从细胞及动物水平验证SFN 对前列腺癌的影响,细胞实验结果提示SFN 能抑制前列腺癌细胞的增殖及侵袭,诱导肿瘤细胞凋亡。SFN明显抑制肿瘤细胞Bcl-2 蛋白表达,促进Bax 表达,动物实验结果示SFN 抑制前列腺癌皮下瘤的生长,SFN 瘤内注射可引起肿瘤组织凋亡,Bcl-2 表达降低。细胞实验中,SFN 对低侵袭性细胞株增殖无明显影响,对转移灶细胞株的增殖及侵袭均表现出明显的抑制作用,细胞凋亡明显增加。这种表观现象似乎也与各细胞株间的Bax/Bcl 表达量有关,既往研究也提示Bax/Bcl-2 在正常及良性前列腺增生组织中低表达,而Bcl-2 在恶性前列腺癌组织中高表达[7]。提示SFN 对前列腺癌细胞的抑制增长作用与细胞的侵袭性相关,并可能通过Bax/Bcl 途径发挥其生物学作用。
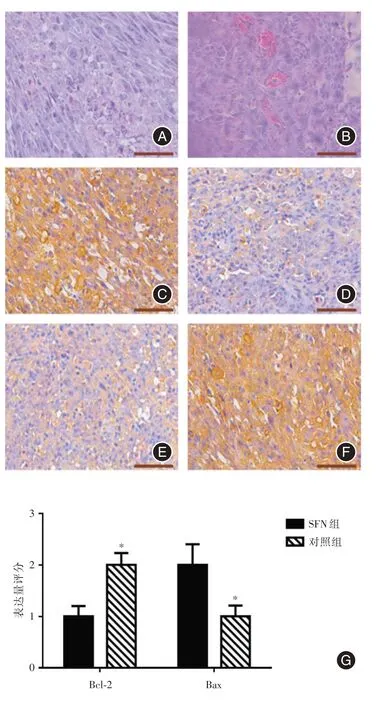
图6 组织学结果Fig.6 Histology result
SFN 对肿瘤细胞的抑制作用可能与诱导肿瘤细胞凋亡、抑制环氧化酶2,抑制肿瘤血管生成及组蛋白修饰有关[11-14],而诱导凋亡可能是SFN 肿瘤抑制作用的主要因素[11]。Bcl-2 是肿瘤抗凋亡的重要的因子,研究发现多种天然抗肿瘤成分均影响肿瘤细胞Bcl-2 的活性[8]。然而,SFN 也可能通过其他途径发挥诱导凋亡的作用,例如,MI 等[15]发现SFN 能够通过抑制SAPK 的活性而引起人非小细胞肺癌A549 细胞的凋亡等,提示SFN 可能在不同的细胞内通过不同的蛋白通路发挥作用。因此,SFN 对前列腺癌细胞的生物学作用,如相关细胞受体、下游相关的蛋白信号通路等尚需进一步研究。
总之,本研究发现SFN 对前列腺癌细胞增殖及侵袭的抑制作用,SFN 对低侵袭性的肿瘤细胞无明显的毒性作用,也提示SFN 可能作为一种新的肿瘤转移的抑制因子,该研究为临床前列腺癌的治疗提供一个潜在的药物治疗靶点。

