基于In-fusion技术的高通量HIV表型耐药检测系统的建立及应用研究
刘峰颜苹苹王征桦谢美榕严延生
随着我国艾滋病(AIDS)疫情的不断上升以及免费抗病毒治疗标准的进一步放宽(发现即治疗)[1],越来越多的HIV/AIDS患者纳入治疗,HIV耐药的产生和传播将不可避免。HIV耐药性已逐渐成为威胁抗病毒治疗可持续性发展的主要因素。国际AIDS协会已推荐将HIV耐药性检测纳入AIDS的临床管理中[2]。此外,随着治疗时间的延长以及新药的研发和应用,新的耐药突变位点将不断产生及突变位点之间的相互作用更加复杂化,这对现有HIV耐药检测技术提出了新的挑战。目前国际上发展较为成熟并且应用于临床的有基因型和表型耐药检测。基因型耐药检测由于具有简便、快速、费用低等优点常用于临床耐药检测,但是在对复杂突变点组合的判断、突变点之间相互作用、新的耐药突变位点鉴定等情况,无法提供可靠的耐药信息,对结果解释比较困难。基于此,表型耐药检测方法将发挥重要作用。目前商业化表型耐药检测试剂盒主要有Virologic 公司的PhenoSenseGTTM系统,VIRCO公司的Antivirogram系统和法国Viralliance 公司的PhenoScript TM系统[3]。虽然,商业化试剂盒在很大程度上简化了检测步骤,提高了检测的可重复性,但并未明显地降低检测的周期,更重要的是其耐药检测范围比较小。为此,本研究将在前期自我构建的HIV-1表型耐药检测系统(pLWJ-SV40-Luc+/VSV-G)[4]基础上对骨架质粒pLWJ-SV40-Luc进行改造,同时引进In-fusion 定向连接克隆技术替代酶切连接,以便通过优化降低本底质粒污染,同时实现高通量快速无缝连接,并将其应用于临床样本检测,通过表型与基因型耐药检测结果比较以评估其临床应用效果。
1 材料与方法
1.1临床样本来源 研究对象来自福建省接受抗病毒治疗失败和未治疗的HIV/AIDS患者的EDTA抗凝全血,分装血浆,冻存于-80 ℃。
1.2主要材料与试剂 膜蛋白表达质粒VSV-G,293T细胞,HIV骨架质粒pLWJ-SV40-Luc由本实验室构建并保存[5];pUC-19质粒、In-fusion无缝连接酶、E.coli DH5α(宝生物,大连);BshTI(AgeI)和AarI限制性内切酶(Fermentas,美国);LipofectamineTM2000转染试剂盒(Invitrogen公司,美国);Bright-GLoTM荧光素酶检测系统(Promega公司,美国);QIAamp Viral RNA Mini Kit试剂(Qiagen公司,德国);引物合成与测序由上海铂尚生物技术有限公司完成;
1.3新的HIV耐药检测骨架载体的构建 以pUC-19质粒为模板扩增LacZ基因片段,上游引物5In LacZ:5′-GACTATGTAGACCGGTTTTACACTTTATGCTTCCGGCT-3′,下游引物3InLacZ:5′-CACCTGCCATCTGTTCTATGCGGCATCAGAGCAG-3′。反应条件为98 ℃2 min;98 ℃ 10 s,55 ℃15 s,68 ℃ 30 s,30个循环;68 ℃ 10 min。PCR产物切胶回收。将HIV-1骨架载体pLWJ-SV40-Luc经AgeI/AarI双酶切,纯化回收线性化载体,利用In-fusion无缝连接酶与LacZ基因进行连接,50 ℃ 15 min,连接产物转化E.coliDH5α,次日挑取蓝色菌落,摇菌提取质粒用AgeI/AarI双酶切进行鉴定,将酶切正确的阳性克隆进行双向测序鉴定。
1.4耐药检测片段的扩增 扩增所用引物,内外侧上游引物AgeI:5′-ACCCTTTAGAGACTATGTAGACCGGTTCTWTAAAACTYTMAGAG-3′;外侧下游引物Vif-HB:5′-CCTTTTCTCCTGTCTGCAGACCCCAATATG-3′;内侧下游引物AarI:5′-GTCTACTTGCCACACAATCAKCACCTGCCATCTGTTTTC-3′。扩增区域(共3 364 bp)包括:Gag区p7-p1-p6 protease cleavage sites,全长PR、RT、RNase及Integrase的1-280aa。提取血浆病毒RNA,进行RT-nested PCR扩增。第一轮扩增引物为AgeI/Vif-HB,反应条件为94 ℃3 min;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 4 min,30个循环;72 ℃ 7 min。第二轮扩增引物为AgeI /AarI,反应条件为94 ℃3 min;94 ℃ 30 s,59 ℃ 45 s,72 ℃ 4 min 35个循环;72 ℃ 7 min。PCR产物送上海铂尚生物有限公司进行测序。将序列进行拼接、编辑整理后上传到斯坦福大学HIV 耐药数据系统进行耐药相关突变分析。
1.5耐药检测载体(RTV)的构建 将新的HIV耐药检测骨架载体pLWJ-SV40-Luc-LacZ经相应的限制性内切酶(AgeI/AarI)进行双酶切,纯化回收线性化载体,并与纯化后的耐药检测片段按一定比例用In-fusion无缝连接酶进行定向连接,50 ℃ 15 min,将连接产物转化DH5α感受态细胞,涂板于已加入X-gal和IPTG的kan+抗性LB平板,次日挑取白色菌落进行菌落PCR鉴定。挑取PCR扩增正确的阳性克隆菌落,摇菌培养,次日提质粒鉴定,将阳性质粒(即耐药检测载体)进行测序证实。主要构建流程(图1)如下。
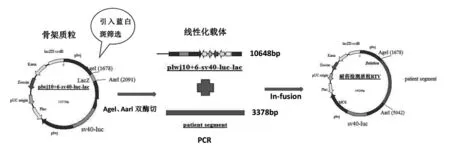
图1 耐药检测载体(RTV)的构建Fig.1 Flow chart for the construction of the RTV
1.6HIV假病毒感染活性的鉴定 采用脂质体转染法,将耐药检测载体RTV和膜蛋白表达质粒VSV-G,按质量比2∶1的比例共转染293T细胞,制备HIV-1假病毒,同时设HIV骨架质粒载体作为对照。按LipofectamineTM2000(invitrogen)转染试剂盒说明书进行操作。转染48 h后收集上清,经0.45 μm滤器过滤,将部分过滤的转染上清(即HIV假病毒)感染293T细胞,培养48~72 h后,收集感染细胞,利用Bright-Glo Luciferase Assay试剂测定每孔感染细胞的萤光素酶(Luc+)的相对荧光单位(RLU)来鉴定假病毒感染活性。
1.7 HIV表型耐药检测
1.7.1逆转录酶抑制剂药物敏感性检测 本研究采用的逆转录酶抑制剂有AZT、TDF、3TC、NVP、EFV。将药物按10×倍比稀释铺入96孔板中,终体积为50 μL,其中用50 μL DMEM培养基替代药物作为空白对照;每孔加入200TCID50HIV假病毒和5×104个293T细胞。每个药物稀释度均设3个复孔。置37 ℃,5% CO2培养48~72 h后,利用Bright-Glo Luciferase Assay试剂测定每孔细胞中相对荧光单位(RLU)。
1.7.2蛋白酶抑制剂的药物敏感性检测 本研究采用的蛋白酶抑制剂为LPV/r。将各临床样本构建好的耐药检测载体按上述方法进行转染试验,转染6 h后,弃上清,将药物按10×倍比稀释加入96孔板中,终体积为100 μL,其中用100 μL DMEM培养基替代药物作为空白对照。每个药物稀释度均设3个复孔。培养48~72 h后取上清100 μL感染新鲜的293T细胞,培养48~72 h后,利用Bright-Glo Luciferase Assay试剂测定每孔细胞中相对荧光单位(RLU)。
以上实验均设HIV骨架质粒pLWJ-SV40-Luc/VSV-G作为敏感株进行平行对照。
1.8稳定性实验 利用新HIV耐药检测骨架载体构建的RTV在不同时间重复4次测定不同药物的敏感性实验,以评估载体的稳定性。
1.9表型耐药结果分析 数据分析利用GraphPad Prism Software 5.01软件,采用非线性回归分析中剂量反应-抑制率来分析药物半数抑制剂量(IC50)及药物抑制曲线。抑制率计算公式:
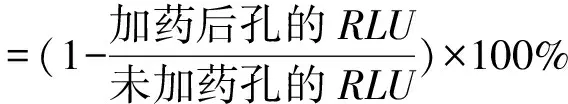
2 结 果
2.1新HIV耐药检测骨架载体的构建 以pUC-19质粒为模板用引物5InLacZ/3InLacZ扩增LacZ基因片段,大小约为460 bp,其中包含了能够表达LacZ包括启动子在内的完整片段、两端具有能够与骨架酶切载体连接的15 bp同源序列。利用In-fusion无缝连接酶,将纯化后的LacZ基因片段和经AgeI/AarI双酶切后的HIV骨架载体pLWJ-SV40-Luc连接起来,构建新的HIV耐药检测骨架质粒pLWJ-SV40-Luc-LacZ。挑取蓝色菌落提质粒进行AgeI/AarI双酶切鉴定,切下的片段大小约460 bp左右与预期相符。经过测序证实LacZ基因已成功替换原骨架载体的目标片段。
2.2HIV-1耐药检测片段的扩增及耐药相关突变位点的分析 用耐药扩增引物共扩增了抗病毒治疗前后临床标本36份(治疗前6份和治疗后30份),扩增片段大小约3 364 bp,如图2,阳性扩增样本有30份,总扩增率为83.33%。
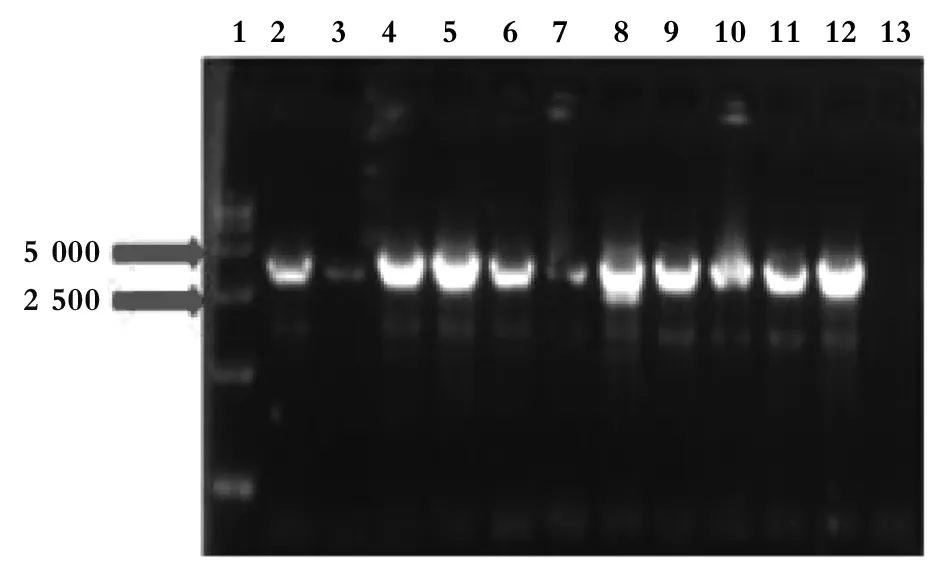
1:15 000 marker 2:YYL 3:HXM 4:DLJ 5:XYQ 6:CLM 7:ZZ 8: HJY 9:HYZ 10:HJW 11:LQQ 12:ZKZ 13:negative control图2 HIV耐药检测片段扩增Fig.2 PCR amplification of target fragments for HIV drug resistance test
2.3表型耐药检测载体的构建及其感染活性的鉴定 将纯化后的阳性耐药检测片段和经AgeI/AarI酶切后的新HIV骨架质粒载体pLWJ-SV40-Luc-LacZ通过In-fusion无缝连接将耐药检测片段替换骨架质粒载体上对应LacZ片段,构建相应的耐药检测载体RTV。通过蓝白斑筛选,各挑取10~20个白斑作菌落PCR鉴定(图3),扩增片段大小若约为5 000 bp,则预示表型耐药检测载体构建成功。最后经测序证实有26例临床样本成功构建出表型耐药检测载体,成功构建率是86.7%。假病毒感染活性实验结果显示有21例临床耐药样本表型耐药检测载体产生的假病毒具有感染活性。

1:15 000 marker;2-21为YYL1-20不同克隆株;22-25为HXM1-4不同克隆株图3 菌落PCR鉴定表型耐药检测载体构建情况Fig.3 Identification of phenotypic resistance test vector by colony PCR
2.4HIV基因型耐药检测结果 HIV耐药相关突变位点分析结果显示:21例样本中有16例发生了HIV耐药相关突变,其中15例发生1个及以上逆转录酶耐药相关突变,但只有1例发生蛋白酶次要相关突变Q58E,详见表1。从亚型分析显示本研究样本亚型涵盖我省绝大多数流行亚型,其中12例CRF01_AE,4例CRF07_BC,2例CRF55_01B,CRF08_BC、B、C各1例。基因型耐药分析结果显示:有7例针对1种及以上核苷类逆转录酶抑制剂耐药,9例对2种非核苷类逆转录酶抑制剂(NVP和EFV)均耐药,21例均对蛋白酶抑制剂(LPV/r)敏感,结果详见表2。
2.5HIV表型耐药检测结果 将上述构建的具有感染活性的21例临床表型耐药检测载体进行药物敏感性实验,由于所构建的HIV骨架质粒pLWJ-SV40-Luc+对所有药物均敏感,故将其作为野生型参考株进行对照。最终表型耐药结果是将其IC50与野生株的IC50进行比较,用IC50的倍增值(即FC值)来表示,结果见表2。
2.6HIV表型与基因型耐药检测结果比较分析 将表型耐药结果判定原则定为与野生株IC50相比,其FC值<4为敏感,>4倍为耐药。按照此判定原则,将表型与基因型耐药检测结果进行比较分析显示:本研究21例样本对6种国内常用抗病毒药物的表型耐药检测结果与基因型耐药检测结果完全一致,见表3。
2.7稳定性实验结果 随机抽取1例用新HIV耐药检测骨架载体构建的RTV在不同时间重复4次测定其对6种药物(3TC、TDF、AZT、LPV、EFV、NVP)的敏感性实验以评价此系统的稳定性。结果显示该表型耐药检测系统具有较高的稳定性,见表4。
3 讨 论
本研究通过对骨架质粒pLWJ-SV40-Luc进行改造,将LacZ蓝白斑筛选基因替换了原骨架质粒内表型耐药检测区域(包括Gag区p7-p1-p6 protease cleavage sites,全长PR、RT、RNase及Integrase的1-280aa共3364bp),从而构建新的HIV耐药检测骨架质粒pLWJ-SV40-Luc-LacZ。在此基础上将来自临床样本的耐药检测片段替换新骨架质粒内的LacZ基因片段,进而构建耐药检测载体RTV。由于AgeI和AarI在双酶切体系中效率分别为20%~50%和50%~100%,用此双酶切线性化旧的骨架质粒pLWJ-SV40-Luc时由于酶切不完全难以避免来自于本底骨架质粒的影响,最后构建出的RTV只能通过KpnI或XbaI单酶切或测序进行鉴别[5]。然而,通过此改造一方面避免来自本底骨架质粒pLWJ-SV40-Luc的影响,另一方面可通过蓝白斑筛选进行初筛,再通过菌落PCR即可完成对RTV的鉴定筛选,这不仅缩短检测时间、减少工作量、整体上提高了实验效率,而且也降低了实验成本;此外,通过引进In-fusion无缝克隆技术,不仅改善了克隆条件,50 ℃ 15 min即可完成定向克隆,便捷、高效且稳定,而且无需受酶切位点的限制,适用于任何载体,从而提高了RTV的构建效率,实现基因克隆的高通量。
表1 21份临床样本基因型耐药突变位点分析结果
Tab.1 Analysis of drug resistant-associated mutant loci in 21 clinical samples

Patient ID病毒载量(copies/mL)subtypePR MutationsRT MutationsmajorminorNRTINNRTIYYL/CRF07_BCnoneQ58ENoneNoneHXM4.01E+04CRF55_01BnonenonenoneE138G, V179EDLJ1.04E+04CRF01_AEnonenoneM184VnoneXYQ5.67E+04CRF01_AEnonenoneM184VY181C, G190ACLM4.97E+05CRF01_AEnonenoneM184VK101E, G190SZZR2.56E+05CRF01_AEnonenoneD67N, K70R, T215F, K219EY181I, N348IHJY3.43E+03CRF01_AEnonenoneM184VK101E, G190AHYZ/CRF01_AEnonenonenoneV179EHJW/CRF01_AEnonenoneT69GV179E, Y181CLQQ2.01E+04CRF07_BCnonenoneK219RnoneZKZ8.26E+04CnonenoneM184VK103NRLW9.41E+05CRF01_AEnonenonenoneY181CZLW/BnonenonenonenoneWKZ2.87E+03CRF01_AEnonenonenonenoneWXW/CRF07_BCnonenonenonenoneHJL/CRF08_BCnonenoneV75AnoneCJ1.88E+03CRF01_AEnonenonenonenoneQYE6.24E+03CRF01_AEnonenoneM184VK103NZMM4.79E+04CRF07_BCnonenonenoneP236LYY/CRF01_AEnonenonenoneV179TWFQ2.93E+03CRF55_01BnonenoneK219RV179E, P236L
注:“/”表示未检测。
表2 基因型与表型耐药检测结果比较
Tab.2 Comparison of phenotypic resistance test results and genotypic resistance test results

IDGenotypic Resistance(Level)Phenotypic Resistance(Level: Fold Increase of IC50)AZT3TCTDFEFVNVPLPV/rAZT3TCTDFEFVNVPLPV/rYYLSSSSSS 1.33 1.14 1.23 3.67 0.710.88HXMSSSLLS1.831.501.5811.67261.671.00DLJSHSSSS1.5074.320.65 2.67 1.661.38XYQSHSHHS2.8350.500.7794.00952.020.81CLMSHSHHS3.17197.323.38863.67919.251.19ZZRHPIIHS13.333.0023.00>1 000>1 0001.38HJYSHSHHS2.0041.363.31766.67381.581.69HYZSSSPPS3.670.911.77 3.00 1.141.19HJWPSSIHS2.173.861.5842.33>1 0001.13LQQPSSSSS3.001.591.58 3.33 0.831.63ZKZSHSHHS1.5043.363.19>1 000>1 0001.31表2(续)IDGenotypic Resistance(Level)Phenotypic Resistance(Level: Fold Increase of IC50)AZT3TCTDFEFVNVPLPV/rAZT3TCTDFEFVNVPLPV/rRLWSSSIHS1.501.591.5435.67>1 0000.44ZLWSSSSSS2.333.002.77 3.33 1.540.44WKZSSSSSS2.673.773.12 3.33 1.950.69WXWSSSSSS2.830.682.35 2.67 1.740.63HJLSSSSSS0.671.001.96 3.33 0.161.00CJSSSSSS2.332.862.65 3.00 1.510.38QYESHSHHS2.8346.453.23>1 000494.311.25ZMMSSSSSS0.671.092.12 3.33 0.181.38YYSSSSSS1.000.951.88 2.67 0.591.31WFQPSSPPS2.671.002.04 3.67 1.481.69
表3 表型耐药检测结果与基因型耐药结果的比较
Tab.3 Comparison between phenotypic and genotypic resistance testing results

耐药检测结果各类药物检测例数基因型检测结果表型检测结果AZT3TCTDFEFVNVPLPV/r耐药耐药161990敏感敏感201520121221耐药敏感000000敏感耐药000000
表4 新的表型耐药检测系统稳定性分析
Tab.4 Stability analysis of the new phenotypic resistance testing system
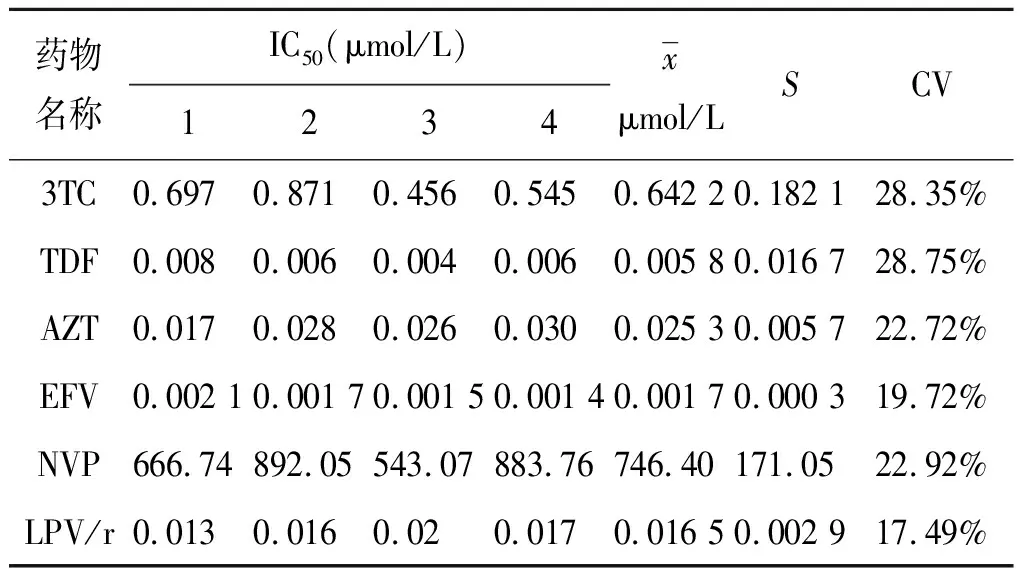
药物名称IC50(μmol/L)1234xμmol/LSCV3TC0.6970.8710.4560.5450.642 20.182 128.35%TDF0.0080.0060.0040.0060.005 80.016 728.75%AZT0.0170.0280.0260.0300.025 30.005 722.72%EFV0.002 10.001 70.001 50.001 40.001 70.000 319.72%NVP666.74892.05543.07883.76746.40171.0522.92%LPV/r0.0130.0160.020.0170.016 50.002 917.49%
HIV复制过程中有三个关键酶,即逆转录酶(reverse transcriptase,RT)、蛋白酶(protease,PR)及整合酶(integrase),它们均为目前抗艾滋病毒药物的主要攻击靶标。目前除了在这些药物作用主要靶点检测到耐药突变外,还在gag区剪切位点处(p7/p1/p6)检测到耐药相关突变位点的存在,由于HIV-1蛋白酶负责病毒的gag和gag-pol多聚蛋白的翻译后加工,因此该区域突变有可能导致对蛋白酶抑制剂耐药[6]。虽然有些新发展的检测技术已经考虑到将Gag 以及 Gag-Pol 剪切位点纳入耐药检测的范围[7],然而目前绝大多数耐药检测方法仍然仅对RT和PR进行耐药检测,其中应用到临床表型耐药检测的试剂盒AntivirogramTM(VircoMechelen, Belgium)仅包含蛋白酶和绝大部分的逆转录酶(codons 1482)[8];PhenoSenseTM(ViroLogic South San Francisco, Calif)也仅包含有部分gag,全部蛋白酶和针对313密码子的RT区域[9]。本研究构建的HIV表型耐药检测方法不仅可检测到全长的PR、RT、RNase以及Integrase的1-280aa还可检测到gag 区中蛋白酶剪切位点p7-p1-p6。因此该耐药检测系统能够只利用一次重组后的假病毒就可检测包括所有蛋白酶、逆转录酶、整合酶抑制剂等目前国家常用药物的主要靶点,从而实现药物检测的高通量。
研究结果显示表型与基因型耐药检测结果能够很好的吻合,且具有较高的稳定性,充分证明了所建立的新的HIV-1表型耐药检测系统可应用于临床耐药检测,为HIV/AIDS患者尤其是对基因型结果难以解释的病例提供更为高效、快捷的耐药检测平台,同时也为开展耐药相关突变位点的研究以及新的抗病毒治疗药物的研发等提供一个技术平台。
研究不足之处,耐药检测片段扩增效率不是特别高,仅为83%,其中原因除了与扩增片段相对比较长(约3 364 bp)、引物与少数模板不匹配有关外,还有可能与样本低病毒载量和样本保存条件有关。另外,部分构建的RTV产生的假病毒没有感染活性可能原因是受到HIV-1准种的影响,或者在PCR过程中不可避免发生突变而表现为复制能力较差或缺陷。为此,为了提高检测效率,样本最好新鲜采集或按要求-80 ℃低温保存,尽可能选择高病毒载量样本,耐药检测片段最好采用3次扩增产物进行混合,另外尽可能多挑取阳性克隆菌落提质粒进行感染活性鉴定。本项目组将进一步优化该检测系统,以提高整体检测效率。
利益冲突:无
本文引用格式:吴守丽, 刘峰, 颜苹苹, 等. 基于In-fusion技术的高通量HIV表型耐药检测系统的建立及应用研究[J]. 中国人兽共患病学报, 2019,35(4): 285-291. DOI: 10.3969/j.issn.1002-2692.2019.00.025
——一道江苏高考题的奥秘解读和拓展

