转录因子Eha直接调控迟缓爱德华菌的靶基因
迟缓爱德华氏菌(Edwardsiellatarda,简称 Et)是革兰氏阴性短杆菌,分布范围很广,同时,它可以感染爬行类、两栖类、鱼类及哺乳类等动物。Et菌对水产养殖业而言是一种重要的病原体,它可以引起多种鱼类的感染[1]。迟缓爱德华氏菌的溶血相关基因(Et haemolysin activator gene,简称eha)是一种重要的转录调控基因[2],本实验采用RNA- Sequence技术比较在酸性条件下,ET-13野生株和eha基因缺失株转录组的表达,发现了147个差异表达的基因(Differentially Expressed Genes, DEGs)[3]。本研究进一步用染色质免疫共沉淀技术(Chromatin Immunoprecipitation,CHIP)[4],寻找Et菌Eha直接调控靶基因,并结合ET13野生株和eha基因缺失株表型的差异,进一步研究Eha参与调控的Et菌属抵抗巨噬细胞杀灭细菌的详尽分子机制。
1 材料与方法
1.1Et 株 由南京农业大学陆承平教授赠予ET13菌株;本实验室前期构建的eha基因缺失株;pBAD-lacZ购自南京铂莱生物有限公司;pGEX-4T购自武汉三鹰公司(表1所示)。CHIP-IT○RExpress试剂盒购自ACTIVE MOTIF公司;本实验于TaKara公司购试剂盒PrimeScriptTMRT Mix及SYBR○RPremix Ex TaTM。细菌培养基(Luria Broth, LB);鼠源巨噬细胞RAW264.7为上海兽医研究所王少辉博士惠赠;于Thermo购进胎牛血清(Fetal Bovine Serum, FBS)和细胞培养液(Dulbecco’s Minimum Essential Medium, DMEM)。
表1 本研究所用质粒和菌株
Tab.1 Bacterial species and plasmids in the study

Strain or plasmidDescriptionand/orgenotypeReferenceStrainE.coil DH5αK-12 cloning host strainSanYingCompanyEdwardsiella tarda strains(ET-13)Wild type;Colr;isolated from humanProf LuThe eha mutant ET-13(△eha)Deletion of eha; ColrDr.GaoET13-pACYC184Added an empty vector of pACYC184 ;ColrThis studyET13-tnaAAdded a vector of pACYC184-tnaA to ET13; ColrThis study△eha-tnaAAdded a vector of pACYC184-tnaA to △eha; ColrThis study△eha-pACYC184Added an empty vector of pACYC184 to △eha; ColrThis studyCehaET13Added a vector of pACYC184-eha to ET13;ColrThis studyCehaFlagET13Added a vector of pGEX-4T-ehaflag to ET13; ColrThis studyPlasmidspGEX-4T-flagAmpr; flag geneSanYing CompanypGEX-4T-ehaflagAmpr; ehaflag geneThis studypBAD-lac ZLacZ;Tetr;Bgl II和XbaⅠPoLaiCompanypBAD-Ptargetlac Ztarget gene promoter-LacZThis studypACYC184Tetr;CmrPoLaiCompanypACYC184-tnaAcontaining tnaA; Tetr; CmrThis study pACYC184-ehacontaining eha; Tetr; CmrThis study
1.2重组质粒 pGEX-4T-ehaflag的构建与鉴定 以ET13的基因组DNA为模板、引物ehaflag-F: CGGGATCCTTGGAATCGACATTGGGCTCG和ehaflag-R: GCGTCGACCTTATCGTCGTCATCCTTGTAATCATTTATTCTGTAAGTGAAT(划线部分为Flag标签序列),扩增融合基因ehaflag。用SalI和BamH I 限制性内切酶对ehaflag片段和pGEX-4T载体双酶切,将双酶切后的片段进行连接,构建重组质粒并命名为pGEX-4T-ehaflag,进行测序,鉴定重组质粒。
1.3细菌EhaFlag融合蛋白的表达 采用电击转化法将重组质粒pGEX-4T-ehaflag导入eha基因缺失株,命名为Cehaflag ET13。挑取ET13、△eha和Cehaflag ET13三菌株的单菌落,并接种于15 mL LB液体培养基中,于摇床37 ℃过夜培养,参照说明步骤制备3菌株的蛋白样品,用样品进行SDS-PAGE凝胶电泳。釆用Flag标签的单抗anti-Flag antibody(Sigma, USA),单抗anti-DnaK (Cell Signaling Technology, USA),用Western blot检测Cehaflag ET13中EhaFlag融合蛋白的表达,DnaK作为内参。
1.4细菌的胞内生存实验研究 以100∶1的感染复数MOI(multiplicity of infection) 用对数期生长的细菌感染鼠巨噬细胞,参照文献方法[5],横坐标为培养时间(h),每个细胞内的活菌数(CFU/cell)为纵坐标,绘制细菌胞内细菌数目和时间曲线。每个细胞内存活的活菌数目=规定时间分离的细菌数目/规定时间的细胞总数目,该试验重复3次后进行统计学分析。
1.5 染色质免疫共沉淀
1.5.1细菌的固定 根据参照文献[3]对数期ehaflag ET13株以pH=6.3 LB的酸性环境刺激2 h,按参考文献[4],加入甲醛,室温固定,然后加入甘氨酸混匀,室温孵育。洗涤,裂解菌体。
1.5.2超声处理 参考文献[4], 超声波将细菌的基因组DNA片段化至500~1 000 bp,超声条件:200 W,5 s/20 s,共超声6到7次使细菌悬液变澄清。
1.5.3除杂与抗体孵育 按参考文献[4]的方法,为了降低非特异性结合,向上清液中加入预处理过的Protein G Magnetic Beads,孵育;依次加入CHIP反应体系各组分,实验组加入anti-Flag antibody,对照组加入IgG antibody,孵育过夜。
1.5.4免疫复合物的沉淀与洗涤, 解交联 按参考文献[5]的方法,向过夜孵育的样品中分别加入预处理过Beads,离心,洗涤。 加入蛋白酶K,分离结合在一起的DNA 和蛋白。
1.5.5荧光定量PCR(quantitative real time PCR, qRT-PCR) 以CHIP得到的DNA样品为模板,根据RNA-Sequence的结果设计引物(表2),参照试剂盒的说明书进行实验操作,在ABI7300型荧光定量仪上进行PCR反应,内标参照为细菌中16S rRNA的表达量,采用2-ΔΔct法计算细菌在实验组(anti-Flag antibody)基因转录水平相对对照组(IgG antibody)的倍数。
表2 用于qRT-PCR鉴定Eha直接结合基因的引物及产物大小
Tab.2 qRT-PCR Primer sequences and product sizes to identify the genes combined directly by Eha

Gene IDSequence(5′ to 3′)Product Size/bpUp RegulationETATCC_RS01565RS01565-F:CGTTGTACTTTCCGCCGCTATRS01565-R:ATCAGGAGCAGGGCAAAGG172ETATCC_RS01560RS01560-F:GGTGGCTGGCTGTGGAATTRS01560-R:GCGATAAGGAACGGCTGACT185ETATCC_RS15305RS15305-F:TGCACCCTTTCCGTACTCTRS15305-R:CGATCCGTTCTTCGATGATAT211ETATCC_RS01555RS01555-F:GCCAATGCTTGAATGACCCRS01555-R:GTAAGTCCTCCTCCGTCTGTG360ETATCC_RS09960RS09960-F:TCGCCATCTGGTGCGTCTARS09960-R:AACAGGGCGGTCAGGGTCA363表2(续)Gene IDSequence(5′ to 3′)Product Size/bpETATCC_RS05005RS05005-F:GGCGTCGGTGCCTTCTTCTRS05005-R:GCCTGGTCAGCCACGAACT260ETATCC_RS16600RS16600-F:CGCCTGTTAGTCGGGTTGGRS16600-R:AGATGGCGCATCGGCTCGC194ETATCC_RS02310RS02310-F:AAGGCGGCTTTCCTACCCTRS02310-R:TGACAACTGCGGCACTCAATA175ETATCC_RS16810RS16810-F:ATCAACACCTGCGTCTCACCRS16810-R:GCGAATCTCATACTTCCCACT155ETATCC_RS08150RS08150-F:ATGTCGCAGCACGCCCTAGRS08150-R:CGGTTGGCGGTAGCTGACT246ETATCC_RS10370RS10370-F:ACTGGTCGGCTTCGATGTGRS10370-R:GGTGATGTAGGGATCGGAGAA193ETATCC_RS06805RS06805-F:CTGGTGATTAACAGTGGCTRS06805-R:CGCTCAGATTGGCGTAGTT352ETATCC_RS06800RS06800-F:GCCATCTGTCCCTTGCTATRS06800-R:CGATAACGAAATAAGCACC225ETATCC_RS05810RS05810-F:TGACTCCCAGCGAGACAACGRS05810-R:TCACGATTCAGGGTCAACACG315ETATCC_RS00100RS00100-F:GTTGGGCAAGGGTTGGAATRS00100-R:CCGACTAACAGGGCGAAGAC168ETATCC_RS14045RS14045-F:CGGAGACGCTTGAGGCTTTGRS14045-R:CAGACGATAGGCGAAACCAT332ETATCC_RS05805RS05805-F:TCTTTCATCCAAGCCATTCTGRS05805-R:GGCGATGTTGCCACGGATA144ETATCC_RS14760RS14760-F:GCCGCAGCAGTAGCTCTATRS14760-R:ATCGCTGAACTCGGTAGCC372ETATCC_RS11570RS11570-F:TCGCCCGTGATTTCATTCG
F: forward primer, R: reverse primer.
1.6构建靶基因启动子和LacZ融合质粒及检测β-半乳糖苷酶 以ET-13基因组DNA为模板,扩增靶基因的启动子区(引物见表3),将该片段插入 pBAD-lacZ 载体中,构建了靶基因的启动子载体 pBAD-P靶lacZ,然后将这些载体分别电击导入 ET-13野生株和eha基因缺失株中。检测对数期细菌以pH=6.3 LB的酸性环境刺激2h的β —半乳糖苷酶活性。
表3 基因启动子区的产物大小和引物序列
Tab.3 Primer sequences and product sizes to amplify the promoters of genes by PCR

Gene IDSequence(5′to 3′)Product Size/bpETATCC_RS01555CAGATCTGCGGCAGGAATGCCAAATTA CTCTAGATATCCGGTAACGCACCCG220ETATCC_RS08025CAGATCTTGGGGTTCCTTAGTGCGATGCTCTAGATCCCATGTCTCACCGCTTTG285ETATCC_RS14735CAGATCTCAGTGAGAGGACCAATGGGA CTCTAGAGCGCGGCCTGATAGACTC280ETATCC_RS10595CAGATCTTCGCCTACATCCCTCAAAGTTCTCTAGAGTCCCACCATGATGACACGA304ETATCC_RS15225CAGATCTCCGGAGGTCTCCGTCAGTTACTCTAGACCGGCGGCGGGATAAG265ETATCC_RS06125CAGATCTTTTTATTTGGTGCGTCGGCAGCTCTAGACCGCACGCCGTAGAAAGAG450ETATCC_RS10185CAGATCTTTGGATGTCCTTGATATGGTCTTCTCTAGAATAATCAGGCATAGCATTTGCATT420ETATCC_RS00925CAGATCTTCTTCGCTCTACAATTATTAGGGTCTCTAGAGCAACTAACATTTTCCTATAGCACG300ETATCC_RS14855CAGATCTGGCCCACATACCGAGAATGACTCTAGAGCAAGTTAGGCGAGTAACGC464ETATCC_RS07650CAGATCTAAATGGAGCAATTACGGCGGCTCTAGAAGCAGCTGTATCGTTGCGG141
1.7SDS-PAGE检测细菌外膜蛋白表达 将相同数目对数期的 ET-13野生株和eha基因缺失株超声波破碎,离心,取上清,再超速离心, 沉淀为细胞膜成分。用BCA法测定蛋白浓度,取等量的蛋白样品,进行10% SDS-PAGE 蛋白电泳检测,考马斯亮兰 R-250 染色液中染色,脱色后观察结果。
1.8SDS-PAGE检测细菌鞭毛蛋白表达 将相同数目对数期的ET-13野生株和eha基因缺失株,离心沉淀,提取细菌鞭毛蛋白,分别溶于5 mL PBS,加样15 μL /每孔,进行SDS-PAGE检测,方法同1.7。
1.9统计学分析 使用GraphPad Prism 5.0软件对数据进行分析两组数据之间的比较采用t检验,当P<0.05时表示结果有统计学差异。
2 结 果
2.1细菌EhaFlag融合蛋白的表达 结果如图1所示,可以在Cehaflag ET13株中检测到大约21 kDa的条带,而在对照组的ET-13野生株和eha缺失株中未检测出条带,说明在Cehaflag ET13株中EhaFlag的融合蛋白是可以表达的。

1.Cehaflag ET13株 2. ET13野生株 3.eha基因缺失株图1 Western blot检测在Et菌中EhaFlag融合蛋白的表达Fig.1 EhaFlag fusion protein of expression in Et inspected by Western blot
2.2细菌EhaFlag融合蛋白活性的检测 结果如图2所示,Cehaflag ET13株与野生型ET-13株在巨噬细胞内的生存能力无明显差异,它们和eha基因缺失株的生存能力分别有明显差异(P<0.05),说明Cehaflag ET13株中表达的EhaFlag融合蛋白与ET-13野生株中表达的Eha蛋白具有一样生物活性。

图2 比较ET13与Cehaflag ET13在巨噬细胞内活差异Fig. 2 Comparison of the differences between the intracellular survival rates of Cehaflag ET13 and the one of the wild type ET13
2.3染色质免疫共沉淀超声条件的摸索 结果如图3所示,200 W,Plus 5 s/10 s,超声6或7次后DNA片段在500~1 000 bp的集中程度更高。

A 1-8:200W,Plus10s/30s的超声2、3、4、5、6、7、8、9次; B 1-8: 200W,Plus 5s/10s的超声4、5、6、7、8、9、10、11次图3 检测不同超声条件下ET13细菌基因组DNA的片段化程度Fig.3 Fragmentation degree of bacterial genomic DNA of ET13 on different ultrasonic conditions
2.4寻找Eha蛋白直接结合的基因 qRT-PCR 检测CHIP实验获得的DNA样品中基因的量,在实验组(anti-Flag antibody)与对照组(IgG antibody)之间相差10倍以上即为转录调控因子Eha的基因。结果如图4所示,CHIP共富集10个基因的启动子片断分别编码:镰刀菌酸抗性蛋白(ETATCC_ RS01555)、N-乙酰胞壁酰-L-丙氨酸酰胺酶(ETATCC_RS08025)、分支酸合酶(ETATCC_ RS14735)、 rRNA胞嘧啶-C5-甲基转移酶(ETATCC_RS10595)、厌氧C4二羧酸转运蛋白DcuA(ETATCC_RS15225)、异柠檬酸裂合酶CitC(ETATCC_RS06125)、热休克蛋白IbpB(ETATCC_RS00925)、鞭毛钩蛋白flgK(ETATCC_RS14855)、色氨酸酶(ETATCC_RS07650)和一个未知功能蛋白(ETATCC_ RS10185)。

图4 qPCR鉴定转录因子Eha直接结合的基因Fig.4 qPCR used to identify the genes combined immediately with the transcriptive factor Eha
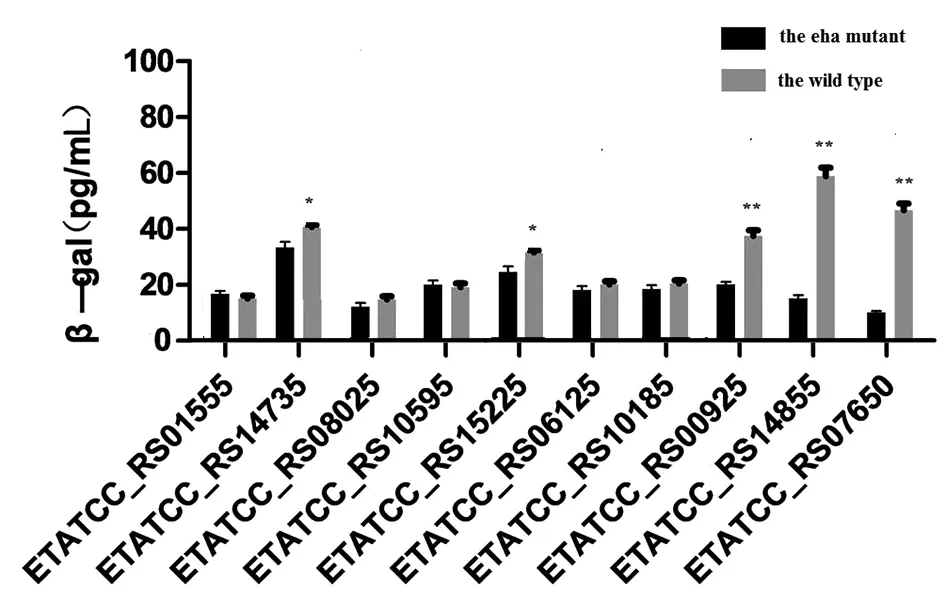
(*P<0.05;**P<0.01)图5 比较野生型ET13株和eha基因缺失株中 β-半乳糖苷酶活性的差异Fig.5 Comparison of the differences between the β-galactosidase activities of the wild type ET13 and the ones of the eha mutant
2.5检测eha基因对靶基因启动子直接调控作用 对数期细菌pH=6.3的酸性环境刺激2 h后,比较ET13野生株和eha基因缺失株中pBAD-P靶lacZ的β-半乳糖苷酶活性的差异,结果如图5所示,在该条件下,eha基因直接正调控靶基因编码的蛋白是:分支酸合酶(ETATCC_ RS14735)、色氨酸酶TnaA(ETATCC_ RS07650)、厌氧C4二羧酸转运蛋白DcuA(ETATCC_ RS15225)、热休克蛋白IbpB(ETATCC_ RS00925)和鞭毛钩蛋白flgK(ETATCC_RS14855)。
2.6比较野生株和eha基因缺失株外膜蛋白表达的差异 分别提取野生株和缺失株的外膜蛋白,SDS-PAGE 蛋白电泳检测,结果见图 6。在加等量蛋白的情况下,野生株约 17 kDa、30 kDa 和 37.7 kDa外膜蛋白的表达水平明显高于eha基因缺失株的表达水平,其中37.7 kDa的大小和厌氧C4二羧酸转运蛋DcuA1的大小一致。
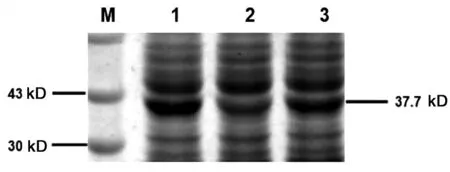
M. 蛋白marker; 1.野生型ET-13; 2.eha基因缺失株;3. 互补株图6 用SDS-PAEG比较ET13、△eha和互补株中外膜蛋白的表达差异Fig.6 Comparison of the differences between the out membrane proteins expressed by the wild type ET13 and the one did by the eha mutant by SDS-PAEG
2.7比较野生株和eha基因缺失株鞭毛蛋白表达的差异 分别提取ET13、互补株和△eha的鞭毛钩蛋白,进行蛋白电泳检测,结果如图所示(图7),E.tarda鞭毛蛋白的分子量为54 kD,图中的条带主要位于43 kD和56 kD之间,与鞭毛钩蛋白的分子量一致。因此,当三种菌株上样量相同时,野生株与互补株的鞭毛钩蛋白的表达量接近且都高于eha缺失株。

M蛋白marker;1. 野生型ET13;2. 互补株;3.eha基因缺失株图7 SDS-PAEG比较ET13、△eha和互补株的鞭毛钩蛋白flgK表达差异Fig.7 Comparison of the differences between the flagellar hook protein flgK expressed by the wild type ET13 and the one did by the eha mutant by SDS-PAEG
2.8eha基因调控tnaA基因影响Et菌胞内生存的作用 结果显示,Et13-pACYC184、Et13-tnaA、△eha-tnaA和△eha-pACYC184株在巨噬细胞内的生存曲线随培养时间呈上升趋势,结果表明以上菌株均可在巨噬细胞内存活。并且与Et13-pACYC184菌株相比,继续培养6 h以后,Et13-tnaA组胞内存活的细菌数量呈增高(P<0.05),△eha-pACYC184组细菌数目明显降低(P<0.05),表明eha基因和tnaA基因均影响Et13在巨噬细胞内的繁殖速率。而和△eha-pACYC184组相比, △eha-tnaA组细菌数量增高(P<0.05);和Et13-pACYC184组相比,△eha-tnaA组细菌数量差异没有统计学意义(P>0.05),结果提示,tnaA基因可以回复eha基因缺失对Et13胞内繁殖速率的影响。

图8 eha基因调控tnaA基因影响ET13株在巨噬细胞胞内的生存率(**P<0.01)Fig. 8 Theehagene regulatedtnaAgenes to affecte the intracellular survival rates of ET13 strains within macrophages
3 讨 论
我们通过转录组测序技术,发现 ET-13 野生株与eha缺失株间的差异表达基因,但其中有些基因是eha直接调控的靶基因,而有的基因是受环境等因素影响或者eha间接调控的基因。本实验借助免疫共沉淀实验技术(CHIP),研究体内DNA与蛋白质的相互作用,从而在细胞的内环境条件下,找出能够与Eha蛋白相结合的靶基因。此技术的关键是需要一种特异性好的抗体才能有效地富集目标蛋白。通过检测Eha融合蛋白的功能发现,Flag标签并会不干扰Eha蛋白的功能。本实验借助商品化的Flag标签替代Eha的单抗,从而实现对融合蛋白Eha-Flag蛋白的高度富集, 最终筛选出5个可以和Eha蛋白直接结合的基因。此外,通过直接检测转化入pBAD-P靶lacZ的ET-13和△eha株中的β-gal活性的差异,说明eha基因对靶基因的启动子区具有直接的调控作用。此外,我们通过比野生株和缺失株表型的差异,如厌氧C4二羧酸转运蛋DcuA1和鞭毛钩蛋白FlgK,验证eha基因对靶基因的启动子有直接的调控作用。
Eha直接调控靶基因编码的蛋白,如分支酸合酶是莽草酸通路中的一种酶,存在于大多数原核生物中,能够催化磷酸烯醇式丙酮酸转化为分支酸,是该通路的最后一步。 由于分支酸是合成芳香族氨基酸的前体,对于细菌的生长繁殖至关重要[6]。C4-二羧酸盐作为碳和电子受体分子,参与非糖物质代谢。在空肠弯曲杆菌中,C4-二羧酸盐转运子dcuA和dcuB由双组分系统RacR / RacS直接调节,响应缺氧氧气环境和硝酸盐的存在[7]。小分子热休克蛋白IbpA和IbpB与胁迫条件下细胞内蛋白的稳态和生存有着密切联系,具有分子伴侣功能、稳定细胞结构功能和调节细胞凋亡功能。巨噬细胞吞噬非致病大肠埃希菌,产生ROS(Reactive Oxygen Species)杀死细菌时,IbpAB提供一定的保护作用。IbpB的靶蛋白,如色氨酸降解酶、延伸因子EF-Tu和过氧化氢酶等,并发现IbpB可以稳定这些靶蛋白[8]。FlgK和FlaL共同构成鞭毛钩环状结构,是鞭毛形成并发挥功能的重要组成部分,ETATCC_RS14855鞭毛钩丝 FlgK,鞭毛是细菌的运动器官,鞭毛的运动方向受到细菌趋化作用系统的控制,鞭毛对于细菌的环境适应性及致病性至关重要[9]。色氨酸酶能够催化色氨酸形成吲哚和丙酮酸,直接参与氨基酸的代谢过程,其中吲哚的产生可以参与很多细菌的生理活动调节,比如抗药性、抗酸性、毒力、运动性、生物膜形成等[10]。这些结果说明,Eha可以通过调控靶基因,影响Et菌物质和能量代谢过程,抵御巨噬细胞杀菌能力。
利益冲突:无
本文引用格式:田畅, 刘念, 郑恩金, 等. 转录因子Eha直接调控迟缓爱德华菌的靶基因[J]. 中国人兽共患病学报, 2019,35(4):299-310. DOI: 10.3969/j.issn.1002-2692.2019.00.027

