ELK-1/JNK/c-Fos对左归降糖解郁方(ZGJTJYF)体外培养的模拟糖尿病并发抑郁症(DD)大鼠海马神经元凋亡中的作用*
柳 卓, 刘 检, 凌 佳, 杨 琴, 杨 蕙, 孟 盼, 杜 青, 赵洪庆, 王宇红,△
(1. 湖南中医药大学, 湖南省中药粉体与创新药物省部共建国家重点实验室培育基地, 长沙 410208; 2. 湖南中医药大学第一附属医院, 长沙 410007; 3. 湖南省中医药研究院, 长沙 412000)
糖尿病是代谢性疾病,其最基本特征为高血糖。有研究表明,大约三分之一的糖尿病患者存在抑郁反应[1, 2]。糖尿病并发抑郁症(diabetes mellitus with depression,DD)的复发和死亡率均显著高于单纯的糖尿病患者[3]。故全面研究DD的发病机制及在机制基础上防治具有重要意义。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)可以介导凋亡的丝氨酸蛋白激酶,转录激活因子ETS样蛋白1(ETS-like 1 transcription factor,ELK-1)可被其激活从而影响c-Fos的表达,导致凋亡的发生[4, 5]。左归降糖解郁方有化瘀解郁,滋阴益气的功效。本课题组前期研究证实,DD大鼠的海马存在神经元病理损伤[6-8]。神经元损伤主要是由神经元凋亡导致,而凋亡的主要机制体外模型尚未研究。在此基础上,本实验拟从体外角度检测ZJJF对海马 JNK、ELK-1、c-Fos蛋白和基因表达的影响,更深一步探讨左归降糖解郁方对海马神经元的保护作用。
1 材料与方法
1.1 试剂
L-多聚赖氨酸、皮质酮、多聚甲醛、DMSO,胰蛋白酶、Ⅰ型胶原酶(美国 Amresco),D-葡萄糖、DMEM/F12、Neurobassal神经元基础培养基、B27 添加剂、胎牛血清(美国 Hyclone)、Glutamax(美国Gibco),兔抗烯醇化酶多克隆抗体(NSE,中国 Bioworld),Hoechst 33258(中国 Beyotime),兔抗鼠 p-JNK( Thr183) 、Elk-1、c-fos 多克隆抗体( Abcam 公司),
1.2 仪器
三气细胞培养箱(NEW BRUNSWICK GALAXY,CO48R-230 型),高内涵成像分析系统(PerkinElmer,OPERETTA 型),体视显微镜(LEICA,S8PAO 型),实时荧光定量 PCR仪( Roche 公司,Lightcycler 480Ⅱ)。
1.3 动物
SD大鼠(400~460 g雌性3只和180~220 g雄性9只),其中雌性受孕18 d,湖南斯莱克景达实验动物有限公司(动物许可证号 SCXK(湘)2013-0004)提供。
1.4 药物
左归降糖解郁方(菟丝子、牛膝、熟地黄、丹参、山萸肉、姜黄、牡丹皮、黄芪、枸杞子、贯叶连翘、杜仲),湖南中医药大学第一附属医院购买并由该院制剂科水煎浓缩制成口服液(每ml含生药1.14 g);盐酸二甲双胍片(湖南湘雅制药有限公司),盐酸氟西汀(法国 Patheon)。
1.5 细胞培养
将SD雌鼠麻醉后,取出胎鼠大脑,将残留的其它组织血液脱干净,在显微镜下夹取海马,剪碎后加入相同体积的Ⅰ型胶原酶和胰蛋白酶,充分消化后加入终止液,反复吹打细胞使其成悬浮液后收集上清液,重悬后加入接种液,调整细胞数为3.0×105cells·ml-1。接种于预先包被的96孔细胞培养板中,于培养箱中培养4 h后,用维持液(96%Neurobassal 神经元基础培养基,1%Glutamax,2%B27 添加剂,1%双抗)替代培养液。3 d后换1/2维持液。第5日,用4%多聚甲醛30 min固定, PBS洗后加入0.25%Triton X-100 溶液,15 min后用预冷PBS洗,用5%BSA封闭30 min,清洗后滴加兔抗大鼠神经元特异烯醇化酶(neuron-specific enolase, NSE)和小鼠抗大鼠 β-tublin 相关抗体(1∶ 100)。4℃过夜后PBS洗,滴加R-PE标记和FITC 标记的二抗( 1∶ 200),37℃孵育1 h,清洗后DAPI 染核20 min,清洗,每孔加50 μl PBS,用高内涵成像分析系统拍照并分析。
1.6 含药学清的制备
取 SD 雄鼠,随机分成阳性药组,中药药物血清组,空白血清组,每组3只,每组灌予相应药物。其中中药药物血清组参照前期文献给予临床有效3倍量左归降糖解郁方 ( 32.82 g·kg-1),阳性给药量为二甲双胍( 0.18 g·kg-1) +氟西汀( 1.8 mg·kg-1),空白血清组给予相同量的蒸馏水,每天2次连续 3 d。末次给药,1 h后无菌条件取腹主动脉血,2 h后15 min离心(3 000 r·min-1),收集上清液,30 min 56℃ 水浴,滤膜(0.22 μm)过滤,分装,放置-80℃冰箱保存[9]。
1.7 分组、造模及给药
原代培养海马神经元,将培养的海马神经元细胞随机分为5组,每组两个复孔:空白血清组、正常组、左归降糖解郁方含药血清组、阳性药(二甲双胍+氟西汀)含药血清组和模型组。培养5~7 d的海马神经元,采用高糖(150 mmol/L)+皮质酮(200 μmol/L)构建DD体外细胞模型[10]。模型组和正常组给予等量培养液,空白血清组加入相应体积分数10 %空白血清,中药组和阳性药组分别加入相应体积分数10 %的含药血清,均干预18 h。
1.8 Hoechst荧光染色检测海马神经元凋亡
海马神经元干预并固定后,每孔加100 μl 0.25%TritonX-100 ,作用15 min后,PBS清洗5 min×3次,滴加Hoechst 33258 避光作用20 min。PBS清洗5 min×3次。DAPI避光作用20 min,最终每孔加PBS观察。
1.9 高内涵分析技术检测海马神经元凋亡相关蛋白ELK-1、p-JNK、c-Fos 表达
神经元经干预并固定后,0.25 %Triton-100作用15 min,BSA 封闭30 min。滴加一抗p-JNK(1∶100)、ELK-1(1∶100)、c-Fos(1∶100)稀释液作用1 h。滴加FITC标记和R-pe 标记二抗孵育30 min,20 min DAPI染色。最终每孔加PBS观察,高内涵分析仪检测。
1.10 各组海马神经元细胞ELK-1、p-JNK、c-Fos的mRNA表达比较
取出细胞,把细胞转移到离心管中, 1 000 r/min,离心5 min,小心倒掉上清,加入1 ml Trizol,吹打均匀至液体澄清且无细胞团块后,室温静止5 min,然后把所有液体转移到1.5 ml EP管中。Trizol加入氯仿0.2 ml/1 ml,剧烈摇晃10 s后静止2 min。离心,取上清加入等体积异丙醇,离心后吸出上层液;按比例加入乙醇,离心弃上清液。干燥5 min后加入10~25μl RNasinfree H2O得总RNA。反转录RNA 成cDNA,在50 μl cDNA 反应液内分别加入2 μl 引物,RT-PCR 反应循环为95℃、30 s,95℃、5 s,持续40 个循环和60℃、30 s。RNA引物由深圳华大基因公司合成,分别有内参引物β-actin引物(上5’-CATCCTGCGTCTGGACCTGG-3’;下5’-TAATGTCACGCACGATTTCC-3’,反应条件:2 min 95℃变性;60℃退火20 s 45个循环)。
c-fos引物(上5’-CAACACACAGGACTTTTGCG-3’;下5’-GAGATAGCTGCTCTACTTTGCCC-3’);p-JNK引物(上5’-AGGAATAGTGTGTGCAGCTTATG-3’;下5’-CTTCTAGGGATTTCTGTGGTGTG-3’); ELK-1引物(上5’-TGCTCCACTGAAGACTGCC-3’;下5’-GAGCATGGATGGATGGACTC-3’);
1.11 统计学处理
2 结果
2.1 左归降糖解郁方对海马神经元凋亡的影响
空白血清组、正常组、模型组、中药药物血清组,阳性药药物血清组,HCA结果随机选取10个视野,凋亡细胞比例分别是:14.9%、13.1%、53.5%、 40.8%和34.9%。正常组细胞荧光均匀完整,其无明显凋亡特征。模型组分散,细胞荧光不均匀,局部出现浓染表明出现大量凋亡;阳性药及中药血清作用,模型组荧光分布更均匀完整(图1)。

Fig.1The apoptotic morphology of hippocampal neurons in each group(Hoechst ×400)
C: Control group; Q: Blank serum group; M: Model group; Y: Positive drug group; Z: ZGJTJYF group
2.2 左归降糖方对模型大鼠海马神经元ELK-1、p-JNK、c-Fos 蛋白表达的影响
经过HCA检测结果分析后显示,细胞骨架呈橙黄色。绿色(FITC)为细胞目标ELK-1、p-JNK、c-Fos,蓝色(DAPI)为细胞核。与空白组比较,模型组海马神经元中ELK-1、JNK和c-Fos相对荧光强度明显升高(P<0.05);与模型组比较,中药血清组神经元ELK-1、JNK和c-Fos相对荧光强度明显降低(P<0.05)。中药组和阳性药组神经及树突连接方面看到明显改善。该结果表明左归降糖解郁方可以逆转DD环境下海马神经元中ELK-1、JNK、c-Fos信号的表达而起到抗凋亡的效果(表1, 图2,3,4)。
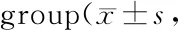

GroupELK-1JNKc-FosC457.1±32.5427.1±30.11198.0±14.6Q451.9±21.6466.2±25.21205.0±15.8M704.1±30.2*662.3±26.7*1474.0±21.6*Y504.6±26.4#456.2±21.8#1280.0±15.8#Z505.2±24.5452.8±23.5#1260.0±20.3#
C: Control group; Q: Blank serum group; M: Model group; Y: Positive drug group; Z: ZGJTJYF group; ELK: ETS-like 1 transcription factor; JNK: C-Jun N-terminal kinase
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel group
2.3 各组海马神经元细胞ELK-1、p-JNK、c-Fos基因表达结果
RT-PCR结果显示,与空白组比较模型组海马神经元中ELK-1、JNK和c-Fos的mRNA表达显著升高(P<0.01);与模型组比较,阳性药血清组和中药血清组神经元ELK-1、JNK和c-Fos的mRNA表达明显降低(P<0.01或P<0.05)。该结果表明左归降糖解郁方可以逆转DD环境下海马神经元中ELK-1、JNK、c-Fos的mRNA表达(表2)。
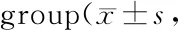

GroupELK-1JNKc-FosC1.00±0.021.00±0.021.00±0.02Q0.93±0.010.92±0.011.02±0.03M1.24±0.12**1.69±0.06**1.67±0.03**Y1.06±0.02##1.13±0.14#1.16±0.08#Z1.06±0.05##1.11±0.05##1.00±0.04##
C: Control group; Q: Blank serum group; M: Model group; Y: Positive drug group; Z: ZGJTJYF group
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel group

Fig.2Expression of ELK-1 protein in neurons of hippocampus in each group(×400)
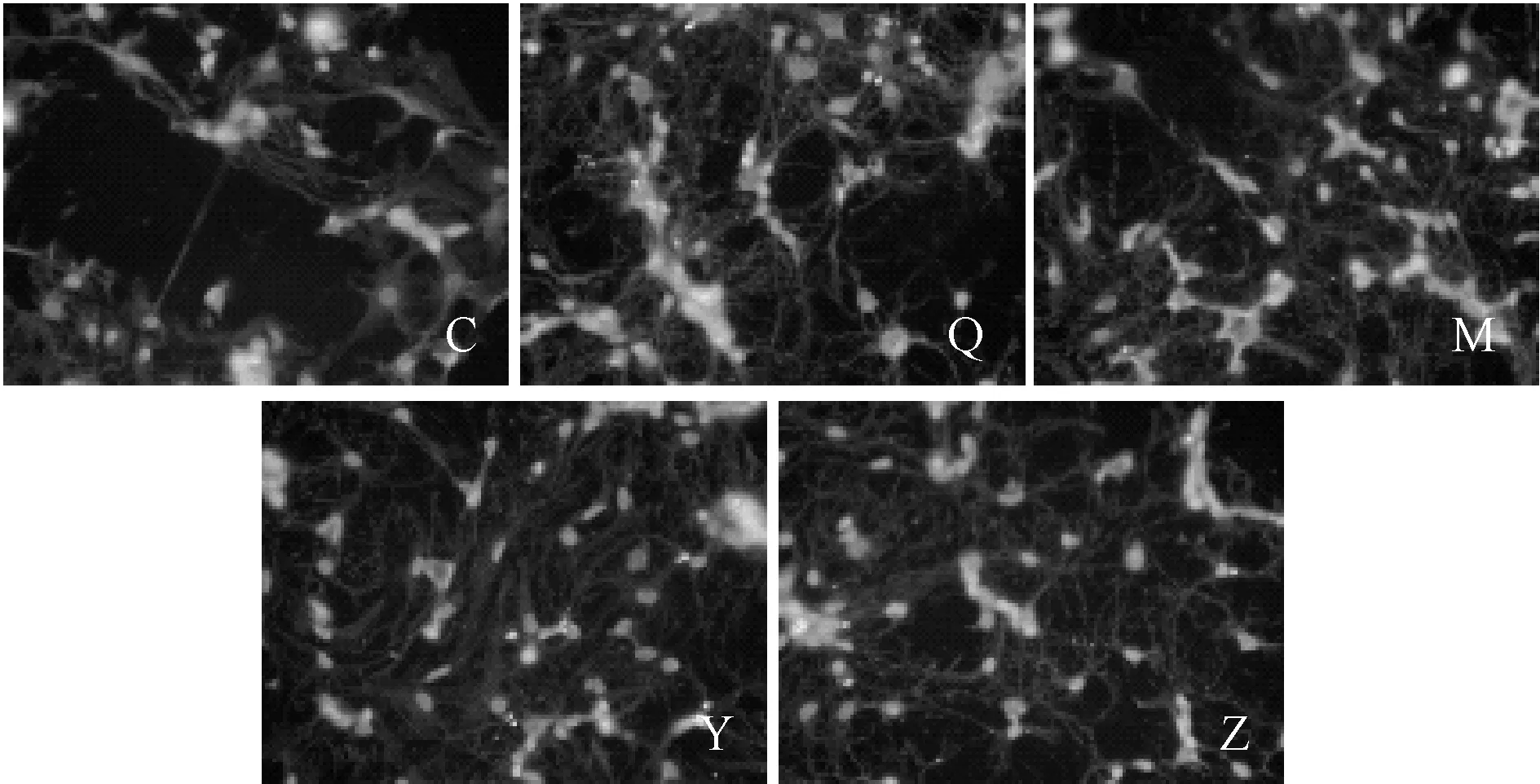
Fig.3JNK protein expression in neurons of hippocampus in each group(×400)
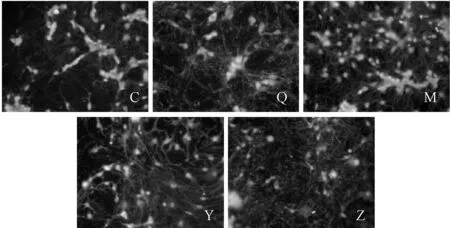
Fig.4c-Fos protein expression in neurons of hippocampus in each group(×400)
3 讨论
糖尿病很多因素导致的胰岛素障碍的疾病。糖尿病也可以引发很多并发症,其中极易并发抑郁症[11]。糖尿病并发抑郁症患者自杀率高,远远高于抑郁症患者[12, 13]。而海马是DD发生的关键靶器官。DD的中医病机可以总结为“虚、瘀、郁”,表现为气阴两虚、血瘀瘀阻等[14]。
左归降糖解郁方源自于《景岳全书》左归丸,在原方滋补肾阴的基础上加以活血散瘀之丹参、丹皮,健脾益气之黄芪,化瘀行气、疏肝解郁之姜黄和贯叶连翘,使之能滋阴益气,化瘀行气解郁,符合DD中医病机“虚、瘀、郁”的特点,明显改善DD大鼠海马损伤及糖代谢紊乱,并可缓解神经元损伤[5]。本实验从体外的角度进一步观察到DD神经元有明显的凋亡,中药组和阳性药组凋亡细胞明显减少,由此表明左归降糖解郁方有改善神经元凋亡的作用。
ELK-1是一种转录激活因子,影响细胞增殖、凋亡、分化,并能通过调节其靶基因c-Fos的表达,诱导神经元的凋亡,属于JNK的核内底物[15]。JNK激活在疾病状态下对神经元凋亡发挥重要作用。目前认为其机制主要是调节下游凋亡相关靶基因和凋亡蛋白的表达,介导细胞凋亡。已有研究证明JNK信号能在糖尿病并发抑郁症引起的海马损伤中表达异常,其可能与其能控制凋亡的相关蛋白有关[16]。c-Fos是神经功能活动的代谢性标志物,在神经细胞收到信号后, 增加c-Fos的表达,造成凋亡的发生[17, 18]。本实验结果表明,与空白组比较,模型组海马神经元中ELK-1、JNK和c-Fos相对荧光强度明显升高;与模型组比较,中药血清组神经元ELK-1、JNK和c-Fos相对荧光强度明显降低。中药组和阳性药组树突连接及神经形态情况得到明显改善。该结果表明左归降糖解郁方可以调节DD环境下海马神经元中ELK-1、JNK、c-Fos信号的表达而起到抗凋亡的效果。在基因表达上,中药血清组和阳性药血清组神经元ELK-1、JNK和c-Fos基因表达明显降低。该结果表明左归降糖解郁方可以逆转DD环境下海马神经元中ELK-1、JNK、c-Fos基因的表达。
综上可知,左归降糖解郁方可改善糖尿病并发抑郁的体外模型的神经元凋亡作用并可以抑制JNK通路。本研究表明左归降糖解郁方对神经元相关凋亡蛋白有调节作用,为中药复方治疗糖尿病并发抑郁症提供有力依据。但有待更深入的研究其他的分子机制。

