Hippo信号通路在颈动脉结扎所致大鼠动脉血管重构中的表达及其意义*
朱 宁, 陈 皓, 赵旭勇, 叶凡豪, 王 毅
(温州医科大学第三临床学院, 温州市人民医院, 浙江 温州 325000)
冠状动脉疾病(coronary artery disease,CAD)是指冠状动脉粥样硬化致使冠状动脉管腔堵塞及发生功能性改变的一类疾病。它是导致病人发生心绞痛,心肌梗死,心力衰竭以及猝死的根本病因[1]。目前介入治疗是公认的治疗冠状动脉疾病的有效方法。目前支架内再狭窄仍然是阻碍CAD治疗进展的主要原因,还需进一步寻找能减少支架内再狭窄的药物或者方法[2-3]。支架内再狭窄的本质问题正是血管的不良重构,目前颈动脉结扎或者球囊损伤的模型被广泛应用于血管重构的研究。虽然转基因小鼠及大鼠颈动脉球囊损伤模型已经被广泛用于药物靶点的研究,但是大鼠颈动脉结扎致血管重构模型对于药物靶点的研究和后续药物的开发仍然具有重要的意义。之前大鼠和小鼠颈动脉重构的模型多应用球囊进行血管内的损伤,这就需要特殊的介入材料,而且手术操作难度较高,需要操作者反复练习[4]。在本研究中我们拟建立操作更方便,效果良好的大鼠颈动脉结扎模型,以用于血管重构的进一步研究。Hippo信号通路是近年来发现的调节细胞大小以及稳态的关键信号途径。Hippo信号通路能对于众多细胞内和细胞外的信号产生调节效应,包括细胞-细胞接触、细胞极性、G蛋白偶联受体的配体,细胞能量状况。Hippo信号通路通过抑制YAP和TAZ转录共激活因子来调节细胞的增殖、凋亡和干性。Hippo信号通路促进诸多癌症发生发展的作用已经得到了明确[5]。也有越来越多的研究开始关注Hippo信号通路在心血管疾病中的作用。目前的研究表明Hippo信号通路的激活能促进平滑肌细胞的增殖和迁移,但是Hippo信号通路在大鼠颈动脉结扎介导的血管重构中的表达以及意义尚不明确。本研究旨在建立新的大鼠颈动脉结扎致血管重构模型,同时探讨Hippo信号通路的主要效应因子YAP和TAZ在该模型中的表达以及可能的意义。
1 材料与方法
1.1 主要动物与试剂
60只(250~280 g)健康雄性SD大鼠购买自上海动物实验中心;牛血清白蛋白(bovine serum albumin,BSA)购买自Sigma公司;磷酸酶抑制剂购买自Cell Signaling Technology公司;HE以及MASSON试剂盒购买自北京索莱宝科技有限公司;YAP (Yes Associated Protein), TAZ (Transcriptional Coactivator With PDZ-Binding Motif)、PCNA (proliferating cell nuclear antigen),GAPDH,TEAD1一抗购买自Cell Signaling Technology公司,Bcl-2-like protein 4 (Bax)、Bcl-2-like protein 4 (Bax)一抗购买自Abcam公司、anti-α smooth muscle actin (α-SMA)购买自Sigma公司,鼠以及兔二抗购买自Cell Signaling Technology公司;RIPA裂解液、蛋白酶抑制剂、BCA蛋白检测试剂盒以及Diaminobenzidine (DAB)购买自碧云天公司。
1.2 大鼠颈动脉结扎模型的建立及分组设计
所以SD大鼠随机分为 2组:对照组(n=40)和模型组(n=20)。使用戊巴比妥(60 mg/kg)一次性腹腔注射麻醉大鼠,模型组经颈部正中切口游离出左侧颈总动脉,用6-0不可吸收线在尽量靠近近心端处结扎,完全阻断血流。对照组仅将手术线穿过颈总动脉而不结扎,闭合切合。14 d后处死所有动物,经原手术路径分离颈总动脉,收集结扎处至远心端的动脉。所有血管经生理盐水漂洗,根据后续处理在-80℃冰箱冻存,或者在福尔马林中固定。
1.3 HE和MASSON染色检测
血管固定于4%多聚甲醛过夜,随后用分级乙醇脱水,用二甲苯脱脂,用石蜡包埋,连续切片(4 μm)。随后玻璃片在二甲苯中脱蜡,并通过磷酸盐缓冲盐水(pH 7.2~7.4)洗涤以及酒精梯度脱水。HE及MSASSON染色步骤按试剂盒说明进行,最后在光学显微镜下观察血管组织的变化。image J软件用于检测新生内膜/中膜区域比例。
1.4 免疫组织化学染色检测增殖
血管石蜡切片后(4 μm),进行脱蜡和水化,然后进行PBS(pH 7.2 - 7.4)漂洗。在PBS(pH 7.2 ~ 7.4)中用高压锅10 min进行抗原修复。用5% BSA封闭后,用抗PCNA抗体(1∶100)、α-SMA、抗YAP抗体(1∶100)、抗TAZ抗体(1∶100)、抗体(1∶400)在4℃过夜孵育,再用HRP结合的第二抗体(1∶200)孵育。然后用光镜(400×放大,尼康,日本)对染色切片进行观察。
1.5 Western blot法检测相关蛋白的表达
取出存于-80℃的血管组织,用蛋白酶抑制剂、磷酸酶抑制剂保存在裂解缓冲液中,然后立即在液氮中冷冻,直至均匀化。用BCA蛋白检测试剂盒测量上清液的蛋白浓度。用10%~12%的SDS-PAGE分离相同量的蛋白质(50 μg),转移至PVDF膜,用5% BSA封闭,在4°C与一抗孵育过夜。GAPDH作为内对照。用HRP偶联的抗兔或抗小鼠IgG作为第二抗体(1∶1 000)检测免疫反应带。然后通过增强化学发光仪器检测蛋白条带。
1.6 统计学处理
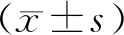
2 结果
2.1 建模存活率
实验组 40 只大鼠中1只因麻醉过量死亡,2只术后14 d内死、最终存活大鼠37 只,存活率 92.5%。平均手术时间(10.26±3.86)min。
2.2 HE观察颈动脉重构
实验组病理检查均出现内膜增生增厚,成活的大鼠均造模成功。血管切片HE染色后显微镜检测及image J软件检测大鼠颈总动脉内膜 / 中膜面积比(I/M)的比较结果:血管切片形态学显微镜检测(图1),模型组大鼠颈总动脉 I/M的比值(1.52± 1.00)显著高于对照组(0.73±0.09,P<0.01)。

Fig.1Morphological changes were observed by HE staining (original magnification ×40)
**P<0.01vscontrol group
2.3 MASSON染色观察颈动脉
血管切片MASSON染色提示,模型组比对照组蓝色的胶原纤维明显增多(图2),结果提示模型组颈总动脉纤维化明显。
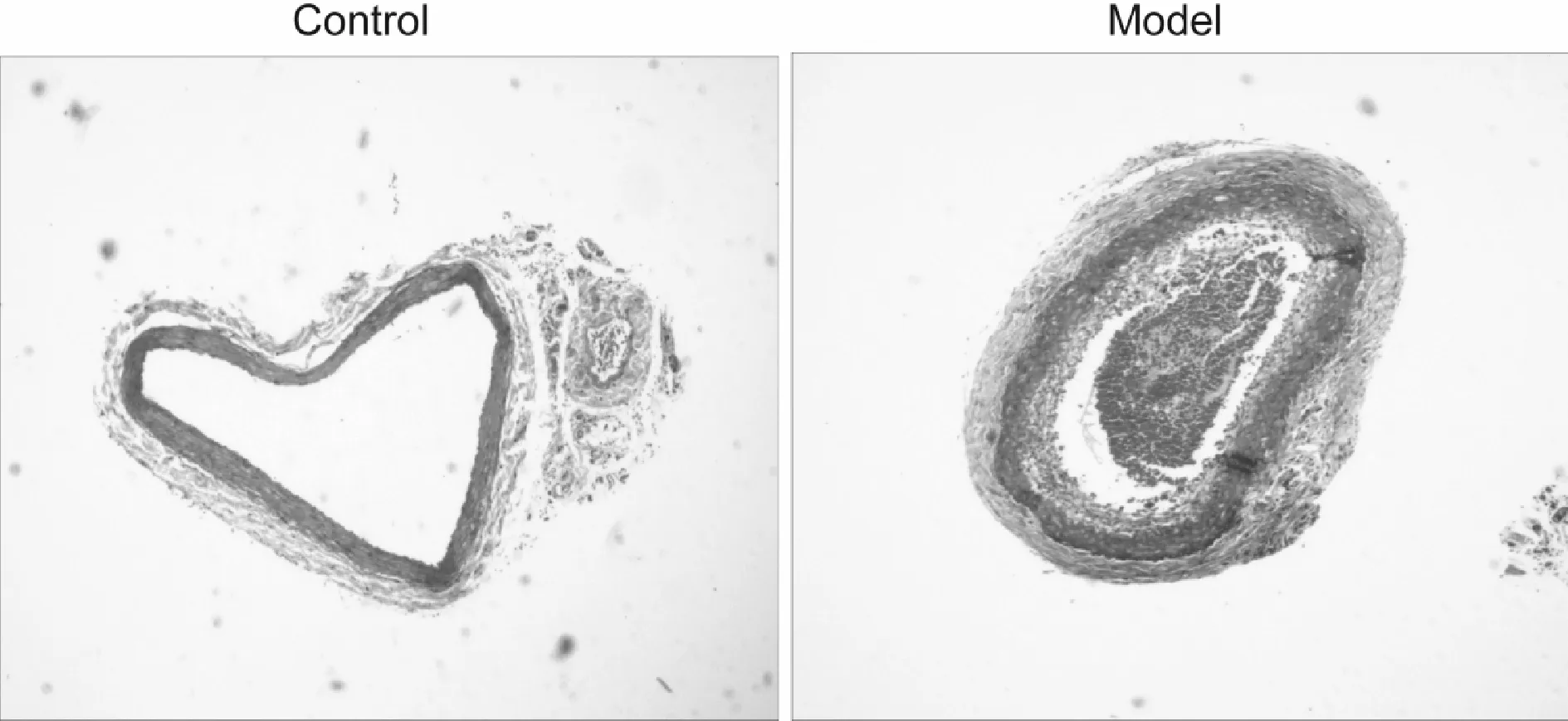
Fig.2Fibrosis was observed by Masson staining (original magnification ×40)
2.4 大鼠颈总动脉PCNA及α-SMA蛋白表达情况
血管切片免疫组化实验结果显示模型组PCNA以及α-SMA蛋白比对照组明显上调(图 3),提示结扎介导了颈总动脉中层的平滑肌细胞增殖显著增加。
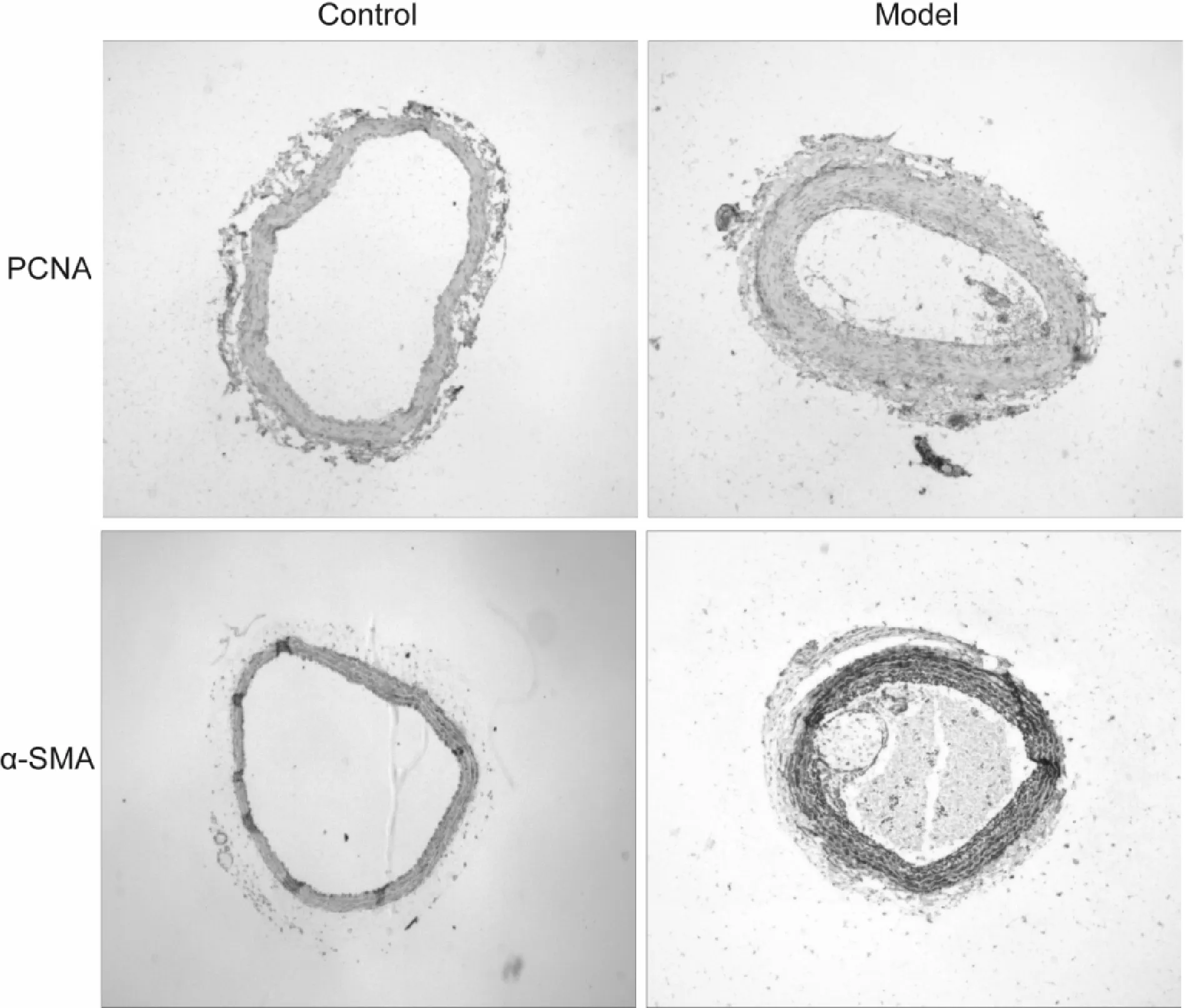
Fig.3PCNA and α-SMA were evaluated by immunohistochemical staining (original magnification ×40)
2.5 大鼠颈总动脉YAP,TAZ以及TEAD1蛋白表达情况
与对照组相比,Western blot检测提示模型组YAP,TAZ及TEAD1的表达明显上调(图4,表 1)。
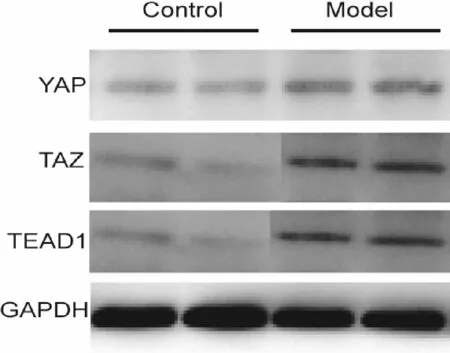
Fig.4The expression of YAP, TAZ and TAED1 were evaluated by Western blot
*P<0.05,**P<0.01vscontrol group


GroupYAP/GAPDHTAZ/GAPDHTEAD1/GAPDHControl0.15±0.030.23±0.050.13±0.02Model0.31±0.03*0.38±0.02**0.27±0.03*
*P<0.05,**P<0.01vscontrol group
2.6 大鼠颈总动脉Bax,Bcl-2蛋白表达情况以及Bax/Bcl-2比值的变化
与对照组相比,Western blot检测提示模型组中促进凋亡的Bax降低,抑制凋亡的Bcl-2明显增加以及Bax/Bcl-2比值明显降低(图5,表 2)。
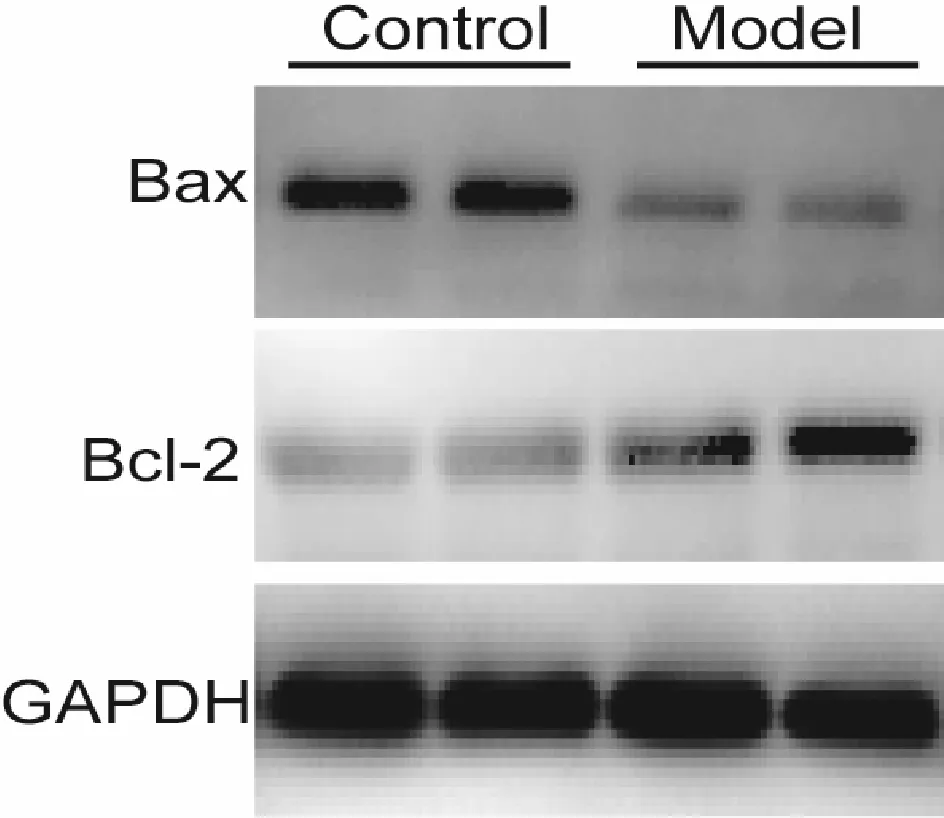
Fig.5The expression of Bax, Bcl-2 were evaluated by Western blot
*P<0.05,**P<0.01vscontrol group
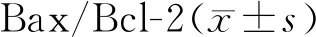

GroupBax/GAPDHBcl-2/GAPDHBax/Bcl-2Control0.86±0.090.80±0.091.08±0.16Model0.47±0.12*1.38±0.07**0.34±0.01*
*P<0.05,**P<0.01vscontrol group
3 讨论
虽然随着介入治疗器械的不断发展,但是支架内再狭窄仍然是阻碍CAD治疗进展的主要原因。然而永久性支架的存在始终是导致冠脉内皮化的延迟和不完全所致的刺激因素,血管损伤将持续不断地刺激平滑肌细胞的增殖迁移,导致血管的异常重构。同时也促进冠脉内血栓的形成,最终还是使得晚期支架内再狭窄的发生率显著增加[6-7]。通常情况下在成熟血管中平滑肌细胞极少处于增殖状态以及表现出分泌活性[8]。但是在应对血管损伤,炎症,血流剪切力增加的时候,由于各种生长因子释放明显增加,同时促进增殖的相关信号通路明显的激活,而抑制增殖的信号通路受到了抑制[9-10]。比如同型半胱氨酸以及血小板源性生长因子都可以诱导平滑肌细胞的增殖以及迁移,这是研究平滑肌细胞功能的基本方法[11-12]。
平滑肌细胞因各种刺激处于活跃的增殖和迁移状态时会促进血管重构,进而导致官腔狭窄,最终产生相应的病变[13]。因此,如何抑制平滑肌细胞的异常增殖,防止血管重构以及再狭窄的发生,是目前心血管疾病研究的一个热点问题。
虽然小鼠的颈动脉结扎和损伤模型已经广泛应用于血管重构的研究,但是大鼠模型仍有其不可替代的地位,特别是临床前的药物筛选。之前的研究表明不管是大鼠颈动脉球囊损伤模型或者显微外科手术建立的模型,对于操作以及设备和材料等要求都较高,特别是外科手术的方法应用很少[4]。在本研究中我们建立了结扎介导的大鼠颈动脉内膜新生模型,该模型具有操作简单,模型优良等特点。HE以及MASSON染色提示造模组血管重构明显,免疫组化表明代表细胞增殖的标志物PCNA以及平滑肌特异性的标志物α-SMA表达明显增高,说明大鼠颈动脉中层平滑肌细胞增殖明显,进而促进血管重构。
许多基于模式生物的研究已经明确Hippo通路是调节器官大小和组织稳态的关键信号途径。近年的研究揭示,Hippo通路在器官大小的控制上具有重要的作用。Hippo通路中的Hpo、SAV、WTS和MAT在基因和生理上相互作用,其突变引起显著的器官增大表型在其他已建立的发育信号途径中是前所未有的。因此,它们被归类为一种新的信号转导模块:以河马的巨大体型命名的Hippo信号通路。对于一系列细胞外和细胞内信号的刺激,Hippo信号通路可以调节细胞的增殖、凋亡和干性[14]。转录共激活剂YES相关蛋白(YAP)和转录共激活子与PDZ结合基序(TAZ)是Hippo途径中进化保守的关键效应因子,目前认为正是通过抑制YAP/TAZ共激活因子,进而调控下游基因转录来实现Hippo途径调控的生物学功能。除了调节正常的细胞以及肿瘤的形态大小和稳态,最近有文献提示,Hippo信号通路中MST通过上调caspase 3促进平滑肌细胞的凋亡,所以MST的降低导致了小鼠颈动脉球囊损伤介导的血管重构[15]。同时也有研究表明YAP和TAZ能够调控促有丝分裂基因的表达,进而促进毛喉素介导的平滑肌细胞增殖和迁移[16]。这些研究表明YAP/TAZ在促进平滑肌细胞增殖中的重要作用。在本研究中,我们也发现结扎介导的颈动脉狭窄模型中,在中层的平滑肌细胞中YAP和TAZ表达明显上调,结合其他增殖标志物的表达升高,说明它们可能是促进平滑肌细胞增殖的关键信号分子。然而YAP和TAZ不含其自身的DNA结合基序,主要通过与DNA结合转录因子相互作用而启动转录。最近的研究已经表明,YAP和TAZ主要是通过与DNA结合转录因子TEAD1结合介导下游促增殖基因的表达[17]。沉默TEAD能阻断大部分YAP诱导的基因表达,并在很大程度上减弱YAP诱导的过度生长表型。此外,TEAD1/2基因缺失的小鼠的表型类似于YAP基因缺失的小鼠。Bax可以促进cleaved caspases-3和cleaved PAPR的表达从而促进凋亡,而Bcl-2可以抑制Bax的表达从而抑制凋亡, bax/bcl-2比值的下调说明促进细胞的增殖。YAP/TAZ可以促进TEAD入核,介导Bcl-2以及下游的cleaved caspases-3和cleaved PAPR的表达促进增殖。本研究同样也证明TEAD1在模型组中表达上调,同时伴随着其所调控的下游蛋白bax/bcl-2比例下调。研究结果表明YAP和TAZ可能通过结合TEAD1入核介导,促进增殖凋亡相关的bax/bcl-2比值改变促进平滑肌细胞的增殖。
Hippo信号通路在生物发育,稳态,肿瘤中的作用已经被充分地证明,未来在心血管疾病中也可能被证实发挥着巨大的作用。YAP和TAZ是Hippo信号通路主要的效应分子,但是目前尚缺少YAP和TAZ有效的直接抑制剂。本研究证明大鼠颈动脉结扎模型中Hippo信号通路明显激活,这与血管重构的发生相一致,结果有助于在动物水平上研究以YAP和TAZ为靶点的药物。

