依帕司他对单侧输尿管梗阻大鼠肾间质纤维化的干预作用及其机制*
高云星, 汤 娟, 张 倩, 蒋莉莉, 李先伟△
(1. 皖南医学院医学微生物与免疫学教研室 241002; 2. 皖南医学院药理学教研室, 安徽省多糖药物工程技术研究中心, 安徽 芜湖 241002)
肾间质纤维化(renal interstitial fibrosis, RIF)是慢性肾脏疾病发展的最终结果,是导致终末期肾病的重要病因[1]。其典型的病理变化为大量成纤维细胞及肌成纤维细胞的增生,细胞外基质(extracellular matrix, ECM)如胶原纤维和纤粘连蛋白的大量沉积,近而导致肾小管间质纤维化[2]。目前大量的研究表明转化生成因子-β1(transforming growth factor-β1, TGF-β1)介导的肾小管上皮细胞间质转分化(epithelial-mesenchymal transition, EMT)被认为是RIF过程中导致ECM大量沉积的主要原因[3]。
醛糖还原酶(aldose reductase, AR)为醛-酮还原酶超家族成员,是多元醇通路的限速酶,在糖尿病并发症中起着关键作用[4]。但近年来研究还发现,AR在非糖尿病诱因引起的肾脏疾病中同样起着一定的作用。研究表明,AR在肾小球硬化症发生和发展过程中起一定的调节作用[5],同样AR在肾小球肾炎病变过程中也起一定的参与作用[6]。而本实验室前期工作表明,AR参与TGF-β1诱导的肺成纤维细胞的增殖及ECM的产生[7]。因此我们推测,TGF-β1/AR介导的肾小管上皮细胞EMT在肾间质纤维化中起着重要作用。依帕司他(epalrestat, EPS)为AR抑制剂,对糖尿病神经病变和糖尿病肾病具有明显的干预作用[8, 9]。而本实验室前期工作表明,EPS可通过抑制AR的表达而减轻博莱霉素诱导的肺纤维化[7]。但目前关于依帕司他对单侧输尿管梗阻大鼠肾脏纤维化的保护作用未见报道。基于以上的研究背景,本研究借助单侧输尿管梗阻(unilateral ureteral obstruction, UUO)模型,研究依帕司他是否通过抑制AR的表达,从而减轻TGF-β1介导的肾小管上皮细胞EMT,进而改善肾间质纤维化,从而为临床防治梗阻性肾间质纤维化提供新的治疗靶点以及制定新的治疗策略提供试验依据。
1 材料与方法
1.1 实验动物
SPF级8周龄雄性Sprague-Dawley(SD)大鼠,体重(200±20) g,购于南京青龙山动物养殖场,许可证号:SCXK(浙)2017-0001。动物饲养环境为自然光照,室温(25±5)℃,相对湿度55%~65%,自由进食和饮水。
1.2 药物及试剂
依帕司他(50 mg/片,扬子江药业集团南京海陵药业有限公司)、Masson胶原染色试剂(北京索莱宝科技有限公司)、TRIzol(美国 Invitrogen公司)、RNA逆转录试剂盒和real-time PCR试剂盒(大连宝生物工程有限公司)、PCR引物设计合成(上海生工)、小鼠抗大鼠GAPDH、转化生成因子-β1(TGF-β1)及醛糖还原酶(AR)抗体(美国Santa Cruz公司)、小鼠抗大鼠E钙粘蛋白(E-cadherin)抗体及兔抗大鼠成纤维细胞特异蛋白-1(fibroblast-specific protein 1, FSP-1)、纤连蛋白(fibronectin, FN)及α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)抗体(美国Abcam公司)、PVDF膜和LunimataTMCrescendo发光液(美国Millipore公司)。
1.3 动物模型的建立及实验分组
大鼠适应性喂养1周,随机分为假手术(Sham)组、UUO组、UUO+EPS (50 mg/kg) 及UUO+EPS (100 mg/kg) 剂量组,每组8只。采用左侧输尿管结扎建立UUO大鼠模型,具体方法如下:用3%戊巴比妥钠按30 mg/kg麻醉大鼠,在腹部左侧1 cm处做一3 cm左右纵行切口,分离皮肤及皮下组织,暴露肾下极,游离输尿管,UUO组及UUO+EPS组大鼠沿肾下极将左侧输尿管结扎,缝合皮下组织及皮肤。Sham组手术步骤同上,输尿管不进行结扎。造模后第2日开始给药,依帕司他用0.5%羧甲基纤维素钠混匀,不同剂量的依帕司他按1 ml/100 g的体积每日灌胃给药1次,Sham组和UUO组灌胃给予等体积羧甲基纤维素钠(1 ml/100 g),连续给药3周。
1.4 标本收集
于末次给药24 h后用戊巴比妥钠腹腔注射麻醉大鼠。分离左肾,沿左肾长轴方向纵切,一半肾组织置于4%多聚甲醛溶液中固定,用于形态学及免疫组化观察;另一半肾组织用于相应基因mRNA和蛋白表达的检测。
1.5 形态学检测
肾组织脱水、石蜡包埋后,切片后进行HE及Masson染色,分别观察大鼠肾组织病理变化及胶原沉积等情况。HE及Masson染色方法详见我们前期研究成果[10]。
1.6 免疫组化检测肾组织AR
免疫组化方法参照我们前期的研究方法[7]。AR抗体浓度(1∶500),二抗浓度(1∶1 000)。结果判断:AR阳性表达呈黄至棕黄色颗粒,主要定位于细胞浆。
1.7 Real-time PCR检测肾组织collagen I、collagen III、α-SMA、FSP-1、FN、E-cadherin、TGF-β1及AR mRNA的表达
肾组织用液氮研磨后,分别依次用Trizol、氯仿、异丙醇等试剂提取总RNA,RNA定量后按照试剂盒说明书进行逆转录合成cDNA。以2 μl cDNA为模板,以GAPDH为内参,在荧光定量PCR仪上进行PCR反应。PCR反应条件参照我们前期的研究结果[10]。用StepOnePlus System SDS Software 软件分析数据,统计各组ΔΔCt 值,计算相应RQ值,比较各组mRNA的表达水平。引物列表如下(表1)。

Tab.1 Sequences of primers for real-time PCR
1.8 Western blot检测肾组织collagen I、collagen III、α-SMA、FSP-1、FN、E-cadherin、TGF-β1及AR蛋白表达
组织用液氮研磨后,用RIPA裂解液(含0.1% PMSF)冰上裂解30 min。蛋白样品定量变性后,用12%SDS-PAGE凝胶电泳分离样品,然后蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,分别滴加GAPDH(1∶2 000)、collagen I (1∶500)、collagen III(1∶500)、α-SMA(1∶1 000)、FSP-1(1∶1 000)、E-cadherin(1∶500)、FN(1∶500)、TGF-β1(1∶ 1 000)和AR(1∶1 000)抗体在4 °C 条件下孵育过夜。TBST洗膜3次,每次10 min,相应二抗(1∶ 2 000)室温孵育1 h。TBST洗膜后将高灵敏的LunimataTMCrescendo发光剂加到膜的正面,采用Bio-Rad ChemiDoc XRS+成像系统进行拍照用,Image J 1.43(National Institutes of Health)软件进行灰度值分析测量,将相应目的蛋白与内参蛋白(GAPDH)灰度值比值作为目的蛋白的相对表达量。
1.9 统计学处理
2 结果
2.1 依帕司他对输尿管梗阻大鼠肾间质病理学改变的影响
HE染色结果显示,Sham组肾小球、肾小管结构完整,肾小管周围间质未增宽;而UUO组大鼠肾小管上皮细胞萎缩、空泡样变性,单核及巨噬细胞弥漫浸润,成纤维化明显增生,肾小管周围明显出现间质纤维化改变。当给予不同剂量的依帕司他3周后,上述病理变化均不同程度缓解,提示依帕司他对输尿管梗阻大鼠肾间质病理变化具有一定的改善作用(图1)。

Fig.1Effects of epalrestat on pathological changes of kidneys in UUO model rats (HE ×200)
UUO: Unilateral ureter obstruction; EPS: Epalrestat
2.2 依帕司他对输尿管梗阻大鼠肾间质胶原表达的影响
Masson染色结果显示,Sham组大鼠肾间质蓝色染色较淡,胶原分布稀疏。而UUO组大鼠肾间质蓝色染色较深,胶原沉积明显增加。与UUO组比较,不同剂量依帕司他组肾间质蓝色染色逐渐减轻,胶原沉积逐渐减少。蛋白及mRNA检测发现,与Sham组相比,UUO组大鼠肾组织Ⅰ型和Ⅲ型胶原mRNA及蛋白表达水平明显升高(P<0.01);与UUO组相比,EPS各剂量组Ⅰ型和Ⅲ型胶原mRNA及蛋白表达明显降低(P<0.05或P<0.01);与EPS (50 mg/kg)组相比,EPS (100 mg/kg)剂量组Ⅰ型和Ⅲ型胶原mRNA及蛋白表达进一步降低(P<0.05或P<0.01)。这些结果提示依帕司他对输尿管梗阻大鼠肾间质胶原沉积具有一定的改善作用(图2,图3,表2)。

Fig.2Effects of epalrestat on collagen accumulation of kidneys in UUO model rats (Masson ×200)
UUO: Unilateral ureter obstruction; EPS: Epalrestat

Fig.3Effects of epalrestat on collagen I and collagen III protein expressions of kidneys in UUO model rats by Western blot analysis
UUO: Unilateral ureter obstruction; EPS: Epalrestat
2.3 依帕司他对输尿管梗阻大鼠肾组织α-SMA、FSP-1、FN 及 E-cadherin表达的影响
与Sham组比较,UUO组大鼠肾组织α-SMA 、FSP-1、FN mRNA及蛋白表达水平明显升高(P< 0.01),而E-cadherin mRNA及蛋白表达水平明显降低(P<0.01)。与UUO组相比,EPS (50、100 mg·kg-1)处理3周后α-SMA 、FSP-1、FN的mRNA及蛋白表达水平明显降低(P<0.05或P<0.01),而E-cadherin mRNA及蛋白表达水平明显升高(P<0.05或P<0.01);与EPS (50 mg/kg)组相比,EPS (100 mg/kg)剂量组α-SMA 、FSP-1、FN的mRNA及蛋白表达水平明显进一步降低(P<0.05或P<0.01),而E-cadherinm RNA及蛋白表达水平进一步升高(P<0.05或P<0.01)。这些结果提示依帕司他对输尿管梗阻大鼠肾组织上皮间质转分化具有一定的抑制作用(表3,表4,图4)。


Group collagen I mRNA level(relative unit, RQ value)collagen III mRNA level(relative unit, RQ value)collagen I protein level (collagen I /GAPDH)collagen III protein level(collagen III /GAPDH)Sham1.04±0.091.07±0.100.28±0.030.42±0.03UUO5.38±0.57**4.73±0.49**0.85±0.08**1.08±0.11**+ EPS (50 mg/kg)3.65±0.44#3.58±0.39#0.59±0.06#0.82±0.09#+ EPS (100 mg/kg)3.03±0.29##△2.87±0.31##△△0.46±0.05##△△0.65±0.07##△△
UUO: Unilateral ureter obstruction; EPS: Epalrestat
**P<0.01vssham;#P<0.05,##P<0.01vsUUO;△P<0.05,△△P<0.01vsEPS (50 mg/kg)
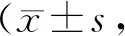

Group α-SMA mRNA level(relative unit, RQ value)FSP-1 mRNA level(relative unit, RQ value)FN mRNA level(relative unit, RQ value)E-cadherin mRNA level(relative unit, RQ val-ue)Sham1.09±0.170.99±0.141.07±0.191.04±0.13UUO4.83±0.65**3.68±0.47**4.51±0.55**0.38±0.09**+ EPS (50 mg/kg)3.58±0.46#2.89±0.43#3.67±0.46#0.64±0.16#+ EPS (100 mg/kg)3.17±0.37##△2.56±0.38##△2.83±0.35##△△0.72±0.18##△△
UUO: Unilateral ureter obstruction; EPS: Epalrestat
**P<0.01vssham;#P<0.05,##P<0.01vsUUO;△P<0.05,△△P<0.01vsEPS (50 mg/kg)
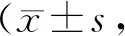

Group α-SMA protein level(α-SMA /GAPDH)FSP-1 protein level(FSP-1/GAPDH)FN protein level(FN /GAPDH)E-cadherin protein level(E-cadherin /GAPDH)Sham0.34±0.040.16±0.050.11±0.030.93±0.07UUO1.24±0.15**1.07±0.10**1.03±0.14**0.27±0.04**+ EPS (50 mg/kg)0.99±0.12#0.78±0.09#0.71±0.09#0.42±0.08#+ EPS (100 mg/kg)0.77±0.09##△△0.65±0.07##△△0.55±0.08##△△0.58±0.06##△△
UUO: Unilateral ureter obstruction; EPS: Epalrestat
**P<0.01vssham;#P<0.05,##P<0.01vsUUO;△P<0.05,△△P<0.01vsEPS (50 mg/kg)

Fig.4Effects of epalrestat on α-SMA, FSP-1, FN and E-cadherin protein expressions of kidneys in UUO model rats by Western blot analysis
2.4 依帕司他对输尿管梗阻大鼠肾组织TGF-β1表达的影响
与Sham组比较,UUO组大鼠肾组TGF-β1 mRNA及蛋白表达水平明显升高(P<0.01)。与UUO组相比,EPS (50、100 mg·kg-1)处理3周后TGF-β1 mRNA及蛋白表达水平明显降低(P<0.05或P< 0.01);与EPS (50 mg/kg-1)组相比,EPS (100 mg/kg-1)剂量组TGF-β1 mRNA及蛋白表达水平进一步降低(P<0.05或P<0.01,图5,表5)。
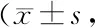
Tab.5 Effects of epalrestat on TGF-β1 and AR mRNA and protein expressions of kidneys in UUO model rats n=8)
TGF-β1: Transforming growth factor-β1; AR: Aldose reductase; UUO: Unilateral ureter obstruction; EPS: Epalrestat
**P<0.01vssham;#P<0.05,##P<0.01vsUUO;△P<0.05,△△P<0.01vsEPS (50 mg/kg)
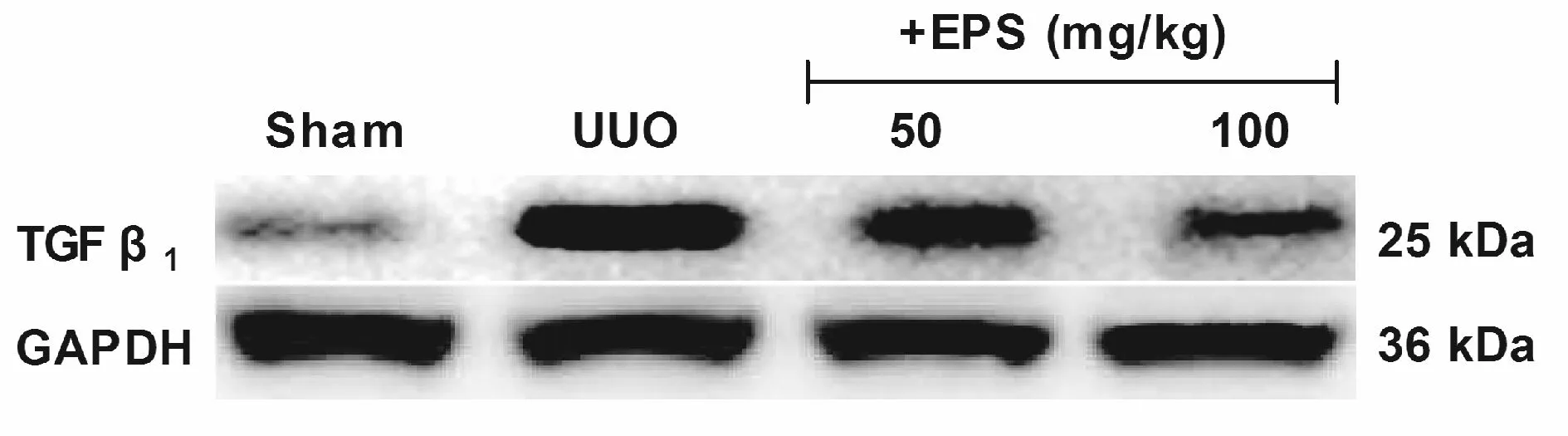
Fig.5Effects of epalrestat on TGF-β1 protein expression of kidneys in UUO model rats by Western blot analysis
2.5 依帕司他对输尿管梗阻大鼠肾组织AR表达的影响
经real-time PCR、Western blot及免疫组化检测发现,与Sham组比较,UUO组大鼠肾组AR mRNA及蛋白表达水平明显升高(P<0.01)。与UUO组相比,不同剂量依帕司他组给药3周后AR mRNA及蛋白表达水平均不同程度降低(P<0.05或P< 0.01);与EPS (50 mg/kg)组相比,EPS (100 mg/kg)剂量组AR mRNA及蛋白表达水平进一步降低(P<0.05或P<0.01)(表5,图6,图7)。

Fig.6Effects of epalrestat on AR protein expression of kidneys in UUO model rats by Western blot analysis
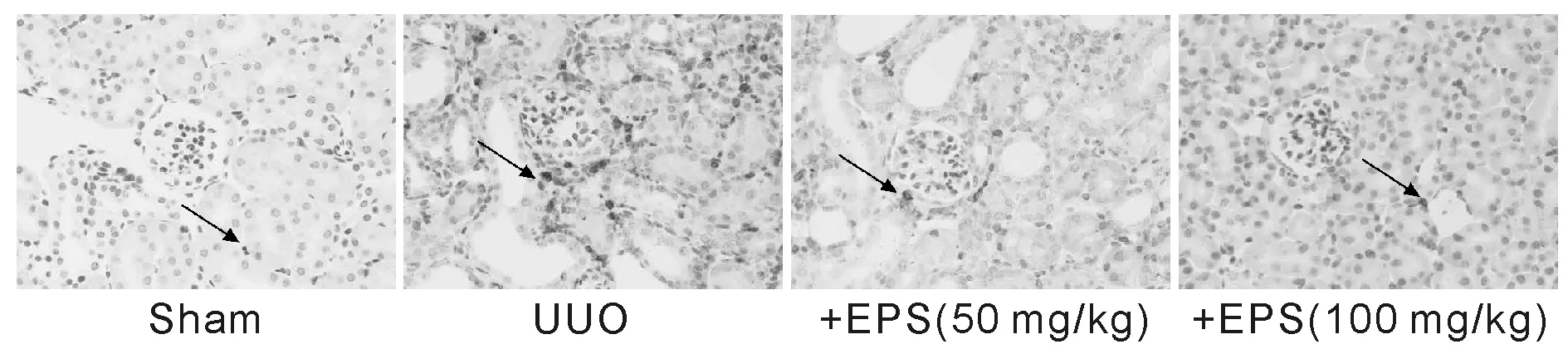
Fig.7Effects of epalrestat on AR protein expression of kidneys in UUO model rats by immunohistochemisty stain (arrows indicated AR positive staining ×200)
UUO: Unilateral ureter obstruction; EPS: Epalrestat
3 讨论
肾间质纤维化(RIF)是各种慢性肾脏疾病进展并导致肾功能衰竭的共同途径和主要的病理基础,其主要的病理变化是肾小管明显扩张,上皮细胞萎缩、空泡样变性,间质成纤维细胞及肌成纤维细胞、ECM过度沉积,并伴有大量炎性细胞浸润[11]。单侧输尿管梗阻(UUO)模型被认为是研究RIF的经典模型。本实验通过实施UUO手术,建立大鼠RIF模型,结果显示:UUO模型大鼠结扎侧肾脏明显增大,呈囊性改变,可见肾积水和肾间质水肿,HE及masson染色可见间质成纤维细胞及肌成纤维细胞大量增殖,胶原大量沉积,肾小管上皮细胞萎缩、空泡变性,大量炎症细胞浸润,与文献报道一致[12]。
依帕司他(epalrestat, EPS)是一种醛糖还原酶抑制剂,临床上主要用于治疗糖尿病神经病变[8]。EPS除了对糖尿病神经、肾脏和血管并发症具有明显的干预作用外,还具有降压、抑制血管平滑肌细胞增殖和血管重构等作用[13]。我们前期的研究发现,EPS对博莱霉素诱导的肺纤维化具有一定的改善作用[7]。本研究结果显示,EPS连续给药3周后,结扎侧肾脏明显缩小,肾积水和肾间质水肿减轻,肾间质成纤维细胞及肌成纤维细胞明显减少,肾小管上皮细胞空泡性变性明显减轻,胶原沉积及Ⅰ、Ⅲ型胶原的表达明显降低。说明EPS对肾间质纤维化有明显的改善作用。
肾间质纤维化的发生机制较为复杂,目前尚未完全阐明。而肾小管上皮细胞间质转化(EMT)一直被认为是肌成纤维细胞的一个重要来源,在肾脏损伤修复中会有经EMT生成肌成纤维细胞的参与,当损伤和炎症持续时,成纤维细胞逐渐累积致纤维化,最终引发肾脏功能以及结构的破坏是RIF发生发展的关键[3]。肾小管EMT主要表现为上皮细胞固有极性的消失、失去上皮细胞表型标志E-cadherin,获得间质表型标志蛋白如α-SMA、FSP-1、FN及胶原蛋白,进而导致上皮细胞转化为肌成纤维细胞,产生胶原导致肾脏纤维化,最终引发肾脏功能以及结构的破坏[14]。本研究结果显示,UUO模型大鼠肾组织E-cadherin的表达明显降低而α-SMA、FSP-1、FN及Ⅰ、Ⅲ型胶原的表达明显升高,与上述文献报道一致。虽然研究已证实TGF-β1通过Smad信号通路能够促进肾小管上皮细胞EMT的发生,进而导致肾小管间质纤维化[15]。但也有文献报道,外源性TGF-β1可剂量和浓度依赖性地上调大鼠系膜细胞中AR的表达,AR的改变可以影响某些ECM成分,同时大鼠系膜细胞转染AR后,可高表达FN和collagen I,应用AR特异性抑制剂可以抑制系膜细胞的FN和collagen I蛋白表达[16, 17]。而我们前期的研究发现,外源性TGF-β1可上调大鼠肺成纤维细胞AR的表达,进而促进肺组织ECM合成和沉积,而用EPS抑制TGF-β1诱导的AR的表达后,肺组织纤维化症状明显改善[7]。本研究结果发现,UUO模型大鼠肾脏TGF-β1及AR的表达明显升高。而给予EPS后,肾脏TGF-β1及AR的表达明显降低,同时E-cadherin蛋白表达水平增加,而α-SMA, FSP-1和FN蛋白表达水平降低,提示EPS通过下调TGF-β1及AR的表达,从而抑制肾纤维化中大鼠肾小管上皮细胞EMT的转化,抑制胶原合成与沉积,发挥抗纤维化的作用。
综上所述,依帕司他对肾间质纤维化具有一定的改善作用,其机制可能与其抑制TGF-β1介导的AR的表达、进而抑制大鼠肾小管上皮细胞EMT有关。本研究为临床防治梗阻性肾间质纤维化提供新的治疗靶点并为依帕司他的临床应用奠定一定的试验基础。

