枸杞多糖对糖尿病大鼠视网膜神经元的保护作用及其机制*
潘 虹, 施 真, 杨泰国, 于腊梅, 徐爱丽
(1. 滨州医学院生理学教研室, 山东 烟台 264003; 2. 平邑县人民医院骨科, 山东 平邑 273300)
随着我国生活水平的提高,糖尿病(diabetes mellitus, DM)的发病率日渐增加,其死亡率位于心血管疾病和肿瘤之后,列第三位,已成为严重威胁人类健康的重大公共卫生问题。糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病眼部并发症中严重的致盲病变,是导致患者失明致盲的主要原因[1]。研究发现在DR病人和动物模型中均存在体内氧化应激水平的明显升高[2-4],而且DR中出现临床可见的视网膜微血管病理改变之前即有视网膜神经细胞的功能损伤,高糖所造成的氧化应激是导致视网膜神经细胞凋亡的主要原因之一。目前单纯降血糖的治疗并不能有效阻断视网膜的损害,所以亟待寻求一种有效的药物来对抗氧化应激、保护视网膜神经细胞的正常功能,延缓DR的进展。
枸杞多糖(lycium barbarum polysaccharides, LBP)是枸杞子最主要的活性成分。研究表明LBP具有抗氧化和降血糖的作用[5,6],在链脲佐菌素(streptozotocin, STZ)诱导的糖尿病鼠和老龄鼠中LBP可保护多种组织对抗氧化应激损伤[7,8],而且LBP能够有效的改善糖尿病视网膜各层组织的病理损伤[6],但是其分子机制尚未完全阐明。有研究发现,LBP可通过促进内源性抗氧化物质的生成,如超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)等来增强机体的抗氧化能力[9,10]。但是NF-E2相关因子2(nuclear factor E2-related factor 2, Nrf2)/血红素加氧酶-1(heme oxygenase-1, HO-1)这一机体重要的抗氧化通路是否参与LBP对DR的保护效应尚未见相关报道。因此,本研究以STZ诱导糖尿病大鼠模型,观察LBP对糖尿病大鼠视网膜神经细胞的保护效应,并初步探讨其作用机制。
1 材料与方法
1.1 主要试剂
STZ购自Sigma;LBP购自上海江莱生物科技有限公司;二氢乙啶(dihydroethidium,DHE)购自Invitrogen;BCA法蛋白质定量试剂盒购自普利莱基因技术有限公司;兔抗RBPMS多克隆抗体购自ProSci Incorporated;山羊抗ChAT多克隆抗体购自Millipore;兔抗Nrf2多克隆抗体、鼠抗β-actin单克隆抗体、山羊抗兔IgG-HRP、山羊抗鼠IgG-HRP均购自Santa Cruz;兔抗HO-1多克隆抗体购自Enzo Life Sciences;DyLight 488抗兔IgG(H+L)、DyLight 488 抗山羊IgG(H+L)均购自Vector Labs。
1.2 糖尿病大鼠模型的建立及分组
8周龄SPF级雄性Sprague-Dawley(SD)种系大鼠,体重240~260 g,购于北京维通利华实验动物技术有限公司,动物合格证编号:SYXK(京)2012-0036。将18只大鼠随机分为2组,即正常对照组(NC)6只和造模组12只。动物禁食不禁水12 h,造模组大鼠均一次性腹腔注射STZ(60 mg/kg,溶于0.1 mol/L的柠檬酸/柠檬酸钠缓冲液中,质量浓度为20 g/L,pH=4.5),NC组大鼠注射相同体积的柠檬酸/柠檬酸钠缓冲液。造模3 d后,采大鼠尾尖血测空腹血糖,血糖值大于16.7 mmol/L视为糖尿病模型诱导成功,随机分为糖尿病模型组(DM)6只和LBP治疗组(DM+LBP)6只。DM+LBP组大鼠给予LBP(1 mg/kg)每天定时定量灌胃,NC组和DM组大鼠每天给予等量的生理盐水灌胃,连续给药12周。建模成功后所有大鼠每周监测空腹血糖和体重,不合格者剔除。给药完成后,检测空腹血糖和体重进行分析。
1.3 活性氧簇(reactive oxygen species, ROS)的测定
大鼠麻醉后,迅速摘除眼球,去除角膜、晶状体、玻璃体后,将带有新鲜视网膜的眼杯迅速用OCT包埋并用液氮速冻后切片,用37℃ PBS(pH 7.4)清洗5 min,用5 μmol/L DHE 37℃孵育30 min后,37℃ PBS清洗3次,用封片剂封片,荧光显微镜下绿光激发,观察和拍摄视网膜细胞红色发射图像。随机选取图像使用Image J软件测定视网膜神经节细胞层(ganglion cell layer, GCL)、内核层(inner nuclear layer, INL)和外核层(outer nuclear layer, ONL)的光密度,每个图像选取5个区域。
1.4 免疫组织化学染色法
取各组大鼠带有新鲜视网膜的眼杯,常规固定、脱水后OCT包埋,液氮速冻,在切片机上沿眼球颞鼻轴横向切割,连续切取厚度为10 μm的切片,选取包含视盘的冰冻切片用于实验。PBS清洗切片后,室温封闭1 h,然后分别加入一抗:兔抗RBPMS多克隆抗体(1∶5 000)、山羊抗ChAT多克隆抗体(1∶200),4℃孵育过夜,PBS冲洗,分别加入免疫荧光二抗:DyLight 488 抗兔IgG (H+L)(1∶ 10 000)、DyLight 488 抗山羊IgG (H+L)(1∶400)静置,室温孵育2 h,从此步骤开始以后均避光。PBS冲洗后,封片剂封片,荧光显微镜观察并拍照,分别计数GCL和INL的RBPMS、ChAT阳性细胞数。
1.5 Western blot检测Nrf2和HO-1蛋白的表达
提取各组视网膜组织蛋白,检测蛋白质浓度,调整蛋白量。取适量蛋白样品进行电泳,转膜,室温封闭1 h后,分别加入一抗:兔抗Nrf2多克隆抗体(1∶200)、兔抗HO-1多克隆抗体(1∶1 000)、β-actin鼠抗单克隆抗体(1∶2 000),4℃孵育过夜,洗膜后分别与二抗:山羊抗兔IgG-HRP(浓度分别为1∶400、1∶2 000)、山羊抗鼠IgG-HRP(1∶4 000)室温孵育1 h,充分洗膜后,在暗室中与ECL超敏感光混合液反应,X光胶片压片曝光,经显影及定影获得结果,通过扫描仪扫描胶片图像输入计算机,用软件Image J进行图像分析,以β-actin为内对照,计算相对含量。
1.6 统计学处理
2 结果
2.1 LBP对糖尿病大鼠血糖和体重的影响
与NC组比较,DM组大鼠体重明显降低、空腹血糖值升高(P<0.01);与DM组相比,LBP治疗组糖尿病大鼠的体重明显升高、血糖显著降低(P< 0.01,表1)。


GroupBody weight (g)Blood glucose (mmol/L)NC457.50±15.355.28±0.66DM246.80±7.43**23.26±2.67**DM+LBP293.10±16.06**##16.50±1.29**##
LBP: Lycium barbarum polysaccharides; NC: Normal control; DM: Diabetes mellitus; DM+LBP: LBP-treatment diabetic rats
**P< 0.01vsNC;##P<0.01vsDM
2.2 LBP对糖尿病大鼠视网膜ROS生成的影响
与NC组相比,DM组大鼠视网膜DHE的荧光强度显著增强(P<0.01),提示糖尿病大鼠视网膜ROS的生成明显增加;与DM组相比,LBP治疗组的糖尿病大鼠视网膜DHE的荧光强度显著减弱(P<0.01,图1)。
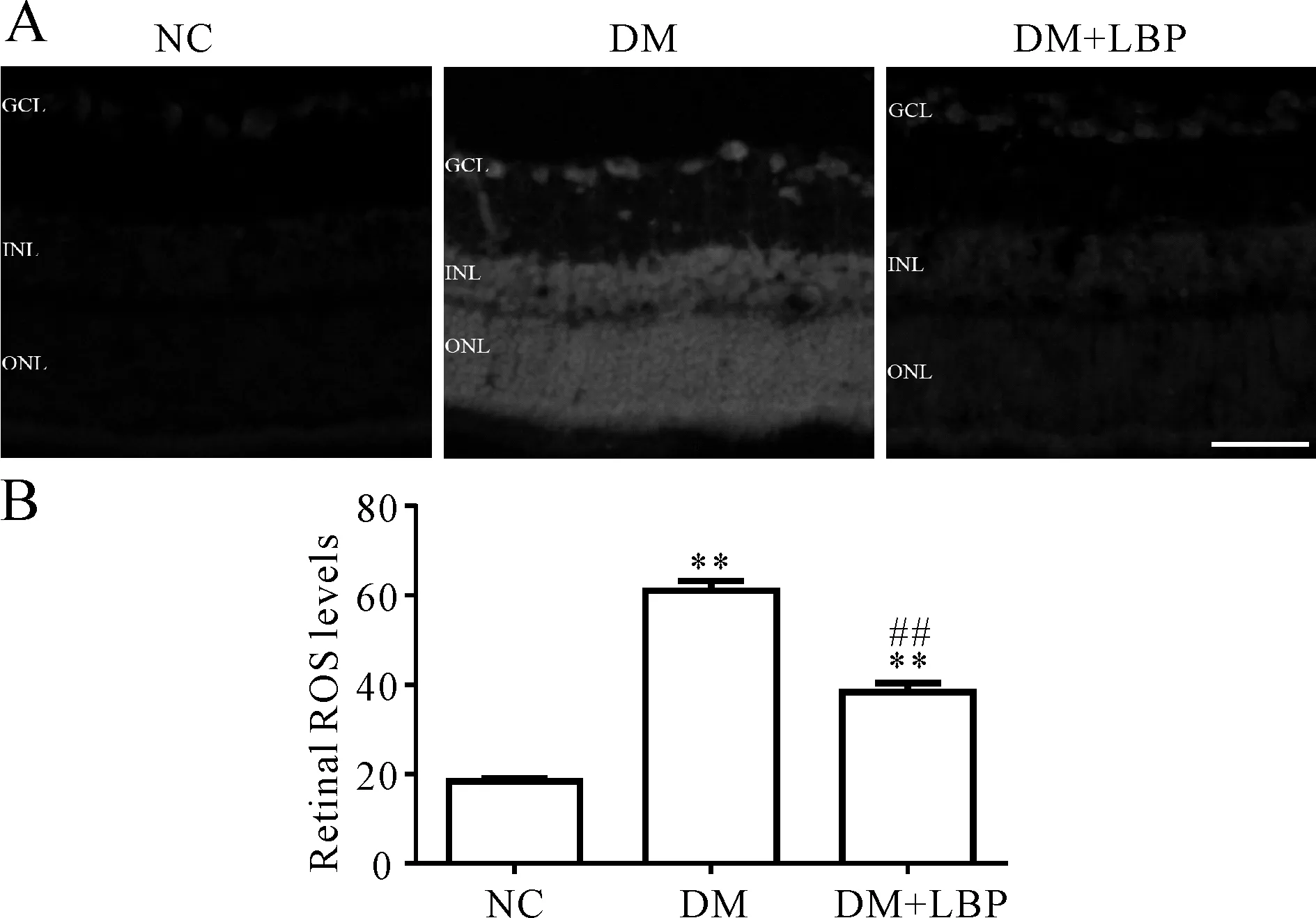
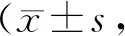
A: Representative micrographs of retinal sections stained with DHE; B: Quantification analysis of ROS levels in the whole retina. Scale bar=50 μm; NC: Normal control; DM: Diabetes mellitus; DM+LBP: LBP-treatment diabetic rats; ROS: Reactive oxygen species
**P< 0.01vsNC;##P<0.01vsDM
2.3 LBP对糖尿病大鼠视网膜神经节细胞(retinal ganglion cells, RGCs)的影响
与NC组相比,DM组大鼠视网膜RGCs数量减少68%(P<0.01);与DM组相比,LBP治疗组的糖尿病大鼠视网膜RGCs的数量明显增加(P<0.01,图2)。


A: Representative micrographs of retinal sections stained with anti-RBPMS; B: Quantitative analysis of RBPMS-positive cells in the retina. Scale bar=50 μm; NC: Normal control; DM: Diabetes mellitus; DM+LBP: LBP-treatment diabetic rats; RGCs: Retinal ganglion cells
**P< 0.01vsNC;##P<0.01vsDM
2.4 LBP对糖尿病大鼠视网膜无长突细胞的影响
NC组大鼠视网膜ChAT阳性的无长突细胞主要分布在GCL和INL的最内层;与NC组相比,DM组视网膜两细胞层的ChAT阳性细胞数量均明显减少(P<0.01);与DM组相比,LBP治疗组大鼠视网膜ChAT阳性细胞数量明显增加(P<0.05,图3)。

A: Representative micrographs of retinal sections stained with anti-ChAT; B: Quantitative analysis of ChAT-positive cells in the retina. Scale bar=50 μm; NC: Normal control; DM: Diabetes mellitus; DM+LBP: LBP-treatment diabetic rats
**P< 0.01vsNC;#P<0.05vsDM
2.5 LBP对糖尿病大鼠视网膜Nrf2和HO-1蛋白表达的影响
与NC组相比,DM组大鼠视网膜Nrf2的蛋白表达增加(P<0.01);与DM组相比,LBP治疗组大鼠视网膜Nrf2的蛋白表达进一步升高,差异有统计学意义(P<0.01);3个组间大鼠视网膜中Nrf2下游分子HO-l蛋白的表达量明显不同,与NC组相比,DM组大鼠视网膜HO-1的蛋白表达增加(P< 0.05),与DM组相比,LBP治疗组大鼠视网膜HO-1的蛋白表达明显增加(P<0.01,图4)。


NC: Normal control; DM: Diabetes mellitus; DM+LBP: LBP-treatment diabetic rats
*P< 0.05,**P< 0.01vsNC;##P<0.01vsDM
3 讨论
本研究结果发现病程12周的糖尿病大鼠体重明显降低、空腹血糖值升高、视网膜ROS生成明显增加、RGCs和无长突细胞凋亡数量增加;使用LBP治疗后的糖尿病大鼠不仅体重和血糖均有所改善、ROS生成减少、视网膜神经细胞存活数量增加,而且同时促进Nrf2/HO-1抗氧化通路的激活,以上结果提示LBP可能通过激活Nrf2/HO-1通路缓解糖尿病氧化应激导致的视网膜神经细胞损伤。
DR的发病机制十分复杂,由多种因素共同参与,目前认为高糖所造成的氧化应激损伤是糖尿病多种慢性并发症不同发病机制的共同通路[11,12]。氧化应激是由于组织或细胞的自由基产生增加以及抗氧化剂的减少而造成的氧化物质相对负载所致。越来越多的研究包括我们以往的实验均证实糖尿病大鼠视网膜存在明显的氧化应激反应增强[13],过量生成的自由基可发挥细胞毒性作用,攻击视网膜神经细胞,造成视网膜细胞的凋亡[14]。通过药物抑制体内的氧化应激可以缓解DR的严重程度[13]。我们在本实验中同样发现,与对照组相比,糖尿病大鼠视网膜ROS生成明显增加,可见其氧化应激损伤加重,同时RGCs和无长突细胞的存活数量明显减少;给予LBP治疗后显著抑制ROS生成的同时,RGCs和无长突细胞的凋亡数量也能明显减少,提示LBP对糖尿病大鼠视网膜具有抗氧化的保护效应。
本实验结果显示,LBP虽然有一定降血糖的作用,但其降血糖作用是有限的,有研究表明即使是使用高剂量的LBP并延长干预时间到20周亦不能使血糖降至正常水平[6],这提示我们LBP对视网膜的保护作用可能与其降低血糖的作用不直接相关,而是通过其他机制来实现的。
机体为了对抗多种疾病所引起的氧化应激,建立起内源性抗氧化防御体系,其中抗氧化反应元件(antioxidant response element, ARE)调控的II相解毒酶及多种下游抗氧化蛋白是机体主要的抗氧化通路之一,在多种组织器官中发挥抗氧化应激作用并维持组织正常的氧化-还原状态。Nrf2是参与氧化应激反应的重要转录调节因子,它可与ARE结合,激活下游抗氧化蛋白,如HO-1、γ-谷氨酰半胱氨酸连接酶(γ-glutamyl cysteine ligase, γ-GCL)、还原型辅酶/醌氧化还原酶-1(NAD(P)H: quinone oxidoreductase, NQO1)等,提高细胞的抗氧化应激能力[15]。HO-1的表达增加可减少ROS的产生,对抗氧化应激。通过药物诱导HO-1的表达上调可起到保护糖尿病大鼠RGCs的作用[16]。本实验中DM组大鼠视网膜ROS的生成增加,说明DM组大鼠视网膜存在氧化应激损伤,同时我们观察到DM组大鼠视网膜Nrf2和HO-1的蛋白表达均较NC组增加,说明DM组大鼠在ROS刺激作用下,体内抗氧化通路被激活,下游抗氧化蛋白表达增加,我们认为这是机体自身对抗氧化应激的一种内源性代偿机制,但不足以对抗疾病的进展。LBP作为天然抗氧化剂,可通过促进Nrf2和HO-1的表达发挥神经保护效应[5]。与以上研究结果相一致,本实验发现LBP治疗组大鼠视网膜中Nrf2和HO-1的蛋白表达较DM组大鼠进一步上调,说明LBP可以通过上调Nrf2和HO-1蛋白水平从而减少视网膜组织细胞氧化损伤的程度,保护糖尿病引起的视网膜氧化应激损伤。同时LBP治疗后糖尿病大鼠视网膜RGCs和无长突细胞的数量也明显增加,提示LBP对糖尿病大鼠视网膜的保护作用与Nrf2/HO-1抗氧化通路的激活有关。
综上所述,LBP能改善糖尿病大鼠视网膜的氧化应激状态,对RGCs和无长突细胞等视网膜神经细胞有一定的保护效应,其作用机制可能与其提高糖尿病大鼠视网膜Nrf2和HO-1的蛋白表达有关。本实验为临床上DR的早期防治提供了新的思路和重要的实验数据及理论指导。

