杏仁中央核损毁对缺钠大鼠钠欲行为启动和表达的影响*
赵志欣, 廖莹莹, 范媛媛, 蒋恩社Δ
(1. 河南大学护理与健康研究所, 开封 475004; 2. 内蒙古医科大学护理学院, 呼和浩特 010050; 3. 河南大学生命科学学院, 开封 475004)
钠离子是动物细胞外液中重要的阳离子,它对于机体维持内环境的稳态、神经元的兴奋和传导等生理过程起着十分重要的作用,但由于机体自身不能合成Na+,只能从外界环境中获取,因此动物自身形成了一套完善的摄钠和排钠机制,其中动物钠欲活动以及相关脑区对咸味觉和摄食活动的调控发挥了重要作用。钠欲是由于机体缺钠引发人和动物对正常情况下产生厌恶味觉的高浓度钠盐溶液表现出味觉喜爱,从而引发动物积极寻找并摄取大量含钠盐食物的行为[1]。这一行为学反应的意义在于能够驱使机体积极寻找并摄取外界环境中的含钠溶液或食物从而满足自身需求。对人类而言,钠欲过强时将引起机体过量摄入钠盐,从而导致或加重充血性心力衰竭、盐敏感性高血压和肝肾功能衰竭等疾病,而有效地控制钠盐摄入是治疗或改善这些疾病的基础。因此对于钠欲调控机制的研究,具有重要的价值和临床意义。
钠欲行为包括钠欲的启动和钠欲的行为表达两个过程。这些行为的产生需要肾素-血管紧张素-醛固酮系统和中枢多个核团的参与。其中,杏仁中央核(central nucleus of amygdala, CeA)被证明能够整合多种与钠欲行为相关的信息和调控动物的钠欲行为。先前的研究表明,电损毁CeA后,体钠正常大鼠对不同浓度的NaCl溶液、柠檬酸溶液和盐酸奎宁溶液的摄入量显著降低,提示CeA可通过影响中枢味觉评估机制改变大鼠对不同味觉刺激的欣快阈值,从而参与动物摄食行为的调控[2]。此外,预先损毁CeA还会显著影响臂旁核外侧区对钠欲行为的抑制性调节作用[3]。Sakai等研究工作者发现给予大鼠盐皮质激素的反义寡核苷酸激动剂去结合CeA中的盐皮质激素受体,能够明显减弱由去氧皮质酮所诱导的钠欲,但这一结果却并不影响由肾上腺切除术后产生的钠欲[4],这些实验结果均说明CeA参与正常动物钠盐摄入以及钠欲行为的调控。长期的低钠饮食可以导致动物体内缺钠进而引发动物钠欲增强,那么CeA功能是否也参与对缺钠大鼠钠欲行为表达的调控作用,有待进一步阐明。另外,在脑干NTS的尾端分布有一类醛固酮敏感神经元,因该类神经元可同时表达盐皮质激素受体和11β-羟类固醇二型脱氢酶(11β-hydroxysteroid dehydrogenase type 2, HSD2),故也被称作为HSD2神经元[5]。NTS内HSD2 神经元活动增加可以作为动物钠欲启动的标志之一,前脑CeA是否参与了低钠饮食诱导的动物钠欲的启动,尚不得而知。
本研究旨在阐明CeA损毁对低钠饮食诱发的缺钠大鼠钠欲启动和钠欲行为表达的影响,为CeA调控缺钠大鼠的钠欲行为提供实验依据。
1 材料与方法
1.1 实验动物
成年雄性SD大鼠42只,大鼠初始体重220~260 g,由西安交通大学动物中心提供,大鼠单笼喂养,实验前大鼠自由进食饮水。动物房温度维持在22~24℃,湿度55%±10%,光暗周期为12∶12 h。放置两个饮水瓶(500 ml)于笼前,间隔5 cm,在上述条件下喂养1周以适应环境。
1.2 实验分组与处理
在实验I中,选用6只成年雄性SD大鼠,每天8:00 am于笼前置于两个盛有蒸馏水(distilled water, DW)饮水瓶,并每天调换两个饮水瓶的左右位置,对大鼠进行双瓶味觉选择适应性训练5 d,于第6日8: 00 am将分别盛有DW和0.3 mol/L NaCl的饮水瓶置于笼前,检测大鼠24 h内对DW和0.3 mol/L NaCl饮用量,液体饮用量单位以毫升(ml)表示。于第7日开始给予大鼠低钠饲料喂养(含有 0.02%NaCl)和双瓶DW 饮水14 d,建立缺钠大鼠模型。于第21日再次将分别盛有DW和0.3 mol/L NaCl的饮水瓶置于笼前,检测大鼠24 h内对0.3 mol/L NaCl和DW饮用量及大鼠对0.3 mol/L NaCl和DW的偏爱率。在双瓶选择实验中,大鼠对某种味觉刺激的偏爱率可由以下公式求得:某种溶液的偏爱率 = 大鼠对某种溶液的饮用量/大鼠饮用两种溶液的总量。
在实验II中,将18只成年雄性SD大鼠随机分为3组(每组6只),分别为:双侧CeA电损毁组(lesion,L)、双侧CeA假损毁组(sham,S)和正常组(normal,N)大鼠,L组大鼠按照以下方法CeA进行电损毁,首先给予大鼠腹腔注射10%的水合氯醛(300 mg/kg)麻醉,将其俯卧位置于脑立体定位仪(SN-2N, Narishige, Tokyo, Japan)上,使其前后囟处于同一水平面。剃毛消毒后切开头部皮肤以暴露颅骨,根据Paxinos & Wastson 大鼠脑立体定位图谱确定CeA的位置(取前囟后2.5 mm,中线旁开4.2 mm,颅骨表面下7.65 mm)。用微型电钻在双侧CeA上方颅骨相应部位开孔。将损毁电极由脑表面垂直向下置入CeA正中处利用电损毁仪(UGO53500,Italy)进行损毁(400 μA,30 s)。术中所用器械及电极均需消毒,且严格遵守无菌操作流程,注意为动物保暖。术后连续3 d给予大鼠青霉素(2×105U)皮下注射以防感染。S组大鼠除了不给予CeA电流损毁外,其他操作同L组大鼠。N组大鼠不给予CeA任何处理。术后动物恢复7 d并进行单笼双瓶选择适应性训练,于第8日开始给予14 d的大鼠低钠饲料喂养和双瓶DW 饮用,于第22日给予DW和0.3 mol/L NaCl双瓶选择饮食,检测大鼠于1 h、3 h、6 h、12 h和24 h五个时间段的DW和0.3 mol/L NaCl的饮用量和计算大鼠对DW和0.3 mol/L NaCl的偏爱率。
在实验III中,将24只大鼠随机分为4组(每组6只):双侧CeA损毁+低钠饮食组(L+L)、双侧CeA损毁+正常饮食组(L+N)、双侧CeA假损毁低钠饮食组(S+L)和双侧CeA假损毁+正常饮食组(S+N)。CeA损毁及假损毁操作同上,术后给予大鼠7 d恢复期并行单笼双瓶选择适应性训练,低钠饮食组于第8日开始给予大鼠低钠饲料和DW饮食14 d以诱导大鼠慢性缺钠,正常饮食组大鼠给予正常饲料和自由饮水(DW)14 d,于第23日将大鼠麻醉、常规4%多聚甲醛灌流固定和收集大鼠大脑标本。
1.3 HSD2神经元免疫荧光染色及计数
将实验III中的大鼠大脑使用恒冷箱切片机,进行NTS后端连续冠状切片(隔3取1),片厚25 μm,每只大鼠收集2片脑切片,进行HSD2蛋白免疫荧光化学染色。将漂洗后的脑切片移入含有Rabbit anti-HSD2 一抗(14192-1-AP, Proteintech; 1∶500稀释)的抗体稀释液中,于4℃冰箱中孵育72 h。漂洗后再将脑切片移入含FITC标记goat anti-rabbit IgG二抗(SA00003-2, Proteintech, 1∶1 000稀释)的抗体稀释液中,4℃过夜。漂洗后在避光情况下将脑片裱于载玻片,并加盖玻片封片。利用荧光显微镜进行观察并拍照。利用Image-Pro Plus图像分析软件检测每张脑切片NTS内HSD2免疫阳性细胞数目,取每只大鼠2张脑切片中NTS两侧HSD2阳性细胞数的总数作为该只大鼠NTS内的HSD2阳性神经元数。
1.4 统计学处理
对于CeA损毁大鼠,在实验结束后,对大鼠双侧CeA部位进行Nissl染色并在显微镜下观察CeA损毁情况,只将CeA损毁准确大鼠的数据用于本实验的统计分析。所有的数据以均数±标准误表示。采用SPSS 22.0软件进行统计分析。利用配对t检验对实验I中的数据进行分析,用双因素重复测量的方差分析和单因素方差分析分析实验II中各组大鼠中在5个时间点上摄钠摄水量的差异,利用独立样本t检验分析实验III中各组之间HSD2阳性神经元活动的差异。
2 结果
2.1 缺钠大鼠钠欲行为的表达增强
先前的研究表明,给予大鼠8~10 d的低钠饮食就可以诱导大鼠体内缺钠以及钠欲的产生。在本研究中,当给予大鼠14 d低钠饮食后,双瓶味觉选择测试结果显示24 h 内缺钠大鼠对0.3 mol/L NaCl溶液饮用量比低钠饮食前显著增多(22.55±1.56 mlvs7.73±1.44 ml,P< 0.01),对DW饮用量却显著减少(17.22±1.64 mlvs34.75±2.59 ml,P<0.01),而总液体摄入量并没有明显变化(39.77±1.20 mlvs42.48±1.31 ml,P>0.05,图1A)。大鼠对0.3 mol/L NaCl的偏爱率在低钠饮食后较低钠饮食前明显上升(P< 0.01),而对DW的偏爱率在低钠饮食后明显下降(P< 0.01,图1B)。结果表明低钠饮食后大鼠的钠欲行为表达明显增强。


DW: Distilled water
**P<0.01vsbefore low sodium diet
2.2 CeA损毁抑制缺钠大鼠钠欲行为的表达
对CeA损毁组L、CeA假损毁组S和正常组N三组大鼠在低钠饮食后1 h、3 h、6 h、12 h和24 h对 0.3 mol/L NaCl溶液、DW、总液体饮用量及其偏爱率进行双因素重复测量方差分析,结果表明(表1),不同分组大鼠的对0.3 mol/L NaCl和DW的摄入量和偏爱率具有显著的差异。单因素方差分析表明L组大鼠在5个时间点内对0.3 mol/L NaCl溶液的摄入量比S组和N组大鼠显著减少(P<0.01,P< 0.05, 表2),对DW溶液的摄入量在12 h和24 h两个时间点内比S组和N组显著增多(P<0.05,P< 0.01,表3)。3组大鼠在5个时间点内对总液体的摄入量没有明显差异(表4)。L组大鼠比S组和N组大鼠在5个时间点内对0.3 mol/L NaCl溶液的偏爱率显著下降(P<0.01,表5),对DW溶液的偏爱率显著增高(P<0.05,P<0.01,表6)。测量时间因素对不同分组大鼠的0.3 mol/L NaCl溶液和DW摄入量和偏爱率都有显著影响。不同分组和测量时间在大鼠0.3 mol/L NaCl溶液的摄入量分析中存在交互效应,随着测量时间的延长,L组大鼠对0.3 mol/L NaCl溶液的摄入量增加幅度小于S组和N组大鼠。

Tab. 1 Summary of the results for the two-way ANOVA with repeated measurement

Tab. 2 Cumulative intake of 0.3 mol/L NaCl in rats with low-sodium diets in three groups (ml, n=6)
L: CeA lesion group; S: CeA sham group; N: Normal rat group
*P<0.05,**P<0.01vsN;#P<0.05,##P<0.01vsS
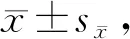
Tab. 3 Cumulative intake of DW in rats with low-sodium diets in three groups (ml, n=6)
L: CeA lesion group; S: CeA sham group; N: Normal rat group
*P<0.05,**P<0.01vsN;#P<0.05,##P<0.01vsS
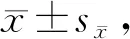
Tab. 4 Cumulative intake of total solution in rats with low-sodium diets at in three groups(ml, n=6)
L: CeA lesion group; S: CeA sham group; N: Normal rat group

Tab. 5 Intake preference of 0.3 mol/L NaCl at 1 h, 3 h, 6 h, 12 h and 24 h in three groups n= 6)
L: CeA lesion group; S: CeA sham group; N: Normal rat group
*P<0.05,**P<0.01vsN;#P<0.05,##P<0.01vsS

Tab. 6 Intake preference of DW at 1 h, 3 h, 6 h, 12 h and 24 h in three groups n= 6)
L: CeA lesion group; S: CeA sham group; N: Normal rat group
*P<0.05,**P<0.01vsN;#P<0.05,##P<0.01vsS
2.3 CeA损毁不影响缺钠大鼠钠欲行为的启动
大鼠体内缺钠可以激活NTS内的HSD2神经元,图2显示了来自CeA假损毁组大鼠低钠饮食后NTS内HSD2神经元表达情况。HSD2神经元主要分布在NTS尾端中线两侧,HSD2蛋白主要位于胞体内。HSD2神经元的胞体多呈卵圆形或圆形(图2)。实验III观察了四组不同处理大鼠NTS内HSD2神经元表达情况,结果显示,L+L组(93.00±4.35)和S+L组(98.67±11.37)大鼠NTS内HSD2神经元表达较L+N组(55.00±5.37)和S+N组 (54.67±2.62)大鼠显著增加(P<0.01)。而L+L组与S+L组大鼠之间和L+N组与S+N组大鼠之间NTS内的HSD2神经元表达没有显著性差异 (P> 0.05,图3)。结果提示,大鼠体内是否缺钠是影响钠欲启动的主要因素,不论是缺钠大鼠还是钠正常大鼠,CeA损毁与否并未影响其NTS内HSD2神经元的表达情况。

Fig.2The representative graph showing the HSD2 positive neurons in NTS in a rat with low sodium diet ( Scale bar = 50 μm). The HSD2 neurons were revealed by the immunofluorescent staining and the picture was viewed and taken under the fluorescent microscope
AP: Area postrema; CC: Central canal
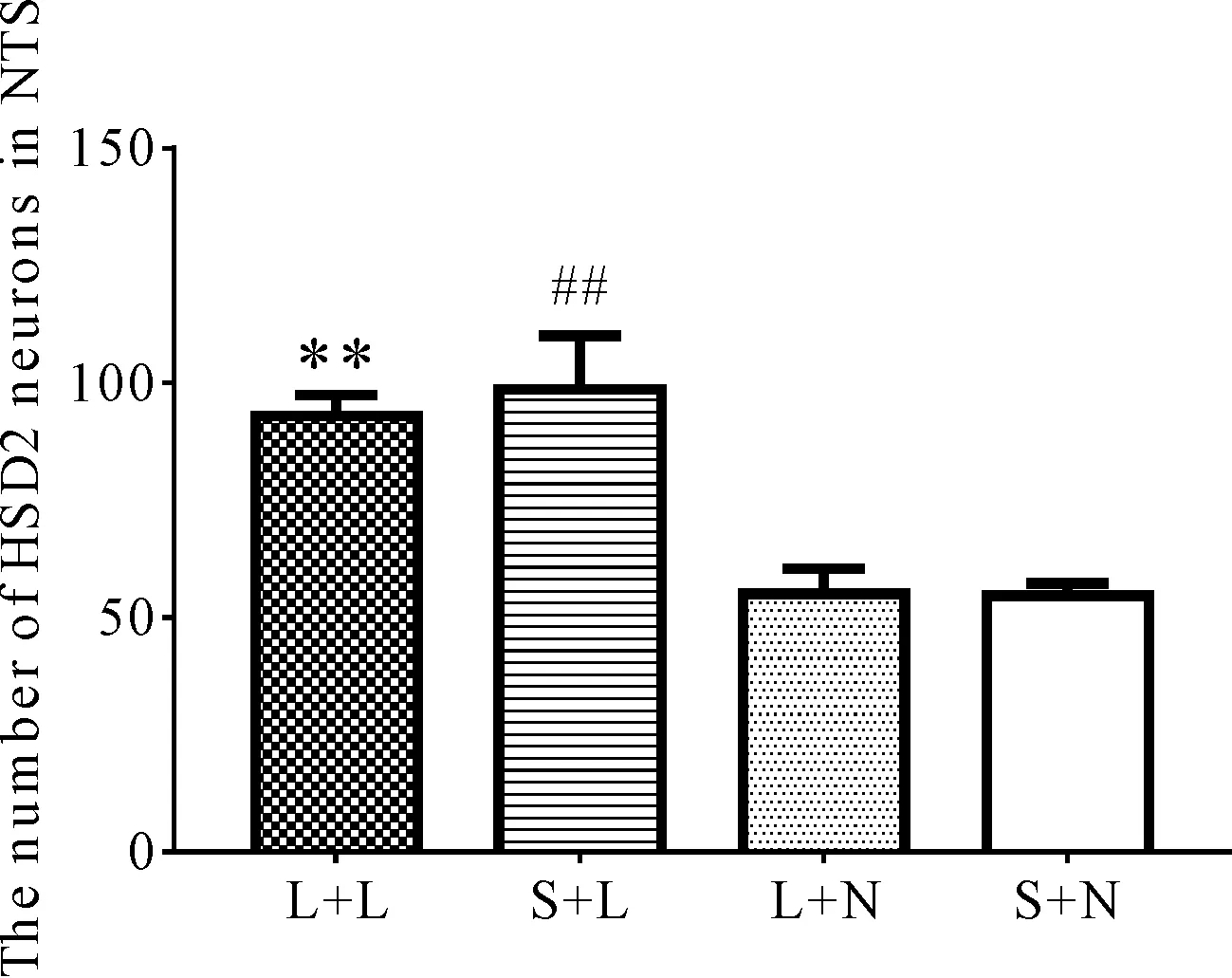

L + L: CeA lesion+ low sodium diet; S+L: CeA sham + low sodium diet; L+N: CeA lesion + normal sodium diet; S+N: CeA sham + normal sodium diet
**P<0.01vsL+N, S+N;##P<0.01vsL+N, S+N
3 讨论
摄钠行为是动物体钠缺失的一种适应性行为反应。以往有研究表明低钠饮食喂养大鼠8~10 d左右就能够诱导大鼠钠欲产生和大鼠摄钠增加,改变大鼠对咸味觉刺激的感受性,削弱大鼠脑干NTS内味觉神经元对高渗NaCl溶液刺激的反应性[6-9]。本研究中,当给予大鼠低钠饲料(0.02%)喂养14 d造成体内缺钠之后,用双瓶选择味觉测试检测大鼠对 0.3 mol/L NaCl溶液摄入量的变化,发现大鼠对 0.3 mol/L NaCl溶液的24 h饮用量较大鼠低钠饮食前明显增高,对0.3 mol/L NaCl的偏爱率显著增加。大鼠24 h内总液体的饮用量比低钠饮食前并没有显著改变。在正常情况下,大鼠对给予的高浓度的0.3 mol/L NaCl溶液起厌恶反应,这提示缺钠改变了大鼠对高浓度盐溶液的味觉喜好,使之正常体钠状态下对高浓度盐溶液的厌恶转变为低钠状态下对高浓度盐溶液的喜好。与NTS内味觉神经元口内给予高渗NaCl溶液刺激反应相一致[6-8],缺钠使得大鼠味觉感受系统对高渗盐味觉刺激的反应性降低,厌恶阈值升高,从而可以促使大鼠摄入高浓度的NaCl溶液以改善机体的钠缺乏状态。这种缺钠大鼠对高浓度钠盐溶液喜好的改变是由于大鼠中枢神经系统包括CeA在内的多个相关核团相互作用和调节的结果。
CeA是边缘前脑的重要结构,它参与中枢味觉和内脏信息的整合,也参与情绪、情感及动机的控制,CeA在维持机体水钠平衡代谢及促进摄食行为中也发挥着重要的作用[10]。此外CeA还参与了对下丘脑室旁核兴奋后引起的升压反应的调控作用[11]。已有研究表明,电损毁或化学损毁CeA后,体钠正常大鼠对于含钠溶液的摄入量明显减少[2]。本研究发现电损毁CeA强烈抑制缺钠大鼠对0.3 mol/L NaCl溶液的摄入量,损毁CeA可使缺钠大鼠对0.3 mol/L NaCl溶液摄入量下降50%以上,而对总的溶液摄入量却没有发生明显改变,这表明CeA损毁明显降低了缺钠大鼠对0.3 mol/L NaCl的味觉喜好,却对大鼠的渴感没有影响。这一结果说明CeA在功能正常的情况下,不仅具有调控体钠正常动物的钠欲行为,同时更对缺钠大鼠钠欲行为的表达具有较强的正性调节作用。在本实验中假损毁组和正常组大鼠对0.3 mol/L NaCl溶液的摄入量没有显著差异,说明假手术过程中电极进入对大鼠脑部其他部位的损伤并不影响大鼠钠欲行为的表达。
钠欲行为的产生对机体的生存至关重要,它使得动物对本来引起强烈厌恶反应的高盐溶液(如:0.3 mol/L NaCl)摄入增加,改变了对于高盐溶液的味觉喜好,以满足机体对钠盐的需求。孤束核内HSD2神经元的激活在这一过程发挥着十分重要的作用。有研究表明,通过低钠饮食诱导大鼠缺钠后引起的HSD2神经元激活程度与其所表现的钠欲程度相平行,并且当缺钠大鼠饮用含钠溶液后,HSD2神经元则会被迅速灭活[12]。因此脑干NTS内HSD2神经元参与机体钠盐需求信号的传递及钠欲行为的启动。由于缺钠导致NTS内HSD2神经元激活是动物钠欲启动的重要标志之一。钠欲的启动可由机体缺钠和后脑内人工注射醛固酮来诱导[13]。有研究表明NTS的HSD2神经元主要投射到调控钠盐摄入相关的前脑核团并接受来自CeA的下行纤维投射[14]。在本研究中,无论CeA损毁与否,并未影响缺钠大鼠和正常饮食大鼠NTS内HSD2神经元的激活。由于HSD2神经元的激活反映了钠欲的启动情况,其激活受到大鼠缺钠状态的影响,而并不受CeA的功能调控。鉴于CeA损毁显著抑制缺钠大鼠对高盐溶液的摄入量,因此,在正常情况下,CeA在调控缺钠大鼠钠欲行为的表达以及在大鼠对高浓度盐溶液的味觉评估中发挥着重要作用,而对大鼠钠欲的启动没有影响。
机体钠欲增强导致的钠盐摄入过多是诱发盐敏感高血压的重要因素之一。长期高盐饮食可以升高脑脊液内钠浓度和导致下丘脑室旁核(paraventricular nucleus, PVN)内的炎症反应,从而激活PVN内的交感神经节前神经元,引起血压升高[15]。另外,中枢高渗盐刺激也可引起PVN内GABA分泌,通过GABA受体产生升压反应[16]。因此临床上限制患者钠盐摄入是预防和治疗盐敏感高血压的重要措施之一,然而限盐导致的钠欲增强是患者遵医嘱依从性差的主要原因之一。因而在临床上可通过一些药物抑制CeA对钠欲行为表达的调控作用,进而降低患者的摄钠行为,从而提高盐敏感高血压的治疗效果。本研究为提高临床盐敏感高血压患者限盐摄入的遵医依从性提供了新的思路和实验依据。

