质粒DNA转染人PBMC电穿孔条件的影响因素
孔明圣,于洋,张亚倩,李玲,张文峰,邵红伟
(广东药科大学生命科学与生物制药学院,广东省生物技术候选药物研究重点实验室,广东 广州 510006)
在有关基因功能的研究中将目标基因导入受体细胞的效率高低对研究结果至关重要,电穿孔是基因传输常用的方法之一,相对于病毒传输系统和其他转染方法,电穿孔具有方便高效,不引入额外的转染介质,潜在副作用更低,适合各类细胞系,原代细胞和干细胞,包括一些常规方法难以转染的细胞,并且已广泛用于体外和体内各种应用,包括基因治疗,伤口愈合和药物筛选等[1-4]。
随着嵌合抗原受体修饰T细胞(CAR-T)、T细胞抗原受体(T Cell Receptor, TCR)修饰T细胞(TCR-T)等基于免疫细胞的抗肿瘤研究以及基于免疫细胞基因组编辑技术的广泛应用,目前对于T淋巴细胞等免疫细胞的基因修饰研究越来越多[5-8]。而作为原代细胞,免疫细胞尤其是淋巴细胞的基因传输效率一直是制约相关研究的重要因素。本研究通过摸索各种可能会导致电穿孔转染效率和细胞存活率的因素,对质粒转染人PBMC的电穿孔方法进行了较为详细的分析与探索,为基于淋巴细胞的相关基础研究以及临床应用提供了有益的参考。本研究分析了电穿孔电压、脉冲时间、电转缓冲液、细胞培养状态,质粒质量对转染效率和细胞活率的影响。
1 材料与方法
1.1 材料与试剂
质粒pCMV-GFP(日本NEPA GENE,4 700 bp);质粒pDC315-GFP(本实验室构建,4 700 bp);质粒pcDNA3.1-GFP(本实验室构建,7 200 bp);质粒pMax-E2F1(3 500 bp)、pEB-3xflag-GFP(8 300 bp)、px458_2A_GFP(9 300 bp)均购自Addgene;人外周血(来自本实验室志愿者);DMEM培养基、Fetal Bovine Serum、PBS pH7.2 basic(1×)、Opti-MEM、Penicillin streptomycin、RPMI-1640培养基、X-VIVO无血清培养基均购自GIBCO;QIAGEN Plasmid Plus Midi Kit(25)(QIAGEN);Toxin SensorTM内毒素检测系统(金斯瑞生物科技)。
1.2 主要仪器
NEPA21 高效基因转染系统(日本NEPA GENE);OLYMPUS IX51倒置荧光显微镜(奥林巴斯); NANODROP 2000超微量分光光度计(Gene Company Limited);GALLIOSTM流式细胞分析仪(BECKMAN COULTER);VARIOSKAN FLASH全波长光谱扫描仪(THERMO SCIENTIFIC);JS-680D全自动数码凝胶成像分析系统(上海培清科技有限公司);JS-2012细胞培养箱(THERMO SCIENTIFIC)。
1.3 方法
1.3.1 PBMC的制备 利用真空采血管抽取本实验室志愿者30 mL左右静脉血,使用淋巴细胞分离液分离PBMC。PBMC的活化培养:第1天,用无血清培养基调整细胞浓度至1~2×106/mL,加入重组人IFN-γ(1 000 U/mL);第2天,加入OKT-3(50 ng/mL)和重组人IL-2(300 U/mL);第3天细胞换液,补充重组人IL-2(300 U/mL);之后根据细胞密度每3天半量换液或细胞传代1次,并补加重组人IL-2(300 U/mL)。
1.3.2 Nanodrop2000测定质粒浓度 按照Nanodrop 2000仪器测量范围(2~15 000 ng/μL),将高浓度抽提质粒用超纯水稀释至40~50 ng/μL(电泳图计算值),每次取1 μL测量,每个样品测3次,取平均值。
1.3.3 全波长光谱扫描测定质粒纯度 将质粒用超纯水稀释至约50 ng/μL,取100 μL稀释后质粒加入到96孔微孔板中,设置扫描区间为200~400 nm进行1 nm步进的光谱扫描。
1.3.4 质粒的内毒素含量测定 将质粒稀释至约5 ng/μL,使用Toxin SensorTM内毒素检测系统对质粒的内毒素含量进行测定,详细检测方法见试剂盒说明书,检测范围为0.01~1 EU/mL。
1.3.5 质粒电穿孔转染条件的设置 将PBMC用生理盐水洗涤后计数,再用电转缓冲液洗涤1遍后调整细胞密度为2×107/mL,加入质粒10 μg/组。根据预实验结果以及厂家推荐电转的电压和脉冲时间参数,按照表1共设置了8组电穿孔条件,对未经培养刺激的PBMC进行电转。转染前,提前加入1 mL含 IL-2(300 U/mL)的X-VIVO无血清培养基于24孔板中,将孔板置于培养箱中37 ℃孵育15 min,电转完成后尽快将细胞吸回培养瓶中,置于37 ℃,5%(φ)CO2细胞培养箱中培养。
1.3.6 PI染色及流式检测 将10×Annexin-binding buffer 用超纯水稀释10倍,将细胞悬液收集到1.5 mL EP管中,离心去上清,加入100 μL/组稀释好的1×Annexin-binding buffer,吹打均匀后加入5 μL /组PI染色剂,避光孵育15 min。加入500 μL 1×Annexin-binding buffer后,转移至流式管中,上机检测。

表1 电穿孔条件Table 1 Electroporation conditions
注:+.根据推荐参数设置的测试组; -.未测试。
1.4 统计学处理
采用IBM SPSS Statistics 22统计软件进行统计学处理,以P<0.05为差异有统计学意义。为解决多组数据两两之间相似性强弱关系,采用Pearson相关分析,相关系数r大于绝对值0.8为极强相关。
2 结果
2.1 电压与脉冲时间的优化
首先对电压和脉冲时间进行了摸索(图1)。根据厂家推荐方案,设置细胞密度为2×107/mL。质粒为NEPA公司提供的阳性质粒pCMV-GFP(4 700 bp),用量为10 μg/组,电转缓冲液为Opti-MEM。按照设计的电压和脉冲时间分别进行电击,转染24 h后,进行荧光拍照和流式分析。从图1A中可以看出,在脉冲时间设定为5 ms的前提下,从150~225 V中,细胞转染效率随着电压增加而增加,至275 V后转染效率明显下降。细胞凋亡率则是一直随着电压增加而增加。电压在达到275 V后,由于细胞凋亡率的增加,导致了转染效率的快速下降。图1B中可以看出,在电压设定为200 V的条件下,细胞转染率在0.5~3 ms区间水平较低,检测不到荧光表达,而至5 ms,转染效率明显提高。细胞凋亡率在脉冲时间为0.5~3 ms之间是随着时间增加而增加的,而到了5 ms的时候,凋亡率反而比3 ms更低。说明寻找一个凋亡率较低同时转染效率较高的脉冲时间是可行的。综合考虑转染效率和细胞凋亡率,在保证更好的细胞状态下,选择200 V,5 ms作为后续实验的电击方案。
2.2 缓冲液对电穿孔效率的影响
比较了PBS,RPMI-1640和Opti-MEM 3种不同的缓冲液对电穿孔效率的影响(图2),可以看出,在转染效率上Opti-MEM>RPMI-1640>PBS;在细胞存活率上,Opti-MEM与1640比较接近,但两者都显著优于PBS组。PBS组细胞状态极差,转染荧光效率也极低,说明适合的电转缓冲液对电穿孔是非常重要。
A.比较150~275 V范围电压对电转PBMC的影响; B.比较0.5~5 ms范围脉冲时间对电转PBMC的影响。
图1不同的电压和脉冲时间对人PBMC转染效率以及凋亡率的影响
Figure1Effect of different voltages and pulse times on human PBMC transfection efficiency and apoptotic rate
2.3 细胞状态对电穿孔效率的影响
由于细胞的不同生理状态能够显著影响转染效率,对活化和静息状态的PBMC分别进行了电穿孔转染实验。从图3可以看出,不同的细胞状态下电穿孔的转染效率和细胞凋亡率有显著区别。活化培养7 d后,细胞处于增殖状态,其转染效率与静息状态的PBMC相比有明显增加,不过随之而来的是细胞凋亡率也显著增加。
2.4 质粒因素对电穿孔效率的影响
2.4.1 质粒的分子量对电穿孔效率的影响
为了比较不同分子量大小的质粒对PBMC电穿孔转染效率和细胞凋亡率的影响,选择了5种携带GFP标记的常用质粒,分别是px458_2A_GFP(9 300 bp)、pEB-3xflag-GFP(8 300 bp)、pcDNA3.1-GFP(7 200 bp)、pCMV-GFP(4 700 bp)、pMax-E2F1(3 500 bp)(图4)。对于PBMC电穿孔结果,只有观测到分子量比较小的pMax-E2F1组和pCMV-GFP组有荧光,前者的荧光率显著高于后者;而当质粒大小≥7 200 bp后并没有观测到荧光;从图中也可以看出质粒越大,细胞的凋亡率也随之增大,表明质粒大小会显著影响电穿孔的效率,同时质粒自身的性质也会影响荧光率。
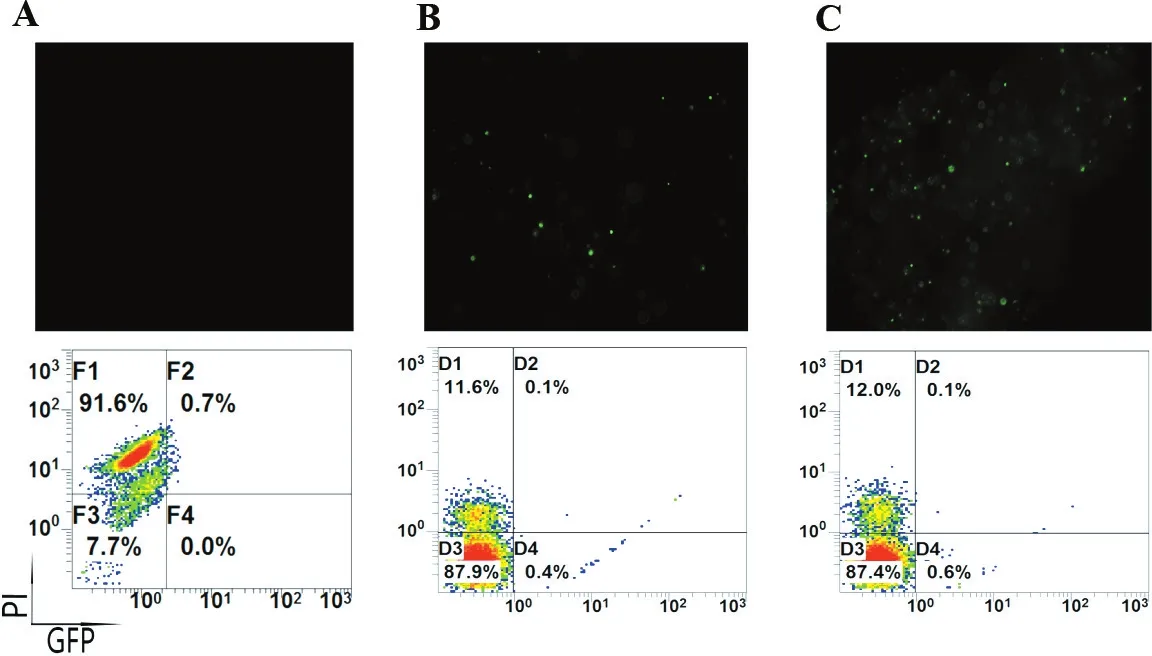
A. PBS缓冲液组; B. 1640 组; C. Opti-mem组。
图2不同缓冲液对PBMC电转转染效率和细胞凋亡的影响
Figure2Effect of different buffers on PBMC electroporation efficiency and apoptosis
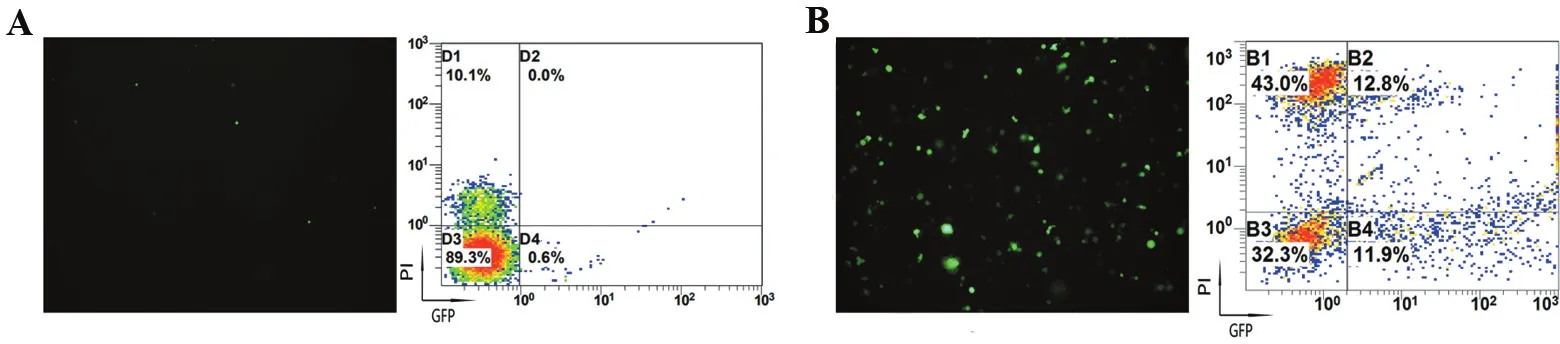
A.新鲜分离的未活化PBMC组; B.经细胞因子刺激PBMC组。
图3不同的细胞状态对电转效率和细胞凋亡率的影响
Figure3Effect of different cell states on electrotransfer efficiency and apoptotic rate
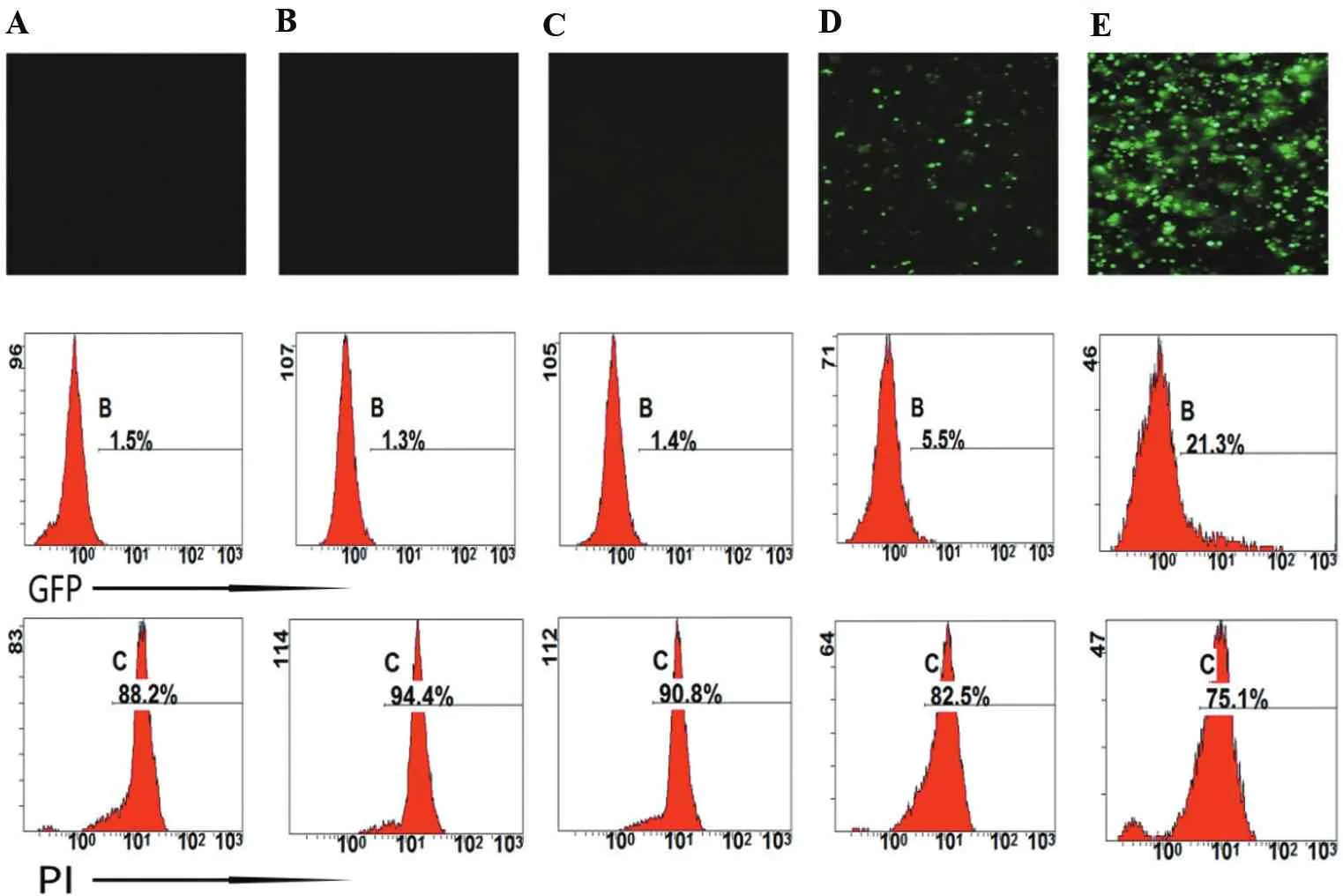
A. px458_2A_GFP(9 300 bp); B. pEB-3xflag-GFP(8 300 bp); C. pcDNA3.1-GFP(7 200 bp); D. pCMV-GFP(4 700 bp);E. pMax-E2F1(3 500 bp)。
图4质粒的分子量对电穿孔效率的影响
Figure4Effect of the molecular weight of plasmid on electroporation efficiency
2.4.2 质粒的纯度对电穿孔效率的影响
从图5的A和B中可以看出,不同方法提取的质粒其不同构象分子所占的比例差异较大,利用Nanodrop 2000检测各质粒的浓度,结果显示个别质粒所测浓度与根据电泳图灰度值所估算的浓度差异较大(表2),与之相对应的260/230比值也偏小。从这一结果推测可能其中含有杂质,利用Nanodrop 2000对各质粒进行全波长扫描,可以看出每组质粒吸收峰图无显著区别(图5C)。随后利用全波长酶标仪对质粒进行光谱扫描分析(图5D),可以看出各组质粒在200~220 nm之间的吸收光谱图存在较大差异,3号质粒在此处的波动变化最大,显示存在较多的短波长光吸收杂质,且在260~280nm之间的峰型也比较粗糙,显示杂质种类较多,这也在一定程度上解释了利用不同方法估算出的该质粒的浓度差异较大的原因。此外还对各组质粒的内毒素含量进行了测定(图5E),可以看出不同方法提取的质粒在内毒素含量上也存在较大差异。为了探讨不同方法所提质粒对PBMC电穿孔效率的影响(图5F),利用上述优化的电压和脉冲时间对PBMC进行了电穿孔转染。转染24 h后,从图中可以看出,只有1号质粒有明显的转染荧光,且细胞的存活率也是比较高的说明质粒纯度对于电穿孔转染效率和电转细胞的存活尤为重要。
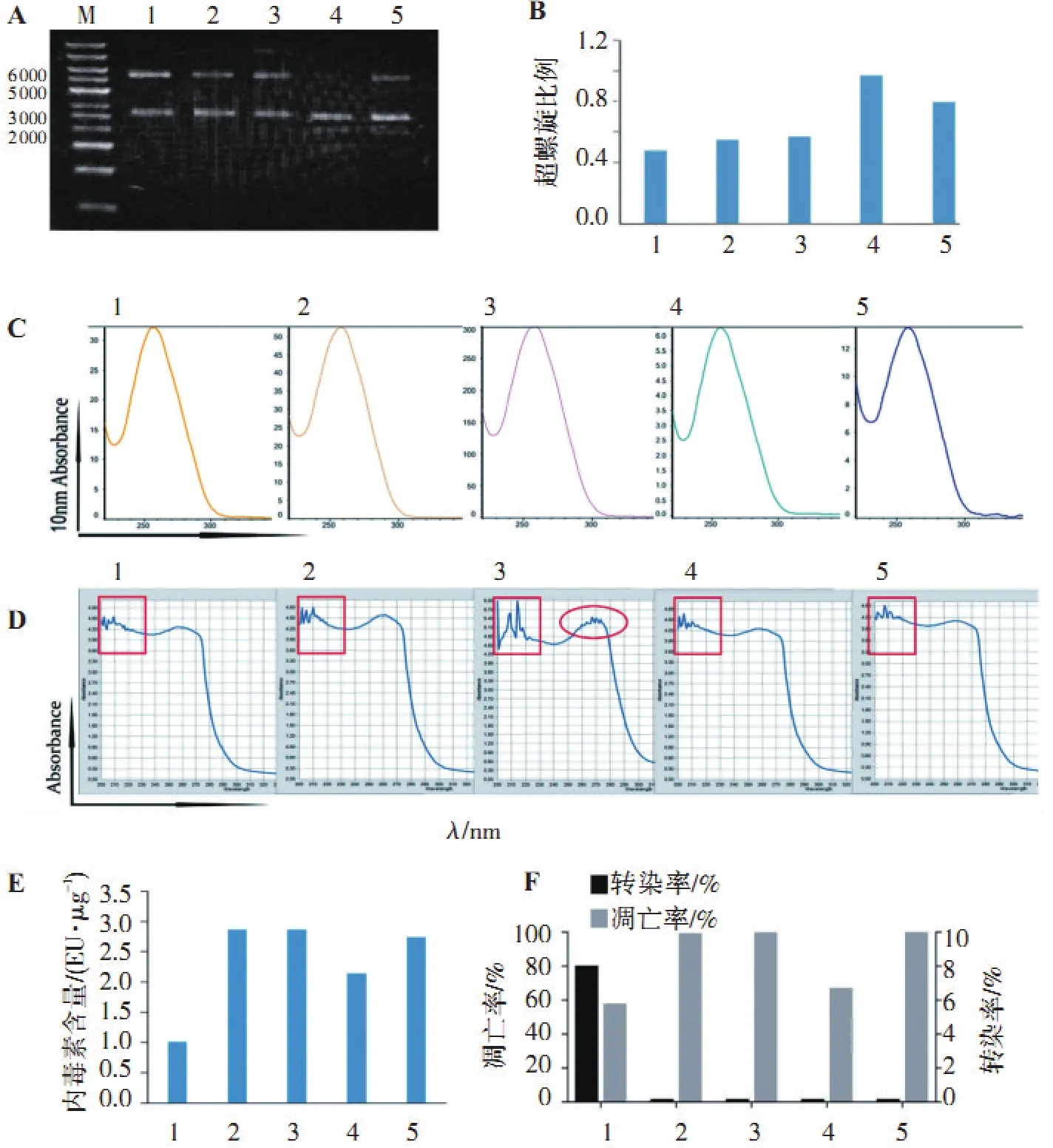
A.质粒电泳图(M:1 kb DNA Marker); B.质粒超螺旋比例; C. Nanodrop2000超微量分光光度计质粒DNA检测峰图; D.全波长酶标仪光谱扫描; E.质粒内毒素含量检测; F.质粒转染PBMC细胞转染效率和细胞凋亡率分析。
1. qiagen-pCMV-GFP; 2.国产试剂盒-pCMV-GFP; 3.传统碱裂解法-pCMV-GFP; 4.qiagen-pDC315-GFP; 5.国产试剂盒-pDC315-GFP。
图5质粒的纯度检测以及不同纯度质粒对电穿孔效率的影响
Figure5Detection of plasmid purity and effect of plasmid on electroporation
为了更好地显示各组质粒在电穿孔转染方面的差异,以HEK-293细胞作为对照组进行了转染实验(图6)。从图中可以看出1~5号质粒的转染效率分别为52%,26.5%,20.3%,22.6%,4.3%。1号和4号存活率都在65%以上,而2、3、5号组的存活率都在43%以下。
为了更好地挖掘影响电穿孔效率的信息,对所有质粒纯度相关指标和转染情况进行量化,包括以下变量:质粒超螺旋比例、质粒Nanodrop检测浓度值、内毒素含量、细胞转染效率,细胞凋亡率,使用SPSS统计学分析软件,对各个变量之间进行相关性分析以及其相关性的显著性检验(表3)。发现内毒素含量与细胞转染率、细胞凋亡率具有极强相关性(r>0.83)。
表2质粒的电泳灰度值浓度和Nanodrop2000仪器检测分析
Table2Multivariate two-way correlation analysis of plasmid factor influencing electrical transition
注:260/280、260/230为仪器检测质粒纯度的相关指标。
1. qiagen-pCMV-GFP; 2.国产试剂盒-pCMV-GFP; 3.传统碱裂解法-pCMV-GFP; 4. qiagen-pDC315-GFP; 5.国产试剂盒-pDC315-GFP。
图6质粒纯度对293细胞系电穿孔效率和细胞活性的影响
Figure6Effect of plasmid purity on electroporation of 293 cell line in control group and transfection analysis
表3质粒因素对电转影响多因素两两相关性分析
Table3Correlation analysis of the influence of plasmid factors on electrotransformation
项目r项目r项目rA :B0.313B :D0.530C :G0.739A :C0.401B :E0.088D :E0.729A :D0.265B :F0.586D :F0.871∗A :E0.423B :G0.096D :G0.572A :F0.139C :D0.926∗E :F0.736A :G0.091C :E0.930∗E :G0.861∗B :C0.200C :F0.831∗F :G0.816∗
注:A. Nanodrop2000质粒浓度值; B.质粒超螺旋比例; C.内毒素含量; D. PBMC转染效率; E. PBMC凋亡率; F. HEK-293转染效率; G. HEK-293凋亡率;*P<0.05
3 讨论
在非病毒传输系统中,能够有效地对淋巴细胞进行基因转染的方法当首推电穿孔技术,在样品制备、实验周期、便捷程度等方面,电穿孔都具有显著的优势。然而,诸多的因素,如电压、电击时间、细胞状态、电转缓冲液、质粒的纯度、大小等都会影响到电穿孔的转染效率,这极大限制了电穿孔转染的应用[9]。原代淋巴细胞的非病毒方法转染一直是难点之一,对其进行优化对于推动和简化基因相关的免疫学功能研究非常重要。目前利用电穿孔法将质粒DNA转染人PBMC的报道较少[10-13]。本研究中,首先对PBMC电穿孔的电压和脉冲时间进行了优化,可以看出随着电压的增大,细胞凋亡率会随之增大,而转染效率在一定范围内随之增大,超过一定范围反而降低。之前有研究表明,适当的电压和脉冲时间可以保证细胞在电转后尽快地……恢复,而过大的电压则会导致细胞的不可逆电穿孔[14-15]。
本研究考察了不同电转缓冲液对电穿孔效率的影响,其中Opti-MEM的转染效率和细胞存活率较高。有关电穿孔缓冲液中细胞致敏动力学的研究表明,不同缓冲液对细胞大小形态的变化,细胞骨架破坏程度和钙流入以及细胞活性的恢复都有重要的影响,因此对每种细胞,确定最适的电转缓冲液是非常重要的[16-17]。
本研究发现质粒的纯度和性质对于电穿孔转染成功与否至关重要的。考虑到电穿孔实验的各种试剂和耗材都可以方便地购买,而自行构建的质粒其所用的提取方法每个实验室都不太一样,即使是相同的提取方法,不同的提取批次也会有差异。通过电泳、微量紫外分光检测、全波长酶标仪光谱扫描、内毒素检测等多个方面对质粒进行评价,以确定重要的影响因素。许多研究者会发现,尽管经过仔细的纯化和质量控制,仍然很难重复电转仪公司所标示的基因转染效率,这很可能是由于他们使用自行构建的更大的质粒而不是公司提供的参考质粒造成的[18-19]。本研究发现不同的质粒其自身性质也会对细胞转染情况造成很大差异,尤其是分子量,大分子的DNA转染效率极低,迄今尚无好的解决办法[9,20]。此外,本研究还发现除了对质粒中内毒素、蛋白质等特定的杂质进行检测外,利用高分辨率全波长光谱扫描仪对质粒进行全面的检测也是有必要的,可以方便快捷地判断质粒的纯度。
综上所述,本研究对影响质粒转染PBMC电穿孔效率的多种因素进行了探索,优化了电压、脉冲时间、电穿缓冲液、细胞状态,阐明了质粒纯度对电穿孔转染效率至关重要,为基于淋巴细胞的基因传输相关研究以及今后的临床应用研究提供了有益的参考。

