小胶质细胞激活研究中免疫组化和荧光技术的应用
王羽茜, 张思然, 陈 璐,3, 李成檀,郑 威, 王琼珠, 赵建波, 王艳芳,张丽慧
(1.杭州师范大学医学院 医学神经生物学市级重点实验室,浙江 杭州 310036;2. 浙江医院 神经内科,浙江 杭州 310013; 3. 常州卫生高等职业技术学校,江苏 常州 213002)
脑内炎症反应是中枢神经退行性疾病包括帕金森病(Parkinson’s disease, PD)和阿尔茨海默病(Alzheimer’s disease, AD)以及脑缺血损伤的共同病理过程,在脑损伤的发生发展中起重要作用[1-2]。小胶质细胞是中枢主要的免疫效应细胞,在脑内广泛分布。各种病理刺激可诱导脑内小胶质细胞激活,炎症分子表达和释放增加与神经元变性死亡密切相关[1-2]。在神经炎症过程中,小胶质细胞形态和吞噬功能改变以及炎症分子表达变化需要基于细胞分子基础的直观研究方法。免疫组化(immunohistochemistry, IHC)和免疫荧光(immunofluorescence, IF)结合显微成像分析技术使神经炎症的可视化研究成为可能,已成为神经科学研究的重要方法[3-5]。本研究应用IHC和IF方法结合显微成像技术,监测小胶质细胞激活剂脂多糖(lipopolysaccharide, LPS)诱导的大鼠脑组织及体外培养的小胶质细胞激活改变,并探讨炎症激活过程中的LPS浓度依赖性。
1 材料与方法
1.1 主要试剂与仪器 兔抗离子钙接头蛋白分子1(ionized calcium binding adaptor molecule 1, Iba-1)抗体购于日本Wako公司,羊抗Iba-1抗体购于英国abcam公司,兔抗白细胞介素1beta(interleukin1beta, IL1beta)抗体购于英国abcam公司,异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的荧光微珠(直径1μm)购于美国Inventrogen公司,LPS和DAPI购于美国Sigma公司;BX51荧光生物显微镜购于日本Olympus公司,CCD摄像头(WV-CP-230)购于日本松下公司,石蜡切片机(RM2235)购于德国Leica公司,CO2培养箱购于美国Forma Scientific公司。
1.2 大鼠脑炎症模型 健康成年雄性Sprague-Dawleg(SD)大鼠,体重200~250 g,由杭州师范大学动物实验中心提供。所有动物实验遵照国家实验动物饲养和使用指南,大鼠称重分笼饲养,自由进食和饮水,12 h明暗循环,室温22~25 ℃。大鼠随机分为对照组和LPS组,LPS组腹腔注射LPS 2.5 mg/kg;对照组腹腔注射等容生理盐水。两组分别给药7 d后麻醉处死取脑,常规固定和处理后制作8 μm脑组织石蜡切片。
1.3 Iba-1免疫组化染色 取脑炎症模型大鼠脑组织石蜡切片42 ℃烤片2 h,再经脱蜡和水化后,枸橼酸钠缓冲溶液高温高压修复。TBST洗3次,5 min/次,5% BSA室温封闭1 h后,加1∶200羊抗 Iba-1一抗(5% BSA稀释)4℃过夜。回收一抗后,切片TBST洗3次,5 min/次。3% H2O2覆盖15 min后,再TBST洗3次,5 min/次。滴加反应增强液,室温孵育20 min,TBST洗3次,5 min/次。增强酶标兔抗山羊IgG聚合物室温孵育20 min,TBST洗3次,5 min/次。DAB避光显色15 min,流水冲洗后擦干,组织脱水透明,中性树胶封片,显微镜拍摄。
1.4 细胞培养 小鼠小胶质BV2细胞系细胞采用含10 %胎牛血清(FBS)的DMEM高糖培养基,于37℃、5 % 二氧化碳的培养箱内培养,每隔1 d换1 次培养液。细胞密度长至80%左右时,1∶2传入至新的培养皿。
1.5 小胶质细胞吞噬功能检测 将BV2细胞接种于放有盖玻片的24孔板,贴壁生长24 h后作相应药物处理。每孔加入直径1 μm荧光微珠0.4 μL,37℃孵箱温育1 h。室温下0.01mol/L PBS清洗3次,5 min/次;然后4%多聚甲醛37℃固定15 min,吸弃并晾干;室温下0.01mol/L PBS清洗3次,5min/次。破膜:室温下0.1% Triton X-100(0.01mol/L PBS稀释)孵育10 min;0.01mol/L PBS清洗3次,5 min/次。5%羊血清(PBS稀释)室温封闭2 h。回收羊血清,添加兔源Iba-1抗体(1∶2000),室温下摇床孵育30 min后湿盒4℃过夜。0.01mol/L PBS清洗3次,5 min/次,滴加用0.01mol/L PBS稀释的荧光二抗FITC-抗兔IgG(1∶200),室温避光孵育2 h后,0.01mol/L PBS清洗3次,5min/次。荧光显微镜下拍摄计数,以荧光微球在细胞膜内为阳性细胞,吞噬率=(阳性细胞数 /细胞总数)×100%,药物处理组数值为相对于对照组的百分比。
1.6 IL1beta免疫荧光染色 BV2细胞接种于无菌激光共聚焦培养皿中,贴壁生长24 h后作相应药物处理。室温下,0.01mol/L PBS清洗3次,5 min/次,4%多聚甲醛37℃固定15 min,吸弃并晾干。室温下0.01mol/L PBS清洗3次,5min/次。破膜:室温下0.1% Triton X-100(0.01 mol/L PBS稀释)孵育10 min;0.01 mol/L PBS清洗3次,5 min/次,5%羊血清(PBS稀释)室温封闭1h。回收羊血清,添加用抗体稀释液配制的兔源IL1beta抗体(1∶800),湿盒4 ℃过夜。0.01 mol/L PBS清洗3次,5 min/次,避光滴加用0.01mol/L PBS稀释的Alexa Fluor 555标记的驴抗兔荧光二抗(1∶1000),37℃避光孵育2 h,0.01mol/L PBS清洗3次,5min/次。1∶1000 DAPI室温染色10 min,PBS洗3次,5 min/次。荧光显微镜拍摄。
1.7 统计学分析 采用SPSS 16.0软件,采用单因素方差分析(One-way ANOVA)检验显著差异性,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑炎症模型中小胶质细胞激活 对照组大鼠大脑皮层有少量Iba-1阳性的小胶质细胞,胞体较小,细胞突起成细长分支状。与对照组比较,2.5 mg/kg LPS组大鼠皮层Iba-1阳性细胞胞体变大、深染,突触变短变粗,细胞形态多变。见图1。
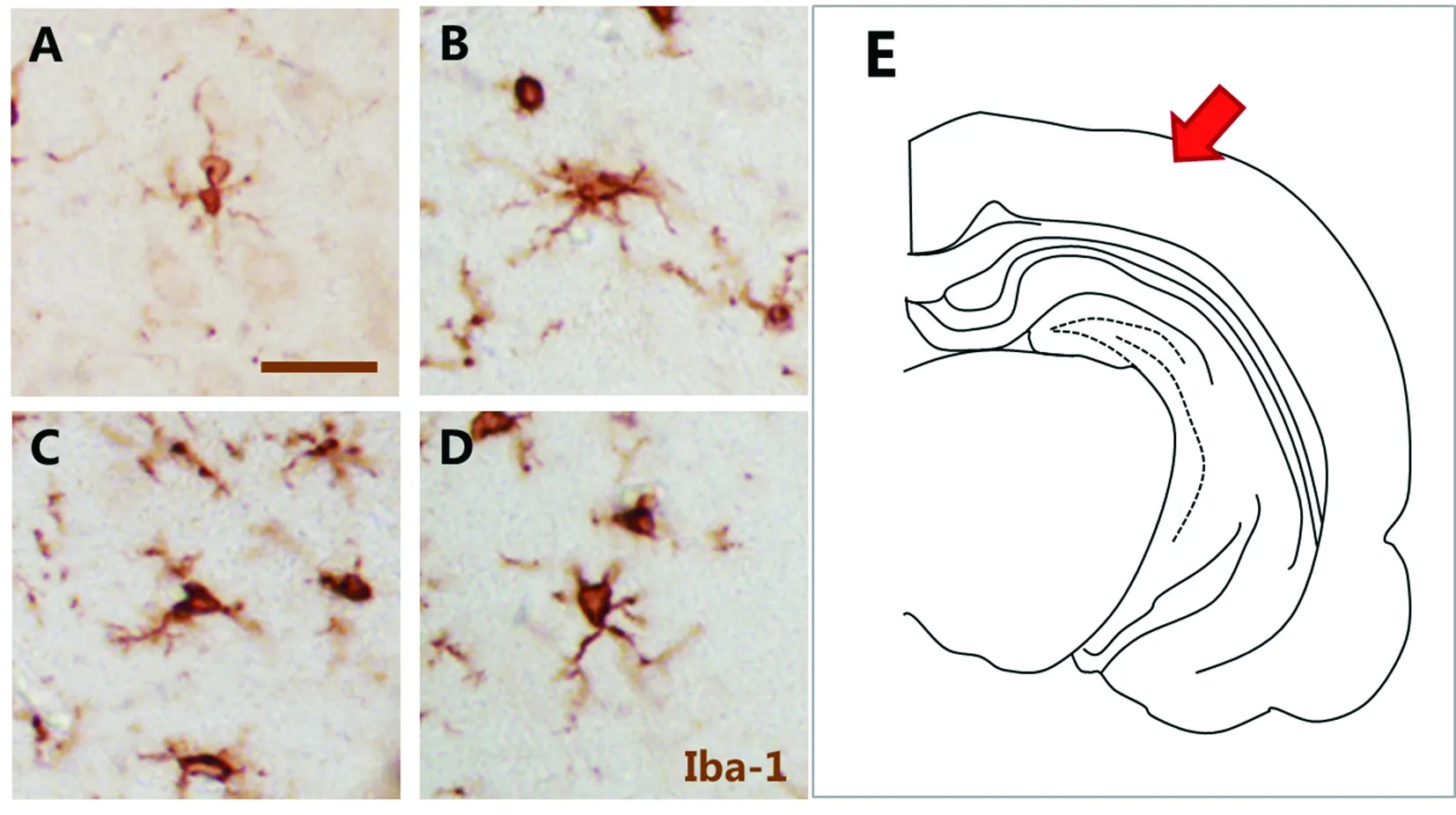
A: 对照组; B~D: 2.5 mg/kg LPS组 (标尺=20 μm); E: 小胶质细胞照片拍摄脑区。图1 IHC检测大鼠脑炎症模型中皮层小胶质细胞激活情况
2.2 BV2小胶质细胞吞噬活性 对照组可见少量BV2细胞内有FITC标记的荧光微球。LPS处理后,吞噬荧光微球的BV2细胞数量增加,10 ng/mL LPS组和100 ng/mL LPS组BV2细胞荧光微球吞噬率与对照组比较,差异均有统计学意义(P<0.05),见图2。

A:对照组;B:1 ng/mL LPS组;C:10 ng/mL LPS组;D:100 ng/mL LPS组;E:小胶质细胞吞噬活性统计分析(n=4),与Control组比较,*P<0.05,**P<0.01;标尺=20 μm。图2 IF法检测小胶质细胞吞噬活性改变
2.3 BV2小胶质细胞IL1beta表达 采用IL1beta抗体IF染色结果显示,对照组BV2小胶质细胞Alexa Fluor 555标记的IL1beta蛋白呈现微弱的红色荧光,100 ng/mL LPS处理后,BV2细胞Alexa Fluor 555标记的IL1beta蛋白红色荧光增强,见图3。

A~C: 对照组; D~F: 100 ng/mL LPS组; 标尺=20 μm。图3 IF染色显示BV2小胶质细胞IL1 beta表达变化
3 讨论
脑内小胶质细胞异常激活是导致神经元变性死亡的关键因素。LPS是经典的小胶质细胞激活剂,常用于制作脑损伤炎症动物和细胞模型[5-9]。研究表明[5-6],LPS可诱导体外培养的小胶质细胞激活以及增加神经毒性的炎症介质合成和释放。脑内或全身给予LPS,可诱导大鼠和小鼠的黑质和海马等脑区小胶质细胞激活,并进一步介导神经元死亡和神经功能障碍[7-9]。在本研究预实验中,以1.25~10 mg/kg LPS连续腹腔注射, 1.25 mg/kg LPS未能诱导明显的脑内炎症,而5 mg/kg LPS和10 mg/kg LPS处理后,大鼠死亡率增加,故本研究选用2.5 mg/kg LPS作为制作大鼠脑内炎症的合适剂量。
Iba-1是小胶质细胞特异标记物,在静息或激活的小胶质细胞中表达[10]。本研究应用抗Iba-1抗体IHC染色结果表明,生理盐水对照组大鼠皮层Iba-1蛋白呈弱表达,只见少量静息小胶质细胞,胞体小有细长突起。LPS处理组大鼠皮层Iba-1蛋白表达增高,Iba-1阳性小胶质细胞呈现增殖与形态改变,细胞体变大、深染,突起变粗变短,表明小胶质细胞反应性激活,提示应用LPS成功建立了大鼠脑内小胶质细胞激活模型,为今后课题组开展动物水平抗小胶质细胞炎症药物研究奠定了基础。
吞噬活性是神经炎症研究中评价小胶质激活的另一重要指标。体内外系列研究表明[11-13],过度活化的小胶质细胞吞噬是脑缺血后神经元迟发性死亡和缺失的重要原因;抑制脑缺血、鱼藤酮和LPS诱导小胶质细胞吞噬可减轻神经元死亡和神经损伤,提示病理条件下异常的细胞吞噬在小胶质细胞炎症及神经元死亡中的作用。小鼠小胶质细胞系BV2细胞具有高度纯化、能稳定传代并保持原代小胶质细胞的特性,常用于小胶质细胞功能调节研究[5,14]。本研究首先应用IF方法结合显微摄像技术观察LPS诱导BV2细胞吞噬FITC-标记荧光微球活性改变,结果显示,LPS可促进BV2细胞荧光微球吞噬率增加,且呈浓度依赖性。本研究进一步以流式细胞法检测同样处理的BV2细胞的吞噬功能[5],结果显示,流式细胞法检测结果与IF法结果一致,提示IF法作为一个简便有效直观的检测小胶质细胞吞噬方法,可用于细胞吞噬活性研究的初筛。
IL1beta是激活小胶质细胞合成和释放的重要炎症细胞因子,在AD、PD和脑缺血等脑损伤中具有重要作用[15]。课题组应用PD体外模型,ELISA方法检测结果表明[5,14],鱼藤酮和LPS处理的BV2小胶质细胞培养液中炎症细胞因子IL1beta和IL6浓度增加;以鱼藤酮和LPS处理的BV2条件培养液培养PC12细胞可产生明显的神经毒性;5-脂氧酶抑制剂和半胱氨酰白三烯受体拮抗剂可抑制鱼藤酮和LPS诱导的小胶质细胞炎症细胞因子产物,可减轻小胶质细胞介导的神经元死亡。本研究进一步以IF染色方法直观地证实LPS可上调小胶质细胞炎症细胞因子IL1beta的表达。
综上所述,系统应用IHC和IF技术并结合其他细胞和分子生物学实验方法,如PCR、Western blot、ELISA以及流式细胞术,可以多视角多方位地阐述神经炎症改变,对揭示小胶质细胞炎症相关的中枢退行性疾病和脑缺血的病理生理机制以及寻找潜在的治疗药物具有理论和实际意义。

