炎症指标和血液流变学指标对脑外伤术后颅内感染的预测价值
杨忠阔,连玉峰,谢永明,李超
(临海市第一人民医院1.脑外科;2.检验科,浙江 临海 317000)
外伤造成的颅脑损伤属于临床常见危重症疾病之一,具有病情严重、死亡率高的特点[1],且术后易继发颅内感染的并发症,严重危及患者的生命安全[2]。脑外伤术后继发颅内感染,在加重患者病情,增加治疗难度的同时,亦严重影响患者预后,因此,早期预测和诊断颅内感染的发生,并进行有效的预防和治疗,对改善脑外伤术后患者预后具有重要的临床意义[8-9]。可能引发颅内感染的因素较多,有研究发现,颅脑损伤后的全身炎症反应能够加重脑组织的功能损害,且增加颅内感染和全身感染的发生率[5],同时其引发的一系列应激反应,还可能诱导机体微循环的改变,血液流变学作为机体微循环状态的重要反映指标之一,亦会发生改变[6-7]。本研究探讨WBC、IL-6等炎症指标及全血黏度、全血还原黏度等血液流变学指标在脑外伤术后的变化情况及对术后颅内感染的预测价值,以期为临床早期预测和诊断脑外伤术后颅内感染提供参考。
1 资料与方法
1.1 一般资料 选取2015年6月—2018年2月我院收治的脑外伤术后继发颅内感染的35例患者作为观察组,另取同期行脑外伤术后未发生颅内感染的38例患者作为对照组。观察组中男21例,女14例,年龄19~62岁,平均42.8±7.1岁,手术时间2~8 h,平均3.6±1.2 h;对照组中男23例,女15例,年龄21~65岁,平均44.1±6.8岁,手术时间2~8 h,平均3.8±1.0 h,两组患者的一般资料比较差异无统计学意义(P>0.05)。观察组患者颅内感染的诊断标准:(1)临床上有高热、头痛、颈项强直等颅内感染的症状和体征;(2)脑脊液检查中白细胞计数>0.01×109/L,糖定量<2.25 mmol/L、氯化物<120 mmol/L、蛋白>0.45 g/L;(3)脑脊液细菌培养呈阳性结果。
1.2 选取标准 纳入标准:①均行颅脑影像学检查,诊断符合脑外伤诊断标准,并具有明确手术指征;②于受伤后48h内入院治疗;③既往无颅内感染病史;④观察组患者术后诊断均符合颅内感染诊断标准。排除合并有心肝肾等重要脏器功能严重损伤及恶性肿瘤者,合并有免疫系统及血液系统疾病者。
1.3 相关指标检测 术后第1、3、7天清晨,空腹采集患者外周静脉血5 mL,取部分静脉血于3500 r/min离心 10 min,将离心后的上清液血清与剩余全血置于-80℃冰箱中保存待用。比较两组患者的白细胞(white blood cells,WBC)计数;以BS-220 Mindray全自动生化分析仪检测血清中的炎症指标:白细胞介素(IL-6)、肿瘤坏死因子(TNF-α)、C反应蛋白(CRP)和降钙素原(PCT),人IL-6、TNF-α、CRP和PCT的ELISA试剂盒均购于上海纪宁实业有限公司,应用双抗体夹心法进行检测;以LBY-N6 Compact全自动血液流变仪测定血液流变学指标,包括全血黏度、全血还原黏度、红细胞压积、纤维蛋白原(FIB)等。
1.4 统计学方法 采用SSPS 19.0统计软件对数据进行分析处理,计数资料比较采用χ2检验,计量资料比较采用t检验;P<0.05为差异具有统计学意义。
2 结果
2.1 术后两组炎症指标的比较 术后第1天,观察组与对照组的WBC、IL-6、TNF-α、CRP和PCT数值差异无统计学意义(P>0.05)。术后第3天,观察组的TNF-α、CRP和PCT数值显著高于对照组,差异有统计学意义(P<0.05);两组的WBC、IL-6数值差异无统计学意义(P>0.05)。术后第7天,观察组的上述指标数值均显著高于对照组,差异有统计学意义(P<0.05)。见表1。
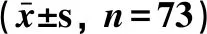
表1 术后不同时间点两组炎症指标的比较
注:*与对照组同期比较,P<0.05,下同。
2.2 术后两组血液流变学指标的比较 术后第1天,观察组与对照组的全血黏度高/低切、全血还原黏度高/低切、红细胞压积和FIB数值差异无统计学意义(P>0.05)。术后第3天,观察组的全血黏度低切、全血还原黏度低切数值显著高于对照组,差异有统计学意义(P<0.05);两组的全血粘度高切、全血还原粘度高切、红细胞压、FIB数值差异无统计学意义(P>0.05)。术后第7天,观察组的上述指标数值均显著高于对照组,差异有统计学意义(P<0.05)。见表2。
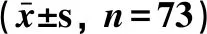
表2 术后两组血液流变学指标的比较
2.3 ROC曲线分析结果 对两组患者的上述各炎症和血液流变学指标进行ROC曲线分析,结果显示,术后第1天,各指标对颅内感染的诊断差异均无统计学意义(P>0.05);术后第3天,全血黏度低切、全血还原黏度低切、TNF-α、CRP和PCT指标对颅内感染的诊断差异有统计学意义(P<0.05),其余指标则无统计学意义(P>0.05);术后第7天,各指标对颅内感染的诊断差异均有统计学意义(P<0.05)。见表3。
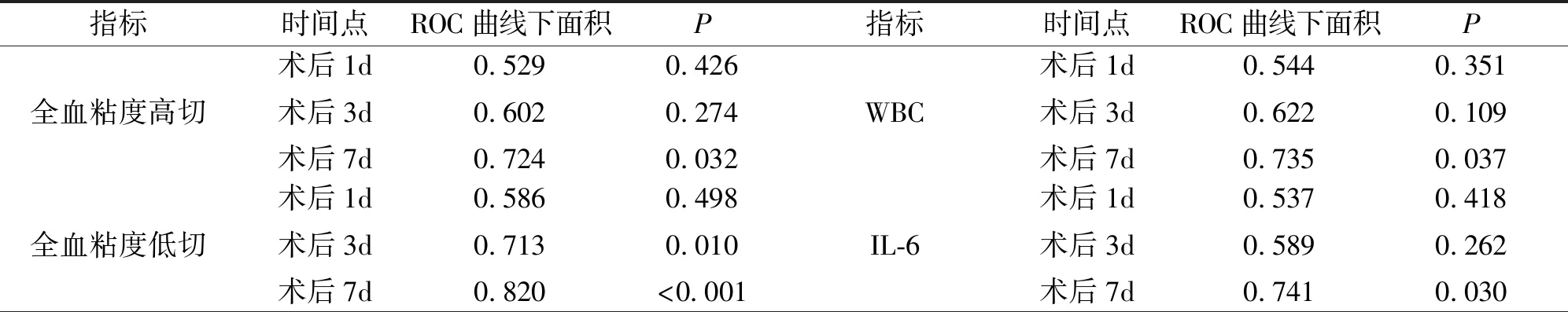
表3 术后炎症指标和血液流变学指标的ROC曲线分析结果(n=73)

表3(续)
3 讨论
脑外伤患者由于伤情危重,机体免疫力低下,手术后发生颅内感染的几率较高,因其发病隐匿、进展迅速,如治疗不及时,往往对患者的生命安全构成极大威胁[8]。脑外伤术后颅内感染的症状并不十分典型,如颅内出血引发脑脊液中混杂红/白细胞,人工硬脑膜的植入,血性脑脊液刺激等原因,均会对颅内感染的确诊造成一定的干扰[9-10],故而,临床上寻找特异性和敏感度较高,不易被各种非感染性因素所干扰的诊断指标,对于脑外伤术后颅内感染的早期预测和诊断,积极治疗并改善预后,均具有重要的临床价值。
现代医学研究发现,脑外伤后颅内感染会引发一系列的脑及全身生理病理改变,如颅内出血、血管内皮损害、微血管血栓、脑血流量下降、血黏度增加、红细胞聚集增强等,这些变化均可能引发颅内感染患者血液流变学的改变[11-12]。另外,脑外伤造成的颅内血管扭曲、颅内高压、机体炎性反应、创伤性应激反应等因素也会对机体微循环状态造成影响[3,12],血液流变学作为有效反映机体微循环状态的重要指标之一,亦会受到影响。全血黏度、全血还原黏度、红细胞压积均属于血液流变学的临床常规检测指标,纤维蛋白原(FIB)亦是反应血液高粘状态和机体炎性反应的一个重要指标,脑外伤患者血清FIB升高易诱发血栓的形成,从而引发各种心脑血管事件的发生[13]。
白细胞(WBC)、白细胞介素(IL-6)、肿瘤坏死因子(TNF-α)、C反应蛋白(CRP)、降钙素原(PCT)均是临床上常用的炎症指标。其中,临床上WBC数值高于正常水平时,预示机体存在细菌感染的可能性[14]。CRP和PCT均属于机体急性感染性指标,在机体受到细菌感染后,其血清浓度会在短时间内迅速升高,故而常作为临床上感染早期诊断的重要敏感指标[15-16]。IL-6广泛存在于中枢神经系统中,对神经元表达敏感性较高,该指标广泛参与机体免疫应答和炎症反应,在神经系统和机体应激反应中均发挥着重要的作用,脑外伤患者IL-6水平升高,不仅意味着颅内存在感染风险,其含量高低对神经元损伤的严重程度亦存在一定的预测作用[17]。TNF-α作为细菌毒素和其他炎症刺激因子作用于巨噬细胞和单核细胞产生的一种重要促炎因子,能够诱导一系列的炎症反应[18-19]。在颅内细菌感染的过程中,TNF-α可通过释放内毒素等炎性成分,刺激相关炎症因子产生协同作用,共同侵犯机体[10]。
国内外众多文献报道显示,脑外伤术后颅内感染易发生在伤后7天内,故而本研究通过对术后第1、3、7天的上述炎症和血液流变学指标分别进行监测,通过对手术后发生颅内感染和未发生颅内感染患者的比较,探讨各指标对脑外伤术后颅内感染的诊断预测价值。结果显示,随着术后时间的增长,TNF-α、CRP、PCT及全血黏度、全血还原粘度等各指标数值的增长越明显,其对颅内感染的预测能力越大。由此可见,术后定期监测炎症指标及血液流变学指标数值对脑外伤术后颅内感染的诊断具有一定的预测价值。

