柑橘酒发酵过程中总黄酮、柠檬苦素和诺米林含量变化
曾竟蓝,马胤鹏,秦 丹,2,曾 璐*,陈长松
(1.湖南农业大学 食品科学技术学院,湖南 长沙 410128;2.湖南农业大学 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南农业大学 湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;4.天下果业开发有限公司,湖南 湘西自治州 416000)
柑橘酒具有酒精度低、酒质温和爽口的特点,基本保留柑橘原有风味和功效,并且具有防衰抗老、润肺、补肝、安神等保健作用[1]。柑橘酒中存在多种功能性成分,如类胡萝卜素、黄酮类化合物和类柠檬苦素等。柑橘中的类黄酮是一种具有C6-C3-C6苯并呲喃酮结构的多酚类化合物,具有抗肿瘤、抗病菌、抗炎、降低毛细血管脆性、抗过敏、抑制血小板凝集等多方面的药理作用[2-3]。因此,柑橘酒中的黄酮含量可作为评价其营养保健价值的一个重要指标。类柠檬苦素是一类高度氧化的四环三萜类化合物,常以苷元和配糖体存在,具有抗氧化性、抗肿瘤、抗心血管疾病、抗炎镇痛、抑菌抗病毒等多种生物活性[4-6]。据报道,现已分离出类柠檬苦素苷元36种,类柠檬苦素糖苷17种,其中柠檬苦素(limonin)和诺米林(nomilin)最具代表性[7]。果汁中的A-环内酯能在酸性条件下被柠檬苦素D-环内脂水解酶催化形成柠檬苦素,产生果汁加工“后苦”的现象[8],尤其在冰冻、机械损害这类非正常条件下的水果组织破坏,可增加果肉酸度和提高酶活,促使柠檬苦素生成量增加[9]。在柑橘果汁加工中,通常认为柠檬苦素和诺米林为代表的苦味物质阈值为6 mg/L,超过该质量浓度则太苦而不宜用于饮料加工[10-11]。由此可知,柠檬苦素类似物虽具有多种生物活性,但它们带来的苦涩味严重影响了柑橘酒的口感,制约着柑橘酒的发展[12-13]。因此,了解柠檬苦素类似物在柑橘酒酿造过程中的变化规律显得尤为重要。
目前,有关柑橘酒的研究主要针对于产品品质和风味的提高,而其发酵过程中功能性成分的变化方面尚未见报道。基于此,本研究以实验室自酿的柑橘酒为试验材料,利用分光光度法和高效液相色谱(high performance liquid chromatograph,HPLC)法分别对柑橘果酒发酵过程中发酵液的总黄酮和苦味物质(即柠檬苦素和诺米林)进行跟踪监测,分析其含量在发酵过程中的变化趋势,为以期为柑橘酒中功能性成分含量的提高,以及柑橘酒的进一步开发提供参考。
1 材料与方法
1.1 材料与试剂
柑橘:湖南湘西椪柑;酵母:意大利SC果酒酵母;蔗糖:广西贵糖集团股份有限公司;氢氧化钠、葡萄糖、盐酸、硫酸、柠檬酸、二甘醇(均为分析纯)、乙腈、磷酸(均为色谱纯):国药集团化学试剂有限公司;柠檬苦素标准品、诺米林标准品(均为色谱纯):成都曼斯特生物科技有限公司;橙皮苷标准品(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
JYZ-E8型榨汁机:九阳股份有限公司;MJ-250B5-Ⅱ型生化培养箱:上海新苗医疗器械制造有限公司;LXJ-IIB型离心机:上海安宁科学仪器厂;PHS-3B型酒精计:翼州市耀华器械仪表厂;JA2003N型电子天平:上海箐海仪器有限公司;101-2AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;PGSJ-3F型pH计:上海仪电科学仪器股份有限公司;721型可见光分光光度计:上海光谱仪器有限公司;1260高效液相色谱仪:美国Agilent公司。
1.3 试验方法
1.3.1 柑橘酒的加工工艺流程及操作要点

操作要点:将鲜果处理好后榨汁去渣,得椪柑浊汁,调整初始糖度为24%,接种SC果酒酵母,接种量为0.04%,发酵温度控制在21℃,主发酵1~2周,残糖量低至6 g/L后,转入后发酵,温度控制在15℃以下,后发酵持续约一个月,使残糖降至2 g/L以下。后发酵结束后,用四层纱布过滤,分离酒脚,温度控制在15℃进行陈酿3个月以上,在低温条件下用棉饼(或硅藻土)过滤机过滤、装瓶,得柑橘酒成品。
将整个发酵过程分为鲜果、起酵、发酵旺盛、主发酵、后发酵这五个阶段来取样分析酒中各指标的变化。
1.3.2 柑橘酒中总黄酮含量的测定
参照国标GB/T 12143—2008《饮料通用分析方法》[14],以橙皮苷标准品为对照,采用分光光度法测定柑橘酒中总黄酮的含量。
1.3.3 柑橘酒中柠檬苦素和诺米林含量的测定
采用HPLC法测定柑橘酒中柠檬苦素和诺米林的含量[15-16]。
样品处理:准确吸取柑橘酒5 mL于10 mL容量瓶中,以乙腈定容,摇匀,超声处理20 min,用0.45 μm微孔滤膜过滤,平行制备3份待测液。
高效液相色谱条件:Agilent ZORBAX SB-C18色谱柱(4.6mm×250mm,5μm);流动相为乙腈∶0.1%磷酸水=55∶45(V/V);柱温35℃;流速1mL/min;进样量10μL;检测波长为210nm,波长扫描范围为200~400 nm。
柠檬苦素和诺米林的标准曲线绘制:准确称取柠檬苦素和诺米林标准品各90 mg,用乙腈超声辅助溶解并定容至100 mL,摇匀,配成质量浓度均为90 mg/L的混合标准溶液。再依次稀释成0.9 mg/L、1.8 mg/L、4.5 mg/L、9.0 mg/L、18 mg/L、45 mg/L的柠檬苦素和诺米林系列标准溶液,以质量浓度(x)为横坐标,峰面积(y)为纵坐标分别绘制柠檬苦素和诺米林标准曲线。
1.3.4 其他理化指标的测定
酒精度:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的酒精计法;总糖:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法;总酸:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的指示剂法[17]。
1.3.5 数据处理
应用Excel和SPSS20.0软件进行数据处理分析。
2 结果与分析
2.1 柑橘酒发酵过程中总糖含量和酒精度的变化
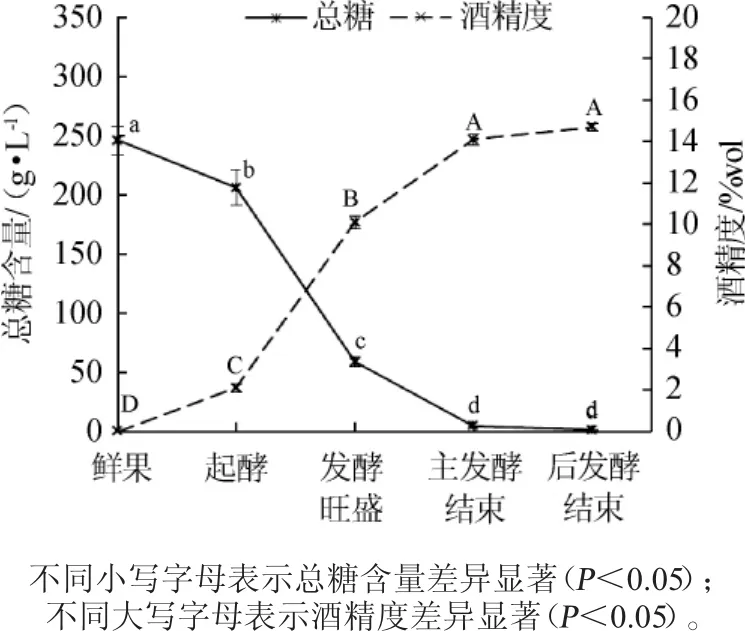
图1 柑橘果酒发酵过程中总糖含量和酒精度的变化Fig.1 Changes of total sugar content and alcohol contents in citrus wine during fermentation process
由图1可知,发酵前3 d,发酵液中总糖含量的变化不大,可能因为酵母菌刚接种处于菌体增殖起始期,酵母菌菌体数量在较低水平。观察发酵液变化情况发现,第3天发酵液上层有少量气泡产生而下层较平静,进入起酵期。此时,发酵液中总糖含量缓慢降低,酒精度缓慢增加。第6天发酵液中有大量气泡产生,进入发酵旺盛期。此时,发酵液中酵母菌的菌体数量呈对数增长,大量消耗糖分,发酵液中总糖含量急剧下降,酒精度含量快速上升。随着发酵液中糖的消耗和酒精度的提高,酵母的生长繁殖受到抑制,在第16天时,无明显起泡现象,视为主发酵结束。此时发酵液中总糖含量为5.75g/L,酒精度为14%vol。在后发酵阶段,发酵液中总糖含量较低且下降缓慢,酵母生长繁殖活动减弱,酒精度无显著变化。第45天柑橘酒的后发酵结束,此时发酵液中总糖含量为1.26 g/L,酒精度为14.7%vol。在整个发酵阶段,酒精生成和糖降解速度呈现出一定的一致性。
2.2 柑橘酒中总黄酮含量的变化
不同柑橘种类含有的黄酮种类不同,本试验中所用湘西椪柑属于宽皮柑橘,其中黄酮类物质中黄烷酮含量较高,占黄酮总量的80%,且以橙皮苷为主[18]。因此,以橙皮苷为标准品测定柑橘酒中总黄酮的含量。
2.2.1 橙皮苷的标准曲线
以橙皮苷质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制橙皮苷标准曲线,结果见图2。由图2可知,橙皮苷标准曲线回归方程为:y=0.009 1x+0.007 4,相关系数R2为0.999 6,表明二者线性关系良好。
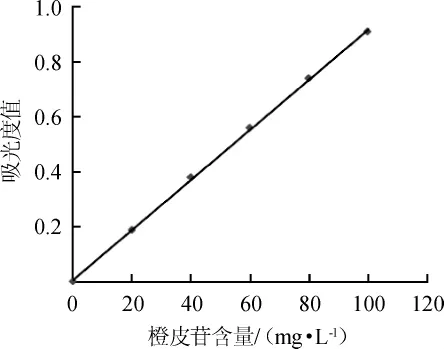
图2 橙皮苷标准曲线Fig.2 Standard curve of hesperidin
2.2.2 柑橘酒发酵过程中总黄酮含量的变化
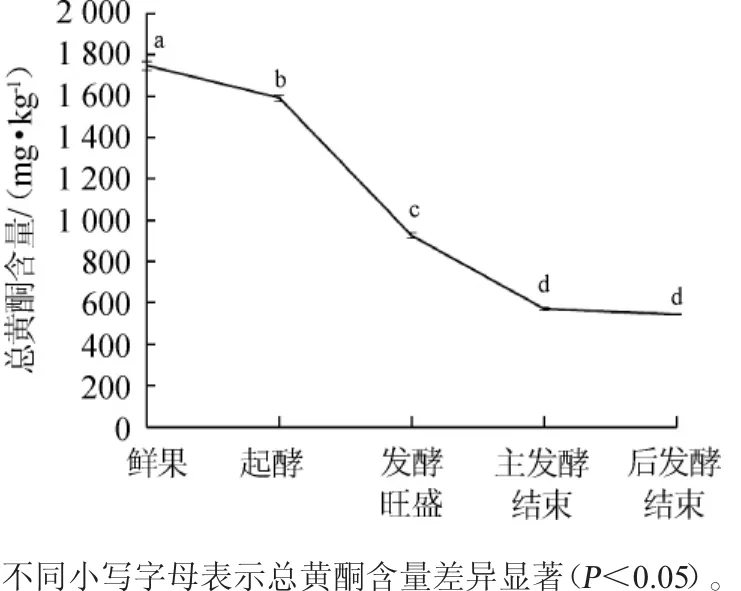
图3 总黄酮含量在柑橘酒发酵过程中的变化Fig.3 Changes of total flavonoids contents in citrus wine during fermentation process
由图3可知,柑橘鲜果中总黄酮含量较高,未发酵的橘汁中总黄酮含量高达1747mg/kg。在果酒的起酵阶段,总黄酮含量变化缓慢,随着发酵的开始总黄酮含量的变化速率加快。在发酵旺盛时期,随着酵母菌的快速繁殖,酒精的大量生成,果酒中总黄酮含量显著下降(P<0.05),而在果酒主发酵结束后,总黄酮含量下降较缓慢,并趋于平稳。在柑橘酒发酵过程中,总黄酮的含量呈下降趋势。总黄酮含量在主发酵时期下降较明显,主发酵结束后,发酵液中总黄酮的含量下降到566.3 mg/kg,随着主发酵的结束,发酵液中总黄酮含量的变化趋于稳定,后发酵结束时柑橘酒中总黄酮含量为544.32 mg/kg。在柑橘酒发酵过程中,柑橘酒总黄酮含量的降低一方面可能是由于酵母产生的次级代谢产物(如丙酮酸、乙醛等)与黄酮类物质反应,生成一些大分子衍生物,而导致酒中总黄酮含量下降;另一方面可能是在发酵过程中,微生物产生一些酶使其发生降解,导致其水溶性降低,从而使酒中总黄酮含量下降[19]。尽管柑橘酒中总黄酮含量有所下降,但其含量显著高于其他果酒如枸杞酒[20-21]、山楂酒[22]等,因此,仍具有较大的商品价值。
2.3 柑橘酒中柠檬苦素和诺米林含量的变化
柑橘酒中最常见导致苦味的萜类化合物是柠檬苦素和诺米林,与其他萜类化合物相比,其含量在果实中较高,也与柑橘加工“后苦味”有关[23]。因此,选择柠檬苦素和诺米林两种物质为代表探究其在发酵过程中的变化。
2.3.1 柠檬苦素和诺米林的标准曲线
以质量浓度(x)为横坐标,峰面积(y)为纵坐标分别绘制绘制柠檬苦素和诺米林的标准曲线见图4。由图4可知,柠檬苦素和诺米林标准曲线线性回归方程分别为y柠=6.498 8x-0.095 2和y诺=6.498 8x-0.095 2,相关系数R2均为1,结果表明,柠檬苦素、诺米林在质量浓度0.9~45mg/L内具有良好的线性关系,可以用于定量检测。
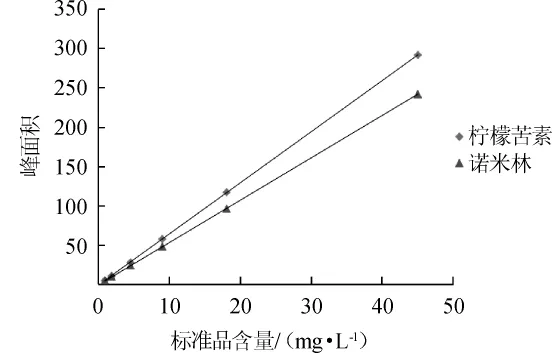
图4 柠檬苦素和诺米林的标准曲线Fig.4 Standard curves of limonin and nomilin
2.3.2 柑橘酒发酵过程中柠檬苦素和诺米林的变化
由图5可知,柑橘汁中柠檬苦素含量很低,为2.21mg/L。从起酵过程中柠檬苦素含量显著升高至15.65mg/L(P<0.05),但随着发酵的进行,柠檬苦素的含量逐渐减少,直到主发酵结束,发酵液中柠檬苦素降至10.87 mg/L,在主发酵结束后,无显著变化且趋于稳定(P>0.05),诺米林的变化规律与柠檬苦素类似。在起酵的过程中其含量显著增加至3.37 mg/L(P<0.05),进入发酵旺盛期后小幅增加至3.55 mg/L。主发酵结束时,发酵液中诺米林含量显著减少至2.20 mg/L(P<0.05),在后发酵时期逐渐趋于平衡。新鲜的柑橘中柠檬苦素类似物的含量极少,经榨汁后柑橘中含有的A-环内酯暴露在酸性环境中,快速地被柠檬苦素D-环内脂水解酶催化水解,生成有苦味的柠碱[24-26]。因此,起酵时期发酵液中柠檬苦素、诺米林含量显著升高(P<0.05)。随着发酵的进行和酵母的繁殖,在主发酵结束时,发酵液中柠檬苦素和诺米林含量显著降低,可能是由于酵母发酵中产生的代谢产物与其反应,使其水溶性降低,发生沉降,导致发酵液中柠檬苦素、诺米林的含量降低。故而在发酵过程中,发酵液中柠檬苦素与诺米林的含量逐渐减少,直至趋于稳定。
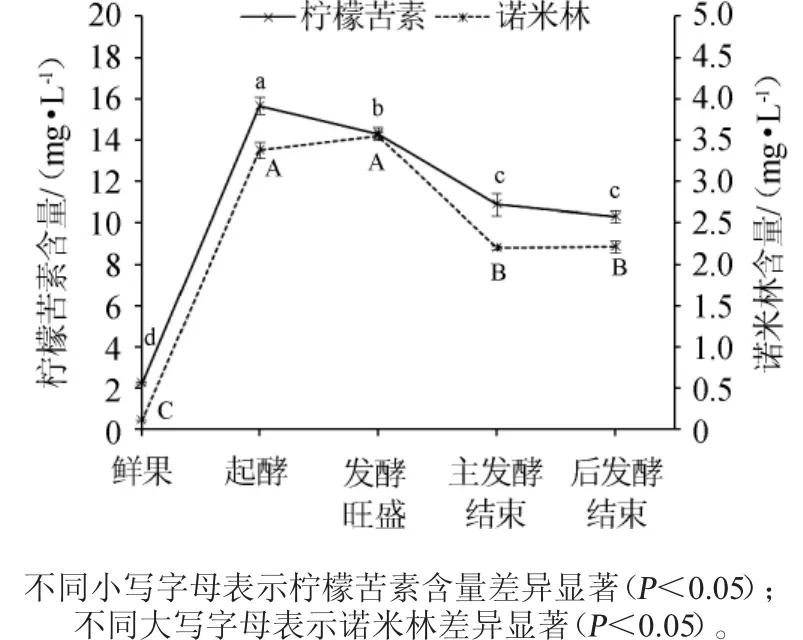
图5 柠檬苦素和诺米林在柑橘酒发酵过程中的变化Fig.5 Change of limonin and nomilin in citrus wine during fermentation process
3 结论
本试验探究了总黄酮、柠檬苦素和诺米林含量在柑橘酒发酵过程中的变化。结果表明,在发酵过程中柑橘酒总黄酮呈持续下降的变化趋势,主发酵结束后下降至566.3mg/kg,与原汁相比减少了67.58%。柑橘酒中柠檬苦素和诺米林均呈先增大后减小趋势,起酵后含量达最高。经发酵后酒中柠檬苦素和诺米林显著下降(P<0.05),发酵结束时分别下降30.54%和34.72%。柠檬苦素、诺米林虽是柑橘酒中的重要功能性成分之一,但因其具有的“后苦味”,也是影响柑橘酒品质的重要苦味物质。因此,了解这些物质在柑橘酒发酵过程中的变化,有利于柑橘酒发酵工艺的改进,同时也为低苦、高黄酮含量柑橘酒的研发提供基础数据。

