靶向LETMD1的miR-494对宫颈癌发病的作用
李 新,董立新,杨 森,曹丽艳,毛 羽,付占昭,董思奇
目前,宫颈癌已成为最常见的妇科恶性肿瘤之一,2012年全球共有新发病例近53万例,病死率约为50%[1, 2],且发病呈年轻化趋势。因此,探索宫颈癌发生发展的潜在机制,以便实现宫颈癌的早期诊断和有效治疗是十分必要的。LETMD1,又称人宫颈癌基因(HCCR),最早在宫颈癌组织中发现[3],但LETMD1在宫颈癌中的上游调控机制目前尚未明确。MicroRNA(miRNA)是一种非编码RNA,其主要通过与靶基因mRNA结合,诱导靶mRNA降解或翻译抑制。目前有研究证实,miRNA参与肿瘤的发生发展,参与调控肿瘤的恶性生物学行为[4, 5]。本研究通过生物信息学分析和实验证实过表达miRNA-494可靶向作用于LETMD1,进而抑制宫颈癌细胞的增殖,旨在对筛选出宫颈癌中靶向作用LETMD1的特异性miRNA有所帮助。
1 材料与方法
1.1 材料 选取2017-09至2018-03秦皇岛市第一医院诊断为原发性宫颈癌30例的组织标本。入选标准:(1)接受根治性子宫切除及盆腔淋巴结清扫术;(2)有完整临床资料者;(3)接受手术获取标本前未接受过放疗或化疗等治疗;(4)签署知情同意书。另选择同期妇科良性疾病行全子宫切除的30例的正常宫颈组织标本进行对照。所有诊断均经病理科医师证实。宫颈组织离体后马上收取,置于冻存管中,-80 ℃冰箱保存直至使用。所有组织标本使用均获得医院伦理委员会批准。
1.2 方法
1.2.1 miR-494靶基因预测 通过 TargetScan、miRanda等基因预测网站预测miR-494靶基因。
1.2.2 细胞培养 实验所用宫颈癌细胞株(HeLa和SiHa)购自上海生物化学与细胞生物学研究所。培养箱培养条件为37 ℃恒温,5%CO2。
1.2.3 qRT-PCR 使用TRIzol试剂(Invitrogen,美国)从宫颈癌组织、正常宫颈组织和宫颈癌细胞株(HeLa和SiHa)中提取总RNA,并应用紫外分光光度计进行纯度检测。cDNA第一条链应用Mir-X miRNA First-Strand Synthesis and SYBR qRT-PCR Kit(Takara,日本)说明书操作合成,合成的cDNA作为模版进行qRT-PCR扩增。所有 PCR 反应都在 Light Cycler480 定量 PCR 系统(Roche Molecular Systems,美国)中进行。miRNA-494及LETMD1 mRNA的相对表达量通过2-ΔΔCT法计算,分别以U6和GAPDH作为内参,引物来自上海生工公司。
1.2.4 细胞转染 空白对照(NC mimic)、miR-494 类似物(miR-494 mimic)、miRNA-494抑制物(miR-494 inhibitor)及空白对照(inhibitor-NC)由广州Ribobio公司进行设计合成。宫颈癌细胞株首先在6孔板中培养至密度达4×105/孔,融合率超过70%时,再进行转染。使用Lipofectamine 2000转染试剂(Invitrogen,USA)单独转染miRNA-494 mimic、inhhibitor,及其各自阴性对照(NC mimic和inhibitor mimic)。
1.2.5 质粒构建 FulenGen (广州,中国)公司设计合成载体质粒(pReceiver -M98-LETMD1),空白对照为空载体质粒(pReceiver -M98)。Ribobio公司 (广州,中国)设计合成小干扰RNA (siRNA LETMD1)。空白对照为错义寡核苷酸 siRNA。质粒和 siRNA 均应用Lipofectamine 2000(Thermo Fisher,美国)转染细胞。
1.3 双荧光素酶实验 转染前1 d将细胞接种在 24 孔板中培养至细胞数量达 1×105/孔,保证铺板率达70%。之后将野生型质粒(Wt vector)和突变型质粒 pGL3-LETMD1-3’UTR-Mt vector,即 Mt vector以及相应的miRNA-494 mimic或者miR494 inhibitor或LETMD1 siRNA应用Lipofectamine 2000进行共转染。在进行荧光素酶实验中,将加入含海参荧光素编码基因的pRL-Tk质粒(Promega,美国)作为内参。
1.4 Western blotting实验 从培养皿中刮下细胞,加入含有新鲜蛋白酶抑制剂的裂解缓冲液中,冰浴30 min充分裂解。4 ℃,12 000 r/min,离心10 min,获上清液,使用BCA蛋白质测定试剂盒(Pierce,美国)测定总细胞蛋白质浓度。通过SDS-PAGE分离出等量蛋白质,然后在低温下转移至PVDF膜。用5%脱脂奶粉对膜进行封闭后,将膜与一抗(antiLETMD1和抗GADPH)一起孵育。冲洗后,将膜在过氧化物酶连接的抗兔IgG(Icllab,美国)中温育,最后使用化学发光(Millipore,美国)使其可视化。用Bio-Rad凝胶系统(Bio-Rad,美国)对印迹进行定量。通过Imgae J软件分析相关图像灰度值。
1.5 克隆形成实验 将细胞接种于6孔板中,在37 ℃,5% CO2的恒温培养箱中连续培养14 d。细胞集落用无水甲醇固定15 min并用结晶紫染色后20 min进行细胞克隆数计数。

2 结 果
2.1 宫颈癌病理特征与miRNA-494表达情况 通过宫颈癌组织中miRNA-494表达情况与患者临床病理特征的相关性,发现miRNA-494与宫颈癌患者FIGO分期呈明显相关(P<0.05,表1),而与患者年龄、分化程度、SCC水平差异无统计学意义。
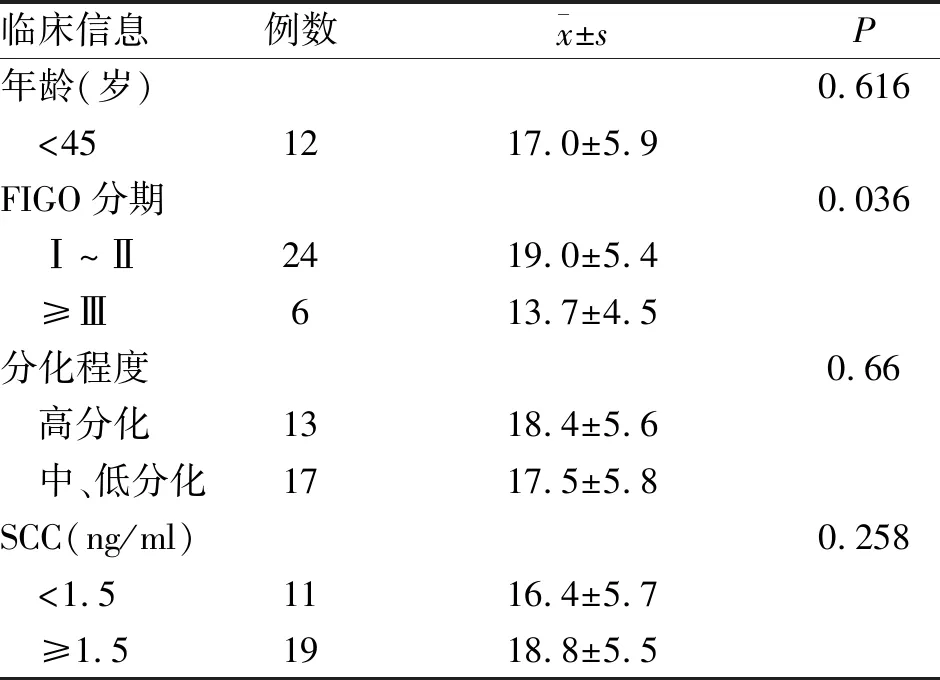
表1 30例宫颈癌的病理特征与miRNA-494表达情况统计表
2.2 miRNA-494在宫颈癌组织和正常组织的表达 采用qRT-PCR技术检测miRNA-494在宫颈组织中的表达。结果显示,与正常宫颈组织相比,宫颈癌组织中miRNA-494的表达水平明显降低,差异有统计学意义(P<0.05,图1)。
2.3 LETMD1 mRNA和蛋白质在宫颈癌组织和正常组织的表达 应用qRT-PCR及Western blotting技术检测LETMD1 mRNA及蛋白质在宫颈组织中的表达,结果显示,与正常宫颈组织相比,宫颈癌组织中LETMD1 mRNA和蛋白质的表达水平均有明显升高,差异具有统计学意义(P<0.05,图2)。

图1 miR-494在宫颈癌组织与正常宫颈组织中的表达

图2 宫颈癌组织与正常宫颈组织LETMD1表达差异比较
2.4 miRNA-494靶向于LETMD1 mRNA的验证 为进一步明确miR-494对LETMD1 mRNA靶向性,我们将LETMD1 mRNA 3’UTR连接于质粒上,形成pGL3-LETMD1-3’UTR-Wt vector(野生型);通过定点突变试剂盒将预测的miR-494与LETMD1 mRNA结合位点进行定点突变构建(预测结合区域),见图3,形成pGL3-LETMD1-3’UTR-Mt vector(突变型)。相关miR-494 mimic及其对照共转染pGL3-LETMD1-3’UTR-Wt vector后,与NC mimic 相比,miR-494 mimic可显著抑制荧光强度(①P<0.01),而miR-494 inhibitor共转染后,可使荧光强度与NC inhibitor相比稍有上升(②P<0.05)。而共转染pGL3-LETMD1-3’UTR-Mt vector后,各组差异无统计学意义,见图4。
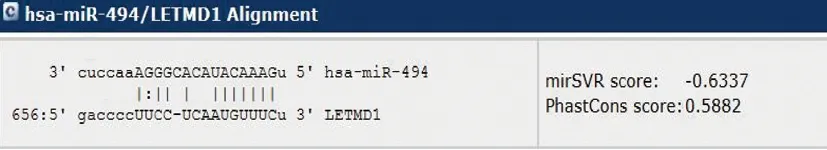
图3 miR494与LETMD1 mRNA3’UTR预测结合位点
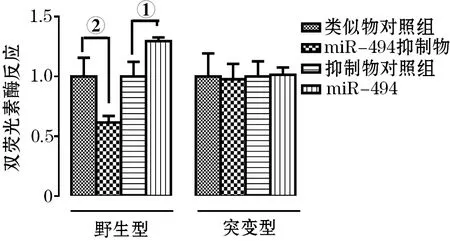
图4 miR-494靶向结合于LETMD1-3’UTR预测靶序列
2.5 miRNA-494通过靶向LETMD1抑制宫颈癌细胞增殖 集落形成实验结果显示,对比转染mimics NC组,转染miRNA-494 mimics的Hela细胞系和SiHa细胞系增殖能力均显著减弱(P<0.01);而对比转染inhibitor NC组,转染miRNA-494 inhibitor的细胞系增殖能力明显增强(P<0.01,图5)。

图5 miR494对宫颈癌细胞系克隆形成能力的影响
A.miR494对宫颈癌Hela细胞系克隆形成能力的影响;B.miR494对宫颈癌SiHa细胞系克隆形成能力的影响;①表示两组比较,P<0.05
3 讨 论
近年来发现,LETMD1是与人类多种肿瘤发生发展、放化疗敏感性及预后密切相关的基因。除在宫颈癌细胞系中,也在乳腺癌和胰腺癌等多个肿瘤中高表达[6, 7]。有研究发现,通过调控降低LETMD1的表达,能够显著降低上述肿瘤细胞的增殖、迁移和侵袭等恶性生物学行为[8],LETMD1还可增加胃癌患者对化疗药物氟尿嘧啶的敏感性,这表明LETMD1可能成为肿瘤治疗的新靶点[9],此外,LETMD1也被证实可作为除甲胎蛋白(AFP)外,也可诊断肝肿瘤和判断预后的一种生物标记物[ 10]。
miRNA-494是一种来源于染色体14q32.31的miRNA[11],其在包括结直肠[12]、肺癌[13]、胰腺癌[14]及乳腺癌[15]等多个肿瘤中异常表达,其在不同的肿瘤中通过作用不同的分子靶点来参与肿瘤的发生发展及预后。在宫颈癌中,有报道称,miRNA-494是明显低表达的,并发现其异常表达参与宫颈癌细胞的恶性生物学行为,并发现通过表达miRNA-494能够显著抑制宫颈癌细胞的增殖、迁移和侵袭[16, 17]。最近的一项研究发现,miRNA-494可以通过细胞信号传导抑制因子6(SOCS6)机制参与宫颈癌的发生发展[18]。本研究选取miRNA-494作为LETMD1上游的调控因子,结果发现,miRNA-494通过靶向作用于LETMD1 mRNA进而对宫颈癌的恶性生物学行为进行负向调控。
本研究首先通过检测宫颈癌组织及正常组织中miRNA-494的含量,对比临床病理特征后发现miRNA-494与FIGO分期呈明显相关,而与年龄、分化程度、SCC水平无关。随后我们通过表达和敲降实验观察宫颈癌细胞系中的LETMD1 mRNA和蛋白质的情况,并以此来验证负相关。为进一步证明两者之间的靶向关系,本研究利用双荧光素酶报告实验证实了LETMD1 mRNA的3’-UTR为miRNA-494的直接靶标。最后,通过体外细胞实验证实了过表达的miRNA-494可通过靶向作用于LETMD1进而抑制宫颈癌细胞的增殖。
总之,本研究结果表明,miRNA-494通过直接靶向作用于LETMD1抑制宫颈癌细胞的增殖。这一发现不仅帮助我们了解宫颈癌发生发展的分子机制,为进一步研究miRNA-494作为宫颈癌的潜在生物标记物和治疗靶点提供了一定的证据,下一步我们将扩大样本,进行更深入地研究。
——一道江苏高考题的奥秘解读和拓展

