清达颗粒对血管紧张素Ⅱ诱导大鼠血管平滑肌细胞增殖和迁移的影响
余 娜 ,李琼瑜 ,陈友琴 ,4,Thomas Joseph SFERRA,4,褚剑锋 ,2,3,林 珊 ,3,彭 军 ,2,3
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学陈可冀学术思想传承工作室,福建 福州 350122;4.凯斯西储大学医学院,美国 克利夫兰 44106)
动脉血管重构是高血压靶器官损害的病理过程,控制血压,改善动脉血管重构,是防治高血压并发症的基础[1]。血管重构是一个动态过程,包括血管平滑肌细胞(VSMCs)的增殖、迁移、凋亡和细胞外基质合成、降解、重排等一系列过程。VSMCs的异常增殖和迁移引起的血管平滑肌变厚、收缩力增加和血管顺应性下降,导致血压明显升高[2]。肾素-血管紧张素-醛固酮系统(RAAS)在高血压的发生发展和终末器官损害中起重要作用[3]。血管紧张素Ⅱ(AngⅡ)作为RAAS中血压和心血管稳态的主要生理调节因子,能够介导VSMCs活化、增殖和迁移等多种反应,进一步引起血管平滑肌变厚,血管收缩力及阻力增加,血压升高[4-6],因此,抑制 AngⅡ诱导的 VSMCs异常增殖和迁移对防治高血压具有重要意义。
清达颗粒(QDG)化裁自清眩降压汤,是陈可冀院士60余年防治高血压的临床专方,主治新发高血压或高血压前期阳亢证患者(肝火上炎、肝阳上亢证等),临床疗效稳定、可靠。课题组前期研究证实:清眩降压汤可显著降低自发性高血压大鼠的血压,参与调控高血压引起的血管重构[7-8]。为了探讨清眩降压汤化裁方QDG是否参与调控高血压引起的血管重构,本文研究了QDG对AngⅡ诱导VSMCs增殖和迁移的影响,以期为QDG临床应用提供进一步的理论依据。
1 材料与方法
1.1 实验动物 6只8周龄雄性SD大鼠,体重(150~200)g,由上海斯莱克实验动物有限责任公司提供,实验动物许可证号:SCXK(沪)2017-0005。
1.2 实验药物 清达颗粒组成:天麻12 g,钩藤10 g(后下),黄芩6 g,莲子心 5 g,由江阴天江药业有限公司生产,批号:1704306。
1.3 主要试剂 DMEM高糖培养基、胎牛血清(FBS)、双抗(青霉素、链霉素)、0.25%胰蛋白酶(trypsin)购自美国Gibco公司;磷酸盐缓冲液(PBS)购自美国Hyclone 公司;AngⅡ干粉(美国 Sigma 公司);Hoechst染色液(南京凯基生物科技有限公司);α-SM-actin抗体(美国Abcam公司);CCK-8试剂(日本同仁化学公司);结晶紫(北京索莱宝科技有限公司)。
1.4 主要仪器 超净工作台(苏州净化设备公司);Forma系列CO2培养箱(美国Thermo公司);Countes全自动细胞计数仪(美国Life Technologies公司);倒置显微镜系统(德国Leica仪器有限公司);ECLIPSE Ti-DH型荧光倒置显微镜(日本尼康公司)。
1.5 实验方法
1.5.1 大鼠胸主动脉VSMCs原代培养及鉴定 采用组织贴块法。在无菌操作下取出大鼠胸主动脉,在DMEM高糖培养基中剥离外膜结缔组织,剖开血管,轻轻刮去内皮细胞,剥离出来的中膜用眼科剪剪成约1 mm3左右的组织块,均匀地平铺于培养瓶中;瓶底朝上,瓶内加入含20%胎牛血清的DMEM高糖培养基,放置培养箱培养,1 h后将培养瓶翻正,使组织块完全浸泡在培养液中;静止培养5 d后换液,于倒置显微镜下观察细胞形态及生长状况。VSMCs采用表型标志蛋白α-SM-actin进行免疫荧光染色鉴定,取3~6代的VSMCs进行实验。
1.5.2 实验分组 将VSMCs分为:① 对照组:未加入 AngⅡ及 QDG;② AngⅡ组;③ AngⅡ+QDG 0.125 mg/mL 组;④ AngⅡ+QDG 0.25 mg/mL 组;⑤ AngⅡ+QDG 0.5 mg/mL组。以上②~⑤组AngⅡ的浓度均为10-6mol/L。
1.5.3 CCK-8法检测细胞活力 在96孔板中接种细胞,每孔加入3×103个细胞,每组做6个复孔;培养24 h后,用无血清的DMEM饥饿24 h,按以上分组给药干预;在培养箱中培养24 h后,配制含10%CCK-8的空白培养基以换液形式加入,4 h后终止培养,充分振荡混匀后在全自动酶标仪450 nm波长处测定吸光度值(A值)。根据公式计算:
细胞增殖率/%=[AngⅡ组 A值/(对照组 A值-1)]×100%
细胞抑制率/%=[(1-AngⅡ+QDG组A值)/AngⅡ组A值]×100%
1.5.4 划痕实验检测划痕损伤修复 在6孔板中接种细胞,每孔加入3×105个细胞,每组做3个复孔;当汇合度达到80%~90%时,用无血清的DMEM饥饿24 h,进行划痕;随后吸出原培养基,用PBS清洗3遍,最后一遍PBS保留不吸出,进行拍照,记为0 h;吸弃PBS,按以上分组给药干预,放入培养箱继续培养,6、12、24 h随机取6个视野,在倒置显微镜下进行观察拍照。
1.5.5 Transwell迁移分析 在6孔板中接种细胞,每孔加入3×105个细胞,每组做3个复孔;培养24 h后,用无血清的DMEM饥饿24 h,按以上分组给药干预24 h后,弃去含药培养基,消化离心收集细胞,用空白培养基重悬并调整细胞密度为1.5×105个/mL;上室内加入200μL重悬的细胞,下室加入700μL完全培养基,每组做3个复孔,放入培养箱中培育;24 h后弃去培养基,用蘸有PBS的棉签轻轻擦拭小室膜上侧的细胞,将小室膜下侧的细胞用4%多聚甲醛固定和结晶紫染色,PBS洗涤后于倒置显微镜下随机选取6个视野拍照。
1.6 统计学处理 采用SPSS 22.0的统计软件进行数据处理。计量资料符合正态分布以(x±s)表示,不符合正态分布以中位数表示。计量资料符合正态分布采用t检验,不符合正态分布采用秩和检验;计数资料采用χ2检验。
2 结 果
2.1 大鼠VSMCs原代培养 组织块贴壁第7天,组织块边缘开始有少量细胞爬出,大部分呈长梭形,小部分呈多角形或不规则形(图1A);第10天,可见细胞沿着组织块周边大量爬出,呈放射性生长(图1B);第12天,细胞生长密度达到90%左右,细胞为梭形、长梭形,呈典型“峰-谷”状生长现象(图1C)。结果表明原代培养成功。

图1 大鼠VSMCs原代培养图片(×100)
2.2 大鼠VSMCs免疫荧光染色并用Hoechst和表型标志蛋白 α-SM-actin进行免疫荧光染色显示:蓝色荧光代表细胞核 (图2A),绿色荧光代表α-SM-actin蛋白阳性细胞(图2B),图2C为细胞核和α-SM-actin蛋白阳性细胞合并图,阳性细胞率达95%以上,表明所培养的原代细胞为VSMCs。
2.3 QDG对AngⅡ诱导VSMCs增殖的影响 见表1。与对照组比较,AngⅡ诱导的VSMCs增殖能力显著升高(P<0.01);不同浓度的QDG可以显著抑制AngⅡ诱导的 VSMCs增殖(P<0.01);且随 QDG 浓度的增加,对VSMCs增殖的抑制作用也逐渐增强。说明QDG对AngⅡ诱导的VSMCs增殖有抑制作用,且呈剂量依赖性。
2.4 QDG对AngⅡ诱导VSMCs划痕损伤修复的影响 与对照组比较,AngⅡ能显著增加VSMCs划痕损伤的修复,不同浓度的QDG可以显著抑制AngⅡ诱导VSMCs划痕损伤的修复,见图3。
2.5 QDG对AngⅡ诱导VSMCs迁移的影响 见图4。与对照组比较,AngⅡ能够显著增加VSMCs的迁移能力(P<0.01);不同浓度的QDG能够显著抑制AngⅡ诱导的 VSMCs迁移(P<0.01),且随 QDG 浓度的增加,对VSMCs迁移的抑制作用也逐渐增强。说明QDG对AngⅡ诱导的VSMCs迁移有抑制作用,且呈剂量依赖性。

图2 大鼠VSMCs免疫荧光染色图(×100)
表1 QDG对AngⅡ诱导VSMCs增殖的影响(±s)

表1 QDG对AngⅡ诱导VSMCs增殖的影响(±s)
注:与对照组比较,1) P<0.01;与 AngⅡ组比较,2) P<0.01;与 AngⅡ+QDG 0.125 mg/mL 组比较,3) P<0.01;与 AngⅡ+QDG 0.25 mg/mL 组比较,4) P<0.01。
组别对照组AngⅡ组AngⅡ+QDG 0.125 mg/mL 组AngⅡ+QDG 0.25 mg/mL 组AngⅡ +QDG 0.5 mg/mL 组24 h 100.00±4.00 123.98±1.341)115.03±2.702)108.39±1.732)3)97.21±1.222)3)4)细胞活力/%48 h 100.00±3.73 126.68±5.621)113.25±2.262)104.61±2.942)3)99.21±2.322)3)4)

图3 QDG对AngⅡ诱导VSMCs划痕损伤修复的影响(×100)
3 讨 论
血压主要是由血管张力维持的,而血管张力主要是由血管平滑肌决定的[9]。VSMCs位于血管中膜,在正常成人体内是通过缓慢和轻度收缩来维持血管壁的张力[10]。VSMCs根据结构和功能的不同可分为收缩型和合成型两种表型,在胚胎时期或病理因素刺激下VSMCs由收缩型转化为合成型,合成型的VSMCs可从中膜迁移至内膜,并在内膜中大量增殖,成为高血压等血管性疾病的主要原因[11]。
RAAS可通过调节水、电解质平衡以及血管张力等方面在高血压的发生发展和终末器官损害中扮演着重要的角色。AngⅡ作为肾素血管紧张素的一种重要的生物活性肽,与VSMCs上的AT1受体结合后,可通过激活多条胞内信号通路促进VSMCs增殖、迁移,导致血管壁硬化、管腔狭窄等[3,12]。 因此,抑制AngⅡ介导的血管平滑肌细胞增殖和迁移是缓解或降低血压升高的重要途径之一。
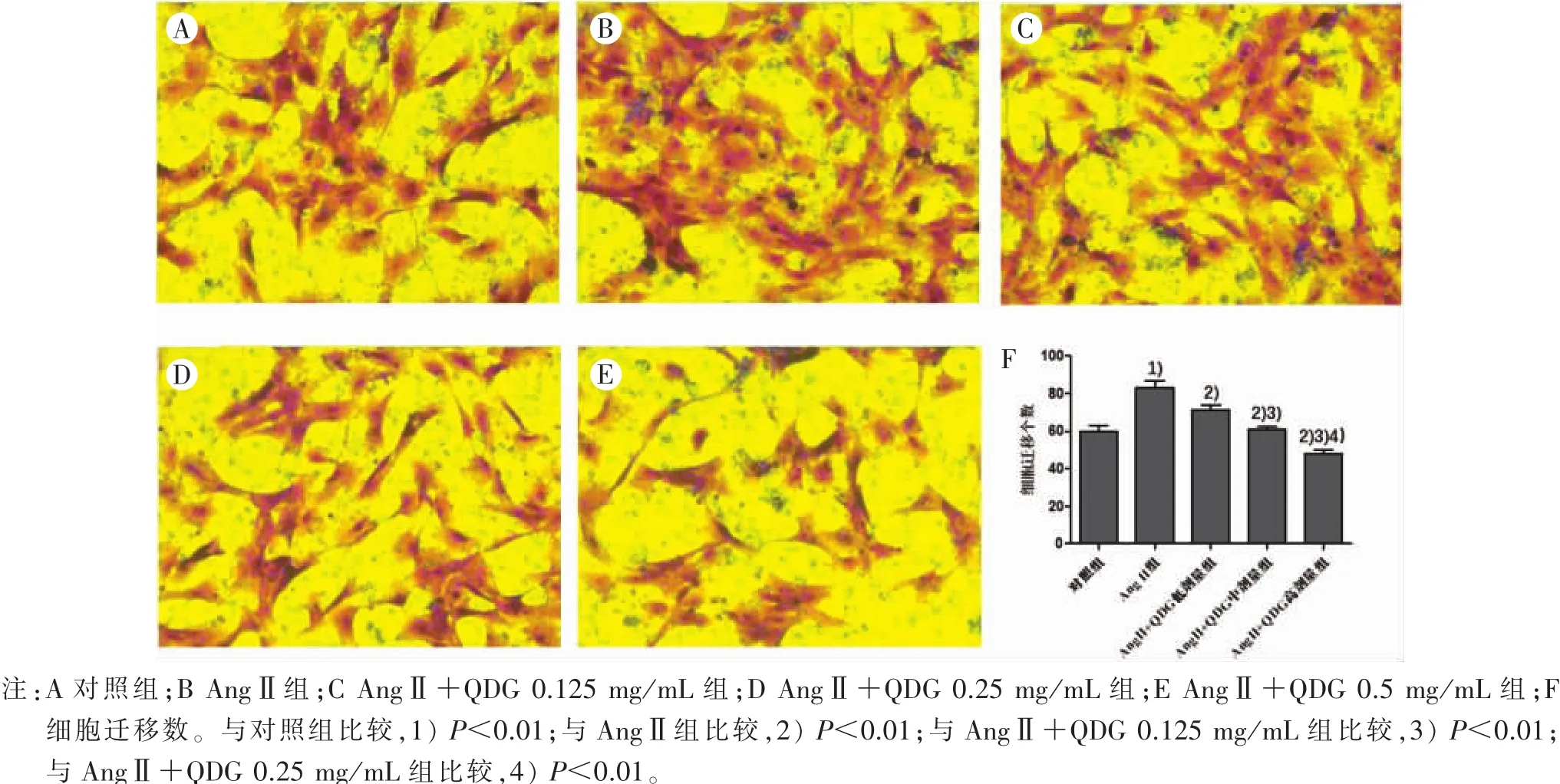
图4 QDG对AngⅡ诱导VSMCs迁移的影响
本研究中,CCK-8检测结果显示:不同浓度的QDG可显著抑制AngⅡ诱导的VSMCs增殖,且呈现明显的剂量依赖性。VSMCs迁移是血管重构的重要驱动因素,划痕实验是测定细胞迁移运动与修复能力的方法,通过体外观察细胞是否生长(修复)至中央划痕区,以此判断细胞的迁移能力。在本实验中,QDG对AngⅡ诱导的VSMCs划痕损伤修复具有明显的抑制作用,提示QDG可抑制AngⅡ诱导的VSMCs迁移能力。Transwell是通过计算相同时间内穿过小孔膜的细胞数来反映细胞迁移能力,穿过小孔膜的细胞数越多,迁移能力越强。Transwell实验结果表明:与对照组比较,AngⅡ诱导后有较多的VSMCs穿过小孔膜,QDG干预后,穿过小孔的VSMCs数量逐渐减少,进一步说明QDG能显著降低AngⅡ诱导的VSMCs迁移能力。
鉴于QDG对AngⅡ诱导的VSMCs增殖和迁移具有显著作用,其相关调控机制、作用靶点和药效物质基础值得进一步研究,其结果有望为QDG的临床运用提供充足的实验依据。

