咖啡果皮酵素发酵过程中代谢产物与抗氧化功能评价
陈小伟,范昊安,张婷,崔艳丽,沙如意,*,毛建卫,*
(1.浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江杭州310023;2.浙江大学化学系,浙江杭州310027)
咖啡是世界最受欢迎的三大饮品之一,在我国云南省有广泛种植,其主要品种为云南小粒咖啡。咖啡豆被外表光滑的咖啡果皮包裹,成熟的咖啡果皮呈深红色或紫红色。咖啡果皮中富含花青素[1],具有抗氧化[2]、保护心脏[3]、抑制癌细胞生长[4]等一系列保健功效。在我国,每年都有大量的咖啡果皮等副产物被丢弃,不仅造成资源的浪费,还导致了环境的污染。
植物酵素最初起源于日本,因其显著的生理功效受到广泛关注,近年来也在中国大陆得到广泛发展。植物酵素是以一种或多种蔬菜、水果和豆谷类、海藻类、药食两用本草类等为原料,加(或不加)糖类物质,经加入单种或多种益生菌(或不加菌依靠植物表面的微生物),经过低温长时间发酵而产生的功能性微生物发酵产品[5-6]。
目前对于植物酵素的研究较多,主要包括发酵工艺[7]、功能性[8]以及发酵过程中代谢产物[9]的研究。植物酵素中成分较多,生物化学反应复杂,发酵过程难以确定。目前,关于不同发酵时间段植物酵素的综合评价较少,选择合适的评价方法确定植物酵素发酵状态尤为关键。本研究对咖啡果皮植物酵素发酵过程中代谢产物的变化以及抗氧化性能进行研究,建立了代谢产物与抗氧化指标之间的相关性,利用主成分分析评价不同时间段咖啡果皮酵素的综合指标,确定咖啡果皮酵素发酵状态,以期建立一种咖啡果皮酵素综合指标变化评价方法,为咖啡果皮酵素的精确发酵提供基础数据;同时对咖啡果皮的高效利用,有效的减少资源的浪费,具有广泛的应用价值。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
咖啡果:云南省保山市小粒咖啡,完全成熟,咖啡果皮呈现深红色;发酵用糖液:浙江省农产品化学与生物加工技术重点实验室。
1.1.2 试验试剂
葡萄糖、蒽酮、硫酸、氢氧化钠、福林酚(10%)、甲醇:分析纯,国药集团化学试剂有限公司;α,α-二苯基-β-苦苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;2,2-联氮基-双-二胺盐[2,2'-azinobis(3-ethylbenzothi azoline-6-sulfonic acid)ammonium salt,ABTS]、考马斯亮蓝G250:上海长哲生物科技有限公司;乙醇:优级纯,上海阿拉丁试剂有限公司;醋酸、乳酸:标准品,中国药品生物制品检定所。
1.1.3 试验设备
Allegra X-12R 离心机:贝克曼库尔特有限公司;PTX-FA210 型电子天平:福州华志科学仪器有限公司;XMTD-204 数显式电热恒温水浴锅:常州诺基仪器有限公司;Waters e2695 高效液相色谱(配备Waters 2998 二极管阵列紫外检测器):Waters 公司;UV-5500 PC 型紫外分光光度计:上海元析仪器有限公司;GC2010/HSS 86.50 岛津GC2010 气相色谱仪+DANI 顶空进样器:日立公司;PHS-3C 酸度计:上海佑科仪器仪表有限公司;SpectraMax iD3 多功能酶标仪:美谷分子仪器(上海)有限公司。
1.2 方法
1.2.1 咖啡果皮酵素的制备
取灭菌、冷却后的无菌水轻轻冲洗带果皮咖啡表面,自然沥干后剥下果皮(保留剥皮过程中的汁水),整个过程在无菌环境下进行。按咖啡果皮与糖液3∶4(质量比)加入经高压蒸汽灭菌冷却后的发酵罐中,于(25±5)℃条件下避光发酵,定期吸取一定量的发酵液,于6 000 r/min 条件下离心15 min,取上层清液检测。
1.2.2 总糖含量的测定
采用蒽酮-硫酸法[10]测定咖啡果皮酵素发酵过程中总糖含量变化。将样品稀释5 000 倍,取稀释后的发酵液200 μL 于2 mL 离心管中,在冰浴条件下向试管中加入0.2 g/100 mL 的蒽酮-硫酸溶液800 μL,冷却后振荡混匀。以水为空白对照,沸水浴中反应10 min 后于冰水浴中再次冷却,取100 μL 于96 孔板中,于620 nm处测吸光度。并按照10、20、30、40、60、80 μg/mL 配制葡萄糖标准溶液,取200 μL 标准溶液按上述方法绘制葡萄糖标准曲线。
1.2.3 总酸含量和pH 值的测定
参照GB/T 12456-2008《食品中总酸的测定》,在此基础上有所调整,取离心后的咖啡果皮酵素1 mL,加水定容至50 mL,取一定体积的上述稀释液于150 mL锥形瓶中,以0.002 mol/L 的NaOH 水溶液为滴定液,酚酞试剂作为指示剂。发酵液pH 值的测定依据GB 10468-1989《水果和蔬菜产品pH 值的测定方法》,取离心后的发酵液直接检测。
1.2.4 醋酸和乳酸含量的测定
色谱条件:色谱柱为Agilent TC C18 柱(250 mm×4.6 mm i.d,5 μm);流动相:甲醇:KH2PO4缓冲液(pH 2.7)=2∶98(体积比);流速:1 mL/min;检测波长210 nm,柱温25 ℃[11]。
待测样品制备:取离心好的发酵液上清液,加入0.01 mol/L KH2PO4缓冲液(pH 2.7)稀释5 倍,经过0.22 μm 微孔滤膜过滤待测。
1.2.5 乙醇含量的测定
以叔丁醇为内标,采用GB 5009.225-2016《食品安全国家标准酒中乙醇含量的测定》第三法进行测定。
自动顶空条件[12]:炉温85 ℃,平衡时间40 min;进样阀温度105 ℃;传输线温度110 ℃。气相色谱条件:色谱柱:RTX-5 毛细管柱(30 m×0.25 mm×0.25 μm);柱温40 ℃,平衡时间3.0 min,10 ℃/min 升温至180 ℃,保温5 min;进样口/气化室温度:200 ℃;分流比30∶1;检测器温度250 ℃。
1.2.6 总酚含量的测定
采用福林酚法测定咖啡果皮酵素发酵液中总酚含量的变化[13]。取10μL 不同发酵时间的发酵液于10mL离心管,加水稀释至500 μL,加入10%福林酚水溶液(体积比)2.5 mL,充分振荡混匀,常温避光静置3 min。反应结束后加入7.5%Na2CO3水溶液2 mL,振荡混匀。25 ℃,120 r/min,避光反应1 h,以0.5 mL 去离子水按上述方法进行空白调零,765 nm 下测定吸光度。
1.2.7 蛋白质含量的测定
采用考马斯亮蓝G250 法[14]测定发酵液中蛋白质含量。准确称取考马斯亮蓝G250 试剂100 mg,溶于50 mL 95%乙醇,加入85%(磷酸,用水稀释至1 000 mL备用。利用牛血清白蛋白制备标准曲线,线性方程y=0.005 5x+0.064,R2=0.999 4。试验前取离心后的咖啡果皮酵素200 μL,加水稀释至1 000 μL,然后加入5 mL 配制好的考马斯亮蓝G250 溶液,混匀,静置反应10 min。以去离子水做空白对照,在595 nm 波长下测定吸光度,计算蛋白质含量。
1.2.8 DPPH 自由基清除能力的测定[15]
取5 μL 离心后的咖啡果皮酵素于10 mL 洁净干燥的离心管中,加入去离子水补足至2 mL,再分别加入4 mL 0.1 mmol/L DPPH-甲醇溶液,25 ℃恒温水浴30 min,以去离子水调零,于517 nm 下检测样品吸光度。
式中:A0为去离子水为参比溶液的吸光度;A1为样品吸光度;A2为本底管的吸光度。
1.2.9 ABTS+自由基清除能力的测定[16]
用5 mmol/L 的pH 7.4 的磷酸盐缓冲液(phosphate buffered saline,PBS)将ABTS 稀释到7 mmol/L,加入过硫酸钾溶液,得到最终浓度为2.45 mmol/L ABTS 溶液,在暗处室温放置12 h~16 h。使用前,在波长734 nm 处,用PBS 缓冲液将ABTS 溶液稀释至吸光度为0.7±0.02。
分别取4 μL 的离心后的咖啡果皮酵素于10 mL洁净干燥的离心管中,用上述PBS 溶液补足至300 μL,再加入5 mL 上述稀释液,30 ℃下反应1 h,734 nm 下测吸光度。
式中:A0为去离子水为参比溶液的吸光度;A1为样品吸光度;A2为本底管的吸光度。
1.3 数据统计与分析
使用excel 2007 和Origin 86 绘制本文图表,数据采集方法利用平均值±标准偏差(n=3)的形式表示。相关性分析采用SPSS 18.0 处理,采用Duncan 法进行多组分样品间差异显著性分析,其中不同字母代表差异显著(p<0.05)。
2 结果与分析
2.1 发酵过程中总糖含量的变化
发酵过程中总糖含量变化见图1。
在试验过程中,加入的高浓度糖液不仅可以抑制部分杂菌生长,筛选出优势菌群,也为微生物的生长代谢提供碳源和能源。检测发酵过程中总糖含量的变化可以较为清晰的掌握微生物对糖类物质的利用状态,间接地确定发酵状态和终点。本研究以葡萄糖为标准,采用蒽酮-硫酸法绘制标准曲线,随着葡萄糖浓度的提高,吸光度不断增大,并呈现出良好的线性关系,线性方程为:y=0.002 1x-0.011,相关系数R2=0.999 7。发酵的前16 d,总糖含量有轻微的上升,这可能是因为发酵前期微生物繁殖较慢,对糖类物质的利用不高[17],原料中的糖类物质溶出导致糖含量上升。发酵16 d后,总糖含量出现明显下降,说明此时微生物开始大量利用糖类物质进行生长代谢。杨小幸等[18]对蔗糖为碳源发酵制备的苹果酵素发酵过程中的蔗糖、果糖和葡萄糖进行检测发现,经过20 d 的发酵,蔗糖几乎全部转化为葡萄糖和果糖,但总含量有明显下降。

图1 发酵过程中总糖含量变化Fig.1 Changes in concentration of total sugar during fermentation
2.2 发酵过程中总酸含量和pH值的变化
图2为咖啡果皮酵素发酵过程中总酸含量变化和pH 值的变化图。
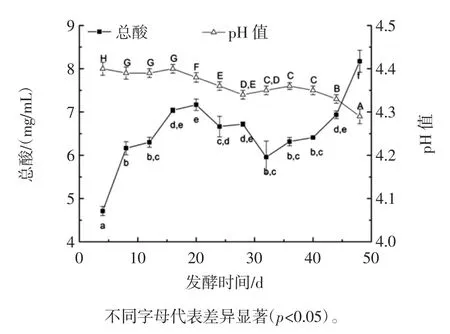
图2 发酵过程中总酸含量与pH值变化Fig.2 Changes in pH value,total titratable acidity during fermentation
酸度是衡量酵素成熟度的主要指标之一,pH 值是衡量发酵过程是否正常的关键条件。咖啡果皮中酸性物质溶出和发酵过程中产生的代谢产物都会导致咖啡果皮酵素总酸和pH 值的变化。咖啡中富含多种有机酸类物质,不同的咖啡中有机酸成分也有差异,大多咖啡中苹果酸含量最高[19]。本研究根据GB/T 12456-2008《食品中总酸的测定》对咖啡果皮酵素发酵过程中的总酸含量进行滴定,以苹果酸为基准衡量总酸含量。发酵第4 天总酸含量为0.377 mg/mL,pH 值为4.40。发酵的前20 d 总酸含量有显著的上升,在发酵第20 天总酸含量达到7.17 mg/mL,pH 值也相应下降为4.38,这可能与部分微生物(包含醋酸菌、乳酸菌等)大量生长繁殖产生的有机酸类物质有关[20]。发酵第20 天至第32 天总酸含量有所下降,发酵32 d 过后又逐渐上升,并于第48 天达到8.17 mg/mL。总的来说,随着发酵时间的延长,总酸含量上升,pH 值有所下降,但并不是每一个时间点两者都呈现完全的负相关,这可能与咖啡果皮酵素中某些新生产的有机酸的缓冲性有关[21],因此我们对发酵过程中经常会产生的有机酸[22](包括乳酸和醋酸)的含量进行了分析。
2.3 发酵过程中乳酸和醋酸含量变化
发酵过程中乳酸和醋酸含量变化见图3。

图3 发酵过程中乳酸和醋酸含量变化Fig.3 Changes of lactic acid and acetic acid in the fermentation process
为确定检测到的乳酸和醋酸是否为后期产生,本研究选择了同批咖啡果皮原料,按照酵素制备过程中的原料与其它添加成分比,即按咖啡果皮∶水=3∶4(质量比)进行超声辅助提取40 min,对提取液中的乳酸和醋酸进行检测,并记为第0 天数据。如图3,发酵前咖啡果皮中本身包含乳酸和醋酸含量分别为1.45 mg/mL和0.38 mg/mL,发酵过程中乳酸和醋酸的含量均显著上升,乳酸含量在发酵第24 天达到最高,为2.79 mg/mL,之后趋于稳定,说明后期发酵过程中有乳酸菌的生长代谢进一步生成了乳酸。醋酸含量在发酵前16 d 上涨缓慢,在第16 天含量为0.67 mg/mL,之后含量出现显著上升,在发酵第32 天达到2.21 mg/mL,之后逐渐趋于平稳。发酵前期酵母菌和醋酸菌菌液浓度含量较低,发酵液中富含丰富的糖类物质,醋酸菌在糖源充足的情况下直接利用葡萄糖发酵生成醋酸[23],在酵母菌发酵生成大量乙醇后,醋酸菌将乙醇氧化成乙醛,进一步生成醋酸[24]。食醋中曲霉、酵母菌、醋酸菌具有一定的协同作用[25],为进一步研究植物酵素中醋酸菌和酵母菌之间的关系,对咖啡果皮酵素发酵过程中的乙醇含量进行了分析。
2.4 发酵过程中乙醇含量变化
图4是发酵过程中乙醇含量的趋势图。

图4 发酵过程中乙醇含量变化Fig.4 Changes of ethanol content in the fermentation process
植物酵素天然发酵主要是利用植物表面本身所带有的微生物进行的,酵母菌作为植物酵素发酵过程中的优势菌群[22],利用糖类物质代谢产生乙醇,乙醇被醋酸菌消耗生成醋酸。故对乙醇含量的检测有助于进一步明确发酵状态。如图4,在发酵前16 d,乙醇含量上升尤为显著,到发酵第16 天乙醇含量达到最高,为2.94%,发酵16 d 后乙醇含量逐渐降低,于发酵第32天降低到2.00%,并趋于平稳。管章瑞等[17]发现蓝莓发酵过程中乙醇含量在发酵前6 d 不断上升,在第6 天达到最高,为64.32 mg/mL,随后乙醇含量逐渐降低,30 d 后乙醇含量降为23.69 mg/mL。结合发酵过程中醋酸的含量变化图可以发现,发酵前期,酵母菌大量利用体系内的糖类物质合成乙醇,随着乙醇浓度的上升,酵母菌大量生长繁殖。总糖浓度的下降、乙醇含量的上升抑制了酵母菌进一步的生长和代谢。乙醇逐渐被醋酸菌消耗生成醋酸,这就是发酵16 d 后醋酸含量上升伴随乙醇含量下降的原因。
2.5 发酵过程中蛋白质含量的变化
发酵过程中可溶性蛋白质含量变化见图5。
为研究咖啡果皮酵素发酵过程中蛋白质含量变化,本研究采用考马斯亮蓝法对咖啡果皮酵素中的可溶性蛋白质含量进行了检测。如图5所示,发酵前8 d,咖啡果皮酵素中蛋白质含量仅有轻微的上升,在第8天达到3.34 mg/mL,这可能与原料中本身的蛋白质溶出有关,发酵8 d 至24 d,咖啡果皮酵素中可溶性蛋白质含量有较为明显的上升,在发酵第24 天达到最高,为0.60 mg/mL。随后一段时间内蛋白质含量趋于平衡,发酵第40 天蛋白质含量逐渐下降,在第48 天为0.50 mg/mL。这可能是因为发酵前期,微生物生长繁殖能力不强,较高浓度的糖抑制了原料中的蛋白质溶出。随着发酵时间的延长,发酵内环境趋于稳定,微生物开始大量繁殖,部分微生物所产生的纤维素酶和果胶酶[26-27]使咖啡果皮细胞壁破裂,蛋白质大量溶出。同时,微生物的代谢也产生了部分小分子蛋白质,导致含量上升。经过24 d 的发酵之后,体系逐渐趋于平衡,蛋白质含量也逐渐趋于稳定。经过40 d 的发酵,总糖含量下降,微生物生长繁殖速率减慢,蛋白质被部分消耗,含量有所下降。

图5 发酵过程中可溶性蛋白质含量变化Fig.5 Changes of soluble protein in the fermentation process
2.6 发酵过程中总酚含量变化
发酵过程中总酚含量变化见图6。
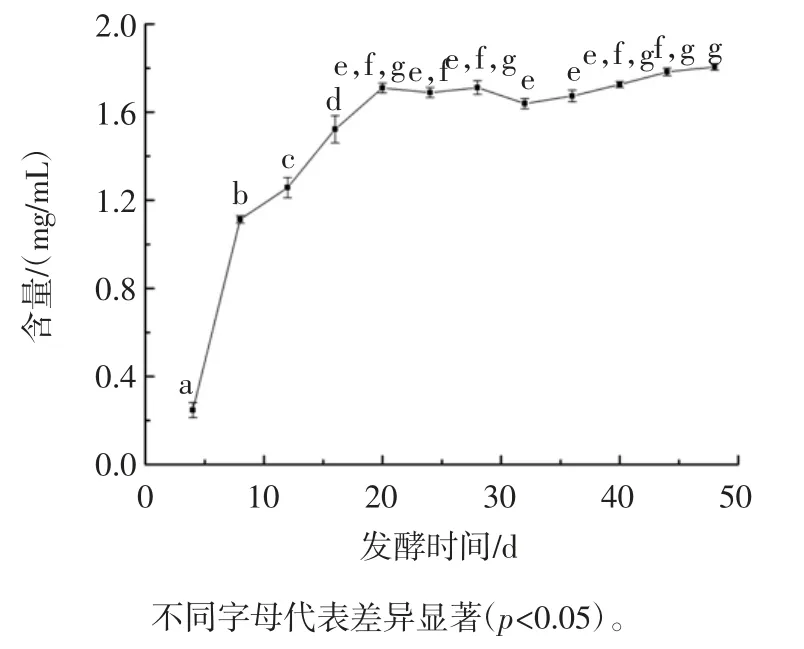
图6 发酵过程中总酚含量变化Fig.6 Changes of total phenolic content in the fermentation process
为研究咖啡果皮酵素发酵过程中的多酚含量变化,采用福林酚法对总酚含量进行检测。如图6,咖啡果皮酵素在发酵前20 d 含量显著上升,在发酵第20天达到1.71 mg/mL,后逐渐趋于平衡,前期总酚含量的上升主要是因为微生物作用导致咖啡果皮本身酚类物质的溶出有关。发酵第28 天~第32 天含量有轻微下降,之后又缓慢上升,在发酵第48 天达到1.81 mg/mL。多酚类物质具有一定的抑菌效果[28],高浓度的多酚类物质也会抑制微生物的生长。随着发酵时间的延长,部分微生物逐步适应高酚含量发酵环境,并逐渐将一些一大分子量的多酚被降解为小分子量酚类物质或单体酚[29],从而使总酚含量进一步的小幅上升。
2.7 发酵过程中抗氧化能力变化
2.7.1 DPPH 自由基清除能力变化
咖啡果皮酵素发酵过程中对DPPH 自由基清除能力的变化情况如图7所示。

图7 发酵过程中对DPPH自由基清除能力的变化Fig.7 Changes in DPPH free radical scavenging ability during the fermentation
在整个发酵过程中咖啡果皮酵素对DPPH 自由基都具有一定的清除能力,发酵过程中前36 d 呈现缓慢上升,咖啡果皮酵素对DPPH 自由基的清除能力逐渐上升,发酵36 d 过后,清除能力进一步显著上升。说明适当的延长发酵时间有利于提高咖啡果皮酵素对DPPH 自由基的清除能力。与发酵过程中总酚含量相比发现,随着发酵时间的延长,总酚含量和对DPPH 自由基的清除能力都有显著的提高,说明两者之间具有一定的相关性。但整个发酵过程中总酚含量与DPPH自由基的清除能力并没有呈现良好的线性关系。而是在总酚的大量积累后清除率显著上升,这可能与原料中本身含有的酚类性质有关。
2.7.2 ABTS+自由基清除能力变化
发酵过程中咖啡果皮酵素对ABTS+自由基的清除能力如图8所示。
整个发酵过程中,稀释75 倍后的咖啡果皮酵素对ABTS+自由基具有良好的的清除能力,且均大于50%。随着发酵时间的延长,对ABTS+自由基的清除能力不断上升,在发酵第48 天时达到91.74%。说明适当的延长发酵时间有利于提高咖啡果皮酵素对ABTS+自由基的清除能力。相比咖啡果皮酵素对DPPH 自由基清除能力而言,ABTS+自由基清除能力与总酚含量的变化趋势相似度更为明显。Floegel A 等[30]对50 种具有富含抗氧化剂的水果的ABTS+自由基清除能力与总酚和黄酮含量做了相关性分析,发现ABTS+自由基清除能力与总酚和黄酮含量呈现显著的相关性,这可能是本研究中ABTS+自由基清除能力与总酚含量变化趋势较为明显的原因。

图8 发酵过程中对ABTS+自由基清除能力的变化Fig.8 Changes in ABTS+free radical scavenging ability during the fermentation
2.8 不同发酵时间咖啡果皮酵素聚类分析
图9为咖啡果皮酵素发酵过程中各指标特征聚类图。
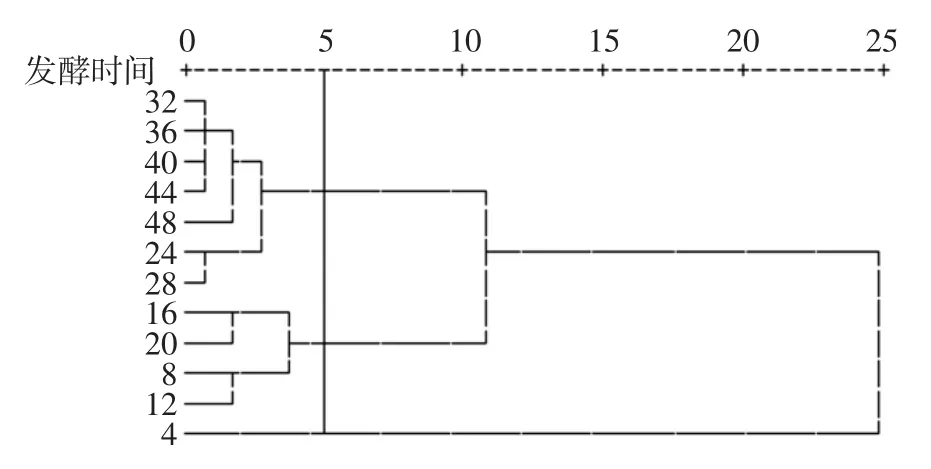
图9 咖啡果皮酵素不同发酵时间各指标特征聚类图Fig.9 Characteristic clustering of different indexes in different fermentation times of coffee peel
整个发酵过程中,检测参数较多,发酵阶段难以确定,本研究采用SPSS 将发酵过程中所有检测参数进行聚类分析,确定不同的发酵阶段。聚类分析结果代表不同阶段总糖、总酸、pH 值、乙醇、乳酸、醋酸、蛋白质、总酚以及抗氧化指标的总体变化规律。如图9所示,横坐标表示差异性,数值越大,表示不同发酵时间咖啡果皮酵素的差异越大,本研究选择了λ=5 分类,12 个不同的发酵时间分为3 类:第一类发酵时间为4 d,第二类发酵时间为:8 d~20 d,第三类为发酵第24 天及以后。
2.9 相关性分析
为研究咖啡果皮酵素发酵过程中各种代谢产物,如总糖、总酸、pH 值、乳酸、醋酸、乙醇、蛋白质、总酚与抗氧化指标(DPPH 自由基清除能力、ABTS+自由基清除能力)之间的内在联系,通过相关性分析确定各组分之间的联系,如表1所示。

表1 发酵过程中各参数相关性Table 1 Correlation of parameters during fermentation
通过表1可以发现,总糖与pH 值与乙醇含量呈正相关,与总酸、蛋白质、乳酸、醋酸含量呈现负相关。这可能与发酵过程中微生物利用糖合成乙醇、蛋白质,代谢产生有机酸和其它酸类物质有关。乙醇与醋酸含量呈现负相关,是因为发酵16 d 后乙醇逐渐被微生物利用合成醋酸。总酚含量与ABTS+自由基清除能力和DPPH 自由基清除能力有显著的相关性,酚类物质本身就具有良好的抗氧化功效,发酵过程中随着总酚含量的上升,抗氧化功效显著提高。
2.10 主成分分析
主成分分析的载荷图如图10所示。

图10 主成分分析的载荷图Fig.10 Principal component analysis of the load diagram
为进一步明确咖啡果皮酵素发酵过程中,各变量总糖、总酸、pH 值、乙醇、乳酸、醋酸、蛋白质、总酚、DPPH 自由基清除能力和ABTS+自由基清除能力的相互关系,采用主成分分析(principal components analysis,PCA)对各个变量进行降维处理。抽取能够代表大部分信息的第一主成分(贡献率为69.352%)和第二主成分(贡献率为19.698%),各检测指标的位置越接近,说明这些指标之间的相关性越好。如图10 所示,总糖、pH 值、乙醇在第一主成分和第二主成分中的系数分别为负值和正值,说明其主要贡献为第二主成分。其它参数均位于载荷图的右侧,表示对第一主成分贡献率较大;其中总酸、总酚、乳酸、ABTS+自由基清除能力第二主成分系数大于0,且彼此之间距离相差不大,说明这4 个检测指标均呈现显著的正相关,DPPH 自由基清除能力略小于0,但与总酚、ABTS+自由基清除能力距离较近。说明三者之间相关性较好;蛋白质与醋酸含量位于右下角,与总糖、pH 值、乙醇含量相反,这与前面相关性分析的结果基本一致。
12 个不同时间的咖啡果皮酵素的主成分样品得分图如图11所示。

图11 主成分样品得分图Fig.11 Main component sample score chart
发酵第4 天的咖啡果皮酵素位于图像左下角,与其他时间点相比相距较远,说明与其它发酵时间酵素性质差别较大。发酵第8 天到第20 天的咖啡果皮酵素位于图片左上方,第一主成分系数和第二主成分系数都有了较为显著的上升,但第一主成分系数还是为负值。发酵第24 天到第28 天第一主成分占据了绝对优势。因此,将不同发酵时间的咖啡果皮酵素按照主成分得分分为3 个区域:N1、N2 和N3。这也与聚类分析结果一致。通过主成分分析法构建不同发酵时间样品的综合评价指标(comprehensive evaluation index,CEI)。以每个主成分所对应的特征值占所提取主成分的特征值之和的比例,进行线性加权求和得到CEI(如公式1)。

不同发酵时间的咖啡果皮酵素综合指标如图12所示。

图12 咖啡果皮酵素综合评价指标Fig.12 Comprehensive evaluation index of coffee peel jiaosu
发酵第4 天CEI 值最低,为-1.995,随后CEI 值有所提高,并在第24 天时达到0.323,随后轻微的下降之后继续上升,在发酵第48 天达到最高,为1.027。说明适当的延长发酵时间有利于提高咖啡果皮酵素综合指标。
3 结论
本试验以咖啡制作过程中废弃的咖啡果皮为原料,利用咖啡果皮表面的微生物,在高浓度糖液浓度下制备咖啡果皮酵素。对发酵过程中总糖、总酸、乳酸、醋酸、乙醇、总酚含量、pH 值及抗氧化指标(DPPH 自由基清除能力、ABTS+自由基清除能力)进行了检测和分析。结果表明:发酵过程可以分为0~4 d、8 d~20 d、24 d~48 d 3 个不同时间段。微生物在发酵前期生长繁殖较慢,咖啡果皮在高糖浓度下活性物质和水分溶出,随着发酵时间的延长,微生物大量生长产生乙醇、醋酸、乳酸和酶等代谢产物,乙醇在后期被醋酸菌代谢导致含量下降。随着发酵时间的延长,蛋白质含量上升,咖啡果皮物质进一步溶出,总酚含量显著上升,两个抗氧化指标也随之出现显著上升。发酵过程中不同检测指标之间具有一定的相关性,通过主成分分析发现随着发酵时间的延长,综合指标显著提高,说明适当的延长发酵时间有利于提高咖啡果皮酵素成熟度和抗氧化功效。

