河南省猪源沙门氏菌分离鉴定、血清分型及药物敏感性分析
方忠意,李金磊,董 鹏,狄元冉,袁 聪,李红婵,高延玲,邱天宝,李梦圆,吴志明
(1.河南省兽药饲料监察所,河南郑州 450008;2. 河南牧业经济学院,河南郑州 450046)
沙门氏菌(Salmonella)是自然界中普遍存在的人兽共患病原菌。其血清型种类众多,目前已确认的沙门氏菌血清型有2 500多个。截止到2007年,我国已检出322个沙门氏菌血清型,其中包括国际新型10余项[1]。沙门氏菌宿主广泛,不同的血清型对人和动物的致病性不同,且极易在人和动物之间水平传播。沙门氏菌每年给全球食品行业造成的损失约23亿美元,其中接近6%的报道与猪肉或猪肉产品有关[2]。我国90%以上的沙门氏菌食物中毒事件都是肉类食品引起的,而猪肉已被认定为主要污染源之一[3]。
目前对沙门氏菌病的防治主要依赖抗菌药物,而抗菌药物的使用导致沙门氏菌耐药性日趋严重。本研究通过河南省猪源沙门氏菌的分离鉴定、血清分型及药物敏感性试验,以期了解河南省猪源沙门氏菌的血清分布及药物敏感性情况,为沙门氏菌防控提供依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株 鼠伤寒沙门氏菌质控菌株ATCC14028、大肠杆菌标准菌株ATCC25922:购自中国兽医药品监察所。
1.1.2 样品来源 2018年随机抽取河南省郑州市、开封市、焦作市、许昌市、漯河市5市生猪屠宰场盲肠内容物样品840份。
1.1.3 培养基与试剂 革兰氏阴性细菌鉴定板:购自BD公司;一次性无菌采样棒(BPW):购自郑州君越科莱特健康科技有限公司;BS琼脂培养基、TSI琼脂、赖氨酸脱羧酶试验培养基、swarm半固体琼脂、营养琼脂:购自北京路桥技术有限公司;沙门氏菌显色培养基:购自上海欣中生物工程有限公司;革兰氏阴性细菌药敏板:购自上海星佰生物技术有限公司;沙门氏菌诊断血清:购自丹麦SSI公司;PCR预混酶:购自康为世纪生物科技有限公司。
1.1.4 仪器设备 低温可叠放摇床:购自赛默飞世尔科技公司;细菌浊度仪:购自北京中西远大科技有限公司;全自动细菌鉴定/药敏系统:购自美国BD公司;台式离心机:购自德国Sigma公司;梯度PCR仪:购自美国伯乐公司;凝胶成像系统:购自美国伯乐公司。
1.1.5 引物 沙门氏菌invA基因引物P1:5′-GTGAAATTATCGCCACGTTCGGG-3′;P2:5′-CATCGCACCGTCAAAGGAAC-3′。扩增片段长度为284 bp,退火温度为60 ℃。
1.2 方法
1.2.1 预增菌 使用一次性无菌采样棒采集猪盲肠内容物,将样品尽快送往实验室,35~37 ℃培养16~20 h,同时设阳性和阴性对照。
1.2.2 样品的分离、纯化 取预增菌液分别划线接种于BS和沙门氏菌显色培养基。在BS上,35~37 ℃培养46~50 h;在沙门氏菌显色培养基上,35~37 ℃培养20~24 h。选取单个典型菌落进行纯化,最后将纯化好的菌落划线接种于营养琼脂培养基。
1.2.3 PCR鉴定 用灭菌棉签挑取纯化好的菌落,加入装有1.5 mL无菌生理盐水的离心管中,反复冷冻煮沸2~3次,12 000 r/min离心,取上清作为PCR扩增模板,同时设阳性对照、阴性对照和空白对照。反应体系:Taq PCR Master Mix 25 μL,ddH2O 18 μL,P1、P2 各 1 μL,模板5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 40 s,35个循环;72 ℃后延伸5 min,4 ℃保存。同时设置阳性对照、阴性对照。配制 1.5%的琼脂糖溶液,于微波炉中加热溶解,待冷却至50~60℃时,加入溴化乙锭(使其终浓度达到0.5 μg/mL)混匀,倒入已插上梳子的胶槽内。待凝固后,转入电泳槽中,在每个泳道中加入8 μL的PCR产物,160 V,电泳15~20 min。电泳结束后,将琼脂糖凝胶置于凝胶成像仪上成像。
1.2.4 生化鉴定 从营养琼脂上挑取菌落接种三糖铁琼脂,先在斜面划线,再于底层穿刺;接种针不要灭菌,直接接种赖氨酸脱羧酶试验培养基。同时从营养琼脂上挑取适当菌落,于接种液中调制菌液浓度至0.5 MCF,然后添加到革兰氏阴性细菌药敏板,采用全自动细菌鉴定/药敏系统进行鉴定。
1.2.5 血清分型 先测O抗原,再用无菌枪头取营养琼脂上经鉴定的沙门氏菌,与载玻片上加有10 μL沙门氏菌A—F群“O”多价诊断血清混匀,轻轻摇动玻片,于30 s内读取结果,凝集判为阳性,浑浊或清亮判为阴性。同时设无菌生理盐水为对照,看细菌是否有自凝现象。测完O多价后,再测O单价。测完O抗原后,测H抗原,先测I项:用一次性接种棒将营养琼脂上沙门氏菌轻轻点接到swarm半固体琼脂中央,注意不要刺破琼脂,35~37 ℃培养18 h;用无菌枪头取swarm半固体琼脂上的菌落先进行HMA、HMB、HMC、HMD多价测定,然后进行单价测定。I项测定完毕后,选出需要测II项的,用一次性接种棒,点接在加有相应诱导剂的swarm半固体琼脂上,然后按I项方法进行II项的测定。
1.2.6 药敏试验 取营养琼脂上经鉴定的沙门氏菌菌落,用生理盐水调制至0.5 MCF,吸取10 μL加入到10 mL肉汤中,然后分别取100 μL加入到96孔药敏板中,37 ℃培养16~20 h,最后读取药敏试验结果。
2 结果与分析
2.1 分离鉴定
经预增菌培养、样品分离纯化,最后经PCR及全自动细菌鉴定/药敏系统鉴定,共分离到沙门氏菌45株,分离率为5.36%(45/840)。部分PCR鉴定及生化反应结果见表1和图1。
2.2 血清分型
分离的45株沙门氏菌中,除2株血清型未定外,其余43株共分为4个群6个血清型,分别为B群的Derby(德尔卑,n=17)、Reading(里定,n=5)、Typhimurium(鼠伤寒变种,n=4),C1群的Rissen(罗森,n=5),C3群的肯塔基(Kentucky,n=11),E1群的London(伦敦,n=1)。具体结果见表2。
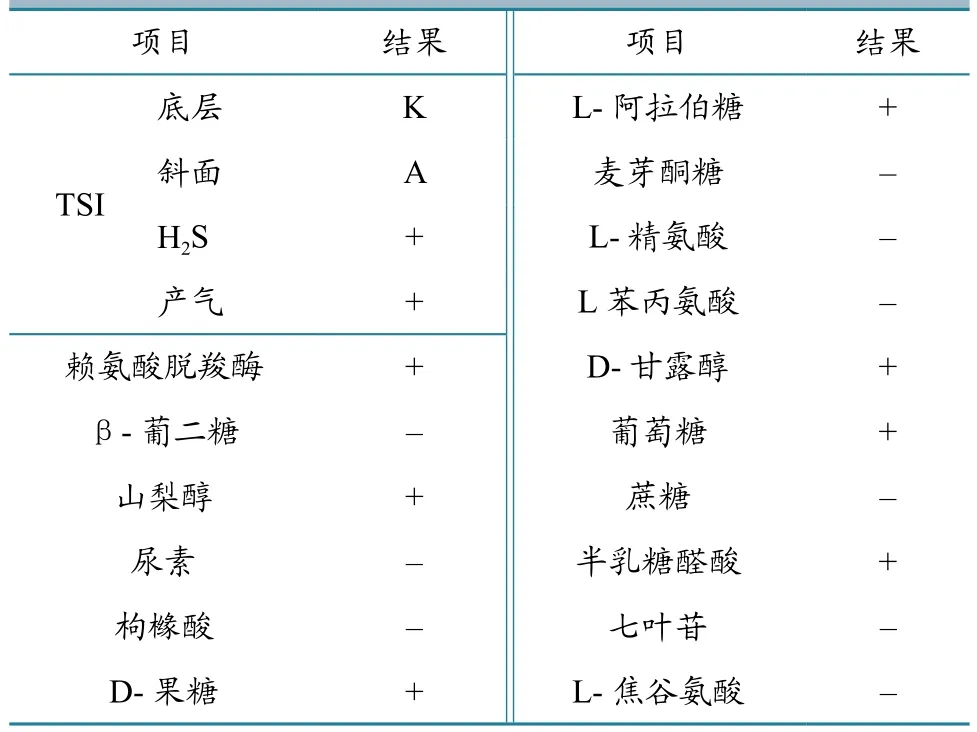
表1 沙门氏菌部分生化反应

图1 沙门氏菌PCR鉴定结果

表2 分离的猪源沙门氏菌血清分型
2.3 药敏试验
将分离菌株进行氨苄西林、奥格门丁、头孢噻呋等16种抗生素药物敏感性试验,发现分离的45株沙门氏菌对四环素、磺胺异恶唑、大观霉素、氨苄西林耐药比较严重,耐药率分别为82.22%、75.56%、73.33%、73.33%;对头孢他啶、美罗培南、安普霉素、乙酰甲喹比较敏感,耐药率均在10%以下。具体结果见表3。
3 分析与讨论
猪肉是我国消费最多的肉制品,因此对猪肉品质的控制,尤其对猪源沙门氏菌血清分型和耐药情况的研究,具有极其重要的公共卫生意义。
本研究选取具有代表性的郑州、开封、焦作等市的大型屠宰企业,进行猪源沙门氏菌分离鉴定,共分离出沙门氏菌45株,分离率为5.63%(45/800)。这一结果与高延玲等[4]从河南省猪屠宰场盲肠内容物中研究得出的沙门氏菌分离率(6.9%)接近,比刘鲜鲜等[5]从猪屠宰环节研究得出的分离率(19.80%)和沈永恕等[6]从河南省患子宫内膜炎母猪中研究得出的分离率(10.83%)要低。这说明不同地区、不同组织中的沙门氏菌污染情况存在差异。

表3 分离沙门氏菌对16种抗菌药物的药敏试验结果
通过血清凝集法,对分离的45株沙门氏菌进行血清分型,发现检出率最高的是德尔卑沙门氏菌,其次是肯塔基沙门氏菌、里定沙门氏菌和罗森沙门氏菌。这一结果与王娟等[7]研究发现的山东屠宰环节猪源沙门氏菌优势血清型,以及侯小刚等[8]研究发现的四川猪肉产业链中沙门氏菌优势血清型一致,均为德尔卑沙门氏菌;国外Denis等[9]也研究表明,种猪和育肥猪场的沙门氏菌血清型以德尔卑沙门氏菌和鼠伤寒沙门氏菌为主。上述这些研究结果表明,德尔卑沙门氏菌在整个养猪生产中普遍存在,世界范围内的猪源沙门氏菌血清型分布有相似性[10]。
通过肉汤稀释法,对分离菌株进行药物敏感性试验,参照美国临床和实验室标准协会(CLSI)最新标准对药敏结果进行判定,发现分离的沙门氏菌除对安普霉素和乙酰甲喹全部敏感外,对其他14种抗菌药物均有不同程度的耐药,尤其对四环素、磺胺异恶唑、大观霉素、氨苄西林耐药严重,耐药率均在70.00%以上。分离菌株对四环素的耐药率与王娟等[7]报道的80.2%以及侯小刚[8]报道的89.29%差别不大,而对大观霉素、氨苄西林的耐药率在50%左右,均明显高于王娟等[7]报道的数据,也分别高于侯小刚[8]报道的36.61%、24.11%;对氧氟沙星、恩诺沙星、头孢噻呋的耐药率分别为14.4%、31.2%、13.2%,均明显高于高延玲等[4]报道的数据,而对氟苯尼考、复方新诺明、奥格门丁的耐药率分别为66.4%、60.8%、71.2%,明显低于其报道的数据。这一结果表明,不同区域、不同组织、不同季节的沙门氏菌耐药情况存在差异,同时也表明河南省猪源沙门氏菌耐药情况较为严重,提示在以后的养殖管理过程中,应加强抗生素的使用监管,做到合理用药、交叉用药,减少或避免沙门氏菌耐药性的产生。

