2种方法测定氧化铜纳米颗粒对新生大鼠脑微血管内皮细胞毒性的比较研究
张丽霞,顾 雯,张宏伟,段 链*
(中国疾病预防控制中心环境与健康相关产品安全所毒理室,北京 100021)
纳米铜是代表性的金属纳米材料之一,作为商业化产品进入市场多年,在生物医学领域中有望代替铜化合物或微米铜材料而得到广泛应用。然而,已有研究表明纳米粒子所具有的小尺寸、大的比表面积及高表面活性等特征使其具有一些可能的健康危害[1-2]。纳米铜在体内、外实验中均显示出毒性作用[3]。研究表明氧化铜纳米颗粒(CuO-NPs)可能影响神经系统功能[4-5]。脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)是一种薄而扁平、内衬在大脑毛细血管内壁且与血液直接接触的磷状细胞。由BMECs组成的大脑微血管构建出高选择性的屏障,很大程度上决定了各种物质对血脑屏障的通透程度。BMECs之间通过其细胞膜侧壁相关联,接触面上有紧密连接蛋白和粘附蛋白[6-7]。BMECs拥有特殊的基底膜结构,是维持血脑屏障的重要部件[8]。作为血脑屏障的主要组成部分之一,BMECs被认为是血液与中枢神经系统物质相互交换的主要场所,对维持中枢神经系统的内环境稳态有着十分重要的作用。
细胞毒性测定是一种最直接反映体外培养细胞损伤的指标,也是研究外源化学物质毒作用机制的最关键步骤。刃天青是常用的一种细胞毒性检测剂,在细胞增殖过程中将无荧光性的刃天青还原为荧光产物,利用荧光分光光度计检测所得的荧光强度与活细胞数成正比[9]。实时细胞分析(real time cell analyze,RTCA)是一种新兴的监测活细胞状态的方法[10],RTCA基于微电子阻抗技术利用细胞指数(cell index,CI)反映细胞活性,可根据需要进行实时测定。检测记录的CI值为无量纲单位,可反映贴壁细胞的数量、形态及粘附能力等特征。
本研究利用RTCA法和刃天青法测定CuO-NPs对BMECs的毒性,比较两种方法用于纳米颗粒毒性测定的优劣势,分析RTCA法用于纳米颗粒细胞毒性测定的适用性。同时获得CuO-NPs作用于BMECs所产生的细胞毒性结果,为进一步深入研究金属纳米颗粒的对神经系统的毒性效应提供相关实验基础。
1 材料与方法
1.1 主要试剂、仪器
连续波长微孔板分光光度计(Multiskan GO,美国Thermo公司);Real-Time Cell Analyzer及配套16孔板由艾森生物有限公司[ACEA生物(杭州)有限公司]生产,此配套16孔板每孔底面积0.32 cm2,与常规96孔板规格一致;Zxis 165 X射线光电子能谱(XPS)系统(Kratos Analytical);JEM-2100F透射电子显微镜(TEM)(JEOL Ltd.Japan);纳米粒度Ζ电位仪(Malvern Instruments.Ltd.,UK)。
1.2 细胞分离和培养
新生SD大鼠(出生后24 h)购自中国实验动物资源研究所(生产许可证SCXK2014-0013)。在分离培养BMECs之前确保所有的工具无菌,所有操作都在冰上进行,用无菌的多聚赖氨酸包被所需材料(12孔培养皿)。在解剖显微镜下,用一对小镊子将新生SD大鼠带有海马和皮层的大脑与头骨分离,然后放入盛有冰冷HBSS的培养皿中,将大脑两半球分开,用镊子将多余的脑膜剥离,并分离海马和大脑皮层。用冰冷的HBSS清洗两次。分离的大脑皮层通过200和70μm的筛网均匀化,神经胶质细胞随滤液弃除,70μm筛网上存留的大部分即为BMECs。70μm筛网上存留物在37℃下用II型胶原酶(0.2%)消化20 min。消化后,室温下200 g离心5 min,收集微血管碎片并接种到聚-D-赖氨酸包被的培养皿上,加入完全细胞培养液DMEM(Gibco,USA),其中含有10%胎牛血清(FCS,Gibco,USA)、30μg/mL内皮细胞生长因子(Sigma)和1%双抗,于37℃、CO2体积分数为5%、饱和湿度条件下培养。当细胞融合达到80%时,用1.25 mg/mL的胰酶进一步纯化,并经2~4代传代纯化后,得纯化的BMECs用于后续实验。
1.3 纳米粒子
1.3.1 纳米氧化铜颗粒的表征 纳米氧化铜(CuONP,纯度99%)购自DK(北京)纳米技术有限公司。根据制造商的规格,粒径为10~100 nm,体积密度为0.79 g/cm3,质量浓度为30%,比表面积为13.1 m2/g,以分散在去离子水中的悬浮液形式获得纳米颗粒。使用X射线光电子能谱(XPS)测定纳米颗粒的元素组成。用JEM-2100F透射电子显微镜(TEM)观察纳米颗粒的形状。
将纳米氧化铜颗粒加入到BMECs培养液中,使其终浓度为最高染毒浓度,轻轻旋转并吹打,以确保颗粒完全分散,用纳米粒度Ζ电位仪测定高浓度受试物的Ζ电位,同时以动态光散射法测定其水合粒径,以确定染毒后纳米氧化铜的团聚情况。
1.3.2 纳米颗粒分散体 使用130 W超声波处理器(Cole-Parmer Instruments,Vernon Hills,IL)将所有分散体以70%振幅超声处理5 min。测定其pH值(pH值稳定在6~7即可)。在4℃下储存分散体至少24 h,并在使用前立即超声处理5 min。
1.4 RTCA实时监测技术测定细胞毒性
1.4.1 细胞生长和增殖测定 取生长状态良好的BMECs细胞用DMEM完全培养液充分混匀,按不同密度接种于RTCA配套16孔板中,每孔50μL。细胞浓度梯度分别设置为 1.56×102、3.13×102、6.25×102、1.25×103、2.50×103、5.00×103和1.00×104个/mL,每个浓度设2个复孔。RTCA程序设置15 min进行一次细胞指数(cell index,CI)值的测试。CI值为RTCA以基于微电子阻抗的检测技术进行细胞活性检测的细胞指数单位,为无量纲单位,所代表的是成活的贴壁细胞。通过对不同密度的细胞进行连续测定,以细胞CI值为Y轴,以时间为X轴绘制生长曲线,通过比较生长曲线斜率判断细胞的生长速度,确定适合于毒性实验的最终细胞浓度进行下一步毒性实验。
1.4.2 实时监测CuO-NPs细胞毒性 根据已绘制出的细胞生长曲线,选择适当的细胞浓度接种于配套16孔板中,每孔100μL。置于37℃、CO2体积分数为5%、饱和湿度条件下培养约24 h后进行染毒。CuONPs设置5个不同染毒剂量及空白对照组,分别为1.5、0.75、0.38、0.19、0.09、0 mg/mL,每个剂量设2个复孔。
RTCA程序设置为细胞接种后自然生长,每15 min测定一个点,测定自细胞接种时为起始点,第100小时测定结束。以时间为X轴,归一细胞指数(normalized cell index,NCi)值为Y轴绘制细胞生长曲线,观察不同剂量CuO-NPs所产生的细胞毒性。本实验将染毒时刻作为校正时间点,NCi值为1,之后各时间点各浓度的CI值均与染毒时刻相比,按下式计算求得NCi值。
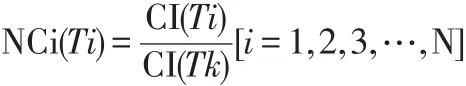
式中:NCi——归一细胞指数;CI(Tk)——染毒前最后一个时间点的细胞指数;CI(Ti)——被测定的时间点的细胞指数;N——所有被测定时间点。
1.5 刃天青法测定纳米氧化铜的细胞毒性
根据细胞生长曲线,选择与RTCA法相同的细胞浓度接种于96孔板中,每孔100μL。置于37℃,CO2体积分数为5%,饱和湿度下培养约24 h后进行染毒。纳米氧化铜染毒剂量组与RTCA法一致,每个剂量设4个复孔,同时设置空白对照组。共接种5块96孔板,分别在染毒3、12、24、36和48 h共5个时间点进行测定。染毒时间到达确定时间点后,各孔加入配制好的刃天青溶液,10μL/孔,终浓度为5μmol/L,继续培养4 h。用连续波长微孔板分光光度计进行检测,激发光波长530 nm,发射光波长590 nm。细胞存活率/%=×
1.6 统计学方法
2 结果
2.1 CuO-NPs的表征
透射电子显微镜图像显示CuO-NPs是不规则形状的晶体形式(图1)。XPS分析显示CuO-NPs由Cu和O组成。将CuO-NPs加入到BMECs完全培养液中,终浓度为最高染毒浓度1.5 mg/mL,Ζ电位测定结果表明,CuO-NPs在BMECs培养液中的Ζ电位为(-36.5±6.59)mv,水合粒径为(189.12±25.68)nm。CuO-NP样品在培养基中的Ζ电位绝对值较大,说明样品在培养基中的悬浮相对稳定。水合粒径结果表明,CuO纳米颗粒在细胞培养基中均形成团聚。其他关于纳米颗粒的研究中也得到类似结果[11-12]。
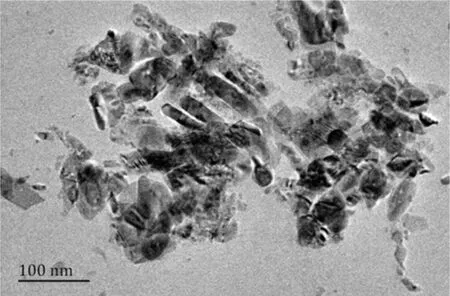
图1 CuO-NP的透射电子显微镜图像结果
2.2 RTCA法测定BMECs细胞毒性
2.2.1 细胞增殖的测定 本研究对BMECs进行细胞增殖分析以获得细胞毒性实验的最佳细胞接种数及最佳染毒时间。结果如图2所示,以15 min的间隔观察细胞特征,垂直蓝线表示细胞粘附和扩展的初始阶段,红线表示接种后的不稳定状态,在细胞接种的初始阶段(0~20 h)BMECs的CI值增加,这可能与细胞的附着和粘附有关,随后达到短暂的平台期。接后种40 h开始,CI值又逐渐升高,说明细胞从这个时间点开始大量增殖,进入快速生长期。因此,后续试验研究建议在BMECs接种后40 h作为染毒时间点。
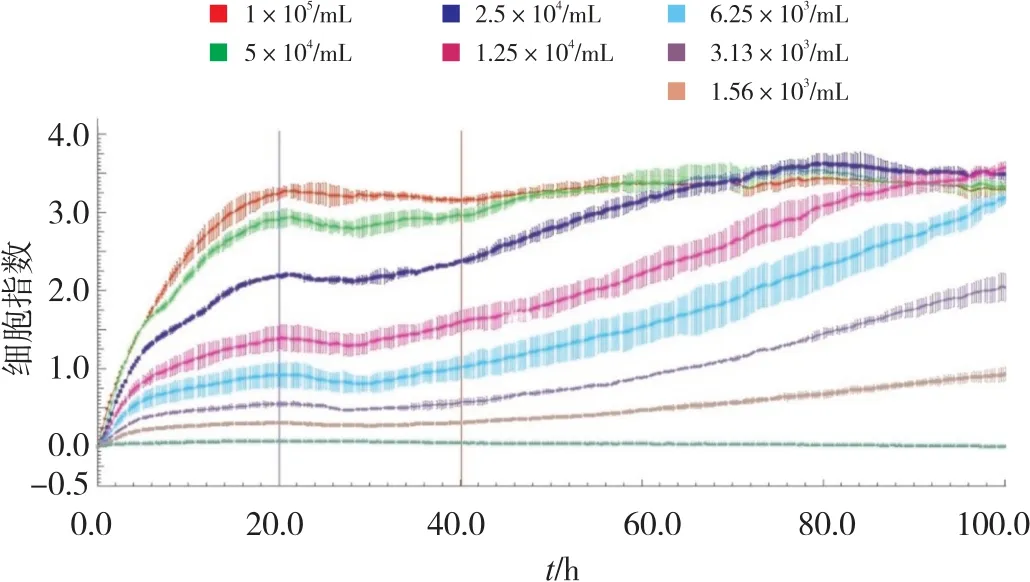
图2 BMECs生长曲线
另外,1.0×104和5.0×103个/孔的两组细胞CI曲线随着时间的增加显示下降趋势。这可能是由于高密度BMECs会影响细胞生长。2.5×103个/孔细胞在染毒时间点细胞CI值快速增加并在受试时间内达到平台期,说明此细胞数量在受试时间内处于快速增殖期并达到稳定。从1.25×103及2.5×102个/孔两组细胞CI值生长曲线可见,到受试时间内该两组细胞一直处于增殖阶段,说明此两组细胞数量不足,在快速生长期内没有到达快速增殖状态。因此,选择每孔2.5×103个细胞作为细胞染毒的最佳数量。
2.2.2 细胞毒性测定 每孔选择2.5×103个BMECs细胞作为细胞染毒的最佳接种数量,接种后约40 h进行染毒。以时间为X轴,归一细胞指数(NCi)值为Y轴绘制细胞生长曲线,观察不同剂量CuO-NPs所产生的细胞毒性,如图3所示。结果显示BMECs在0.38、0.75、1.5 mg/mL染毒后2~3 h引起瞬间不稳定,之后是渐进死亡,这可能是由于纳米颗粒本身的特征,如扩散后沉积、团聚等,导致其进入大分子的细胞培养体系后而产生的影响,而非毒性作用所致。此外,0.75、1.5 mg/mL组BMECs的NCi值在染毒后约2 h开始降低并在4 h内降至约0。其他染毒剂量组的毒性效应曲线可观察到近似剂量依赖性趋势。
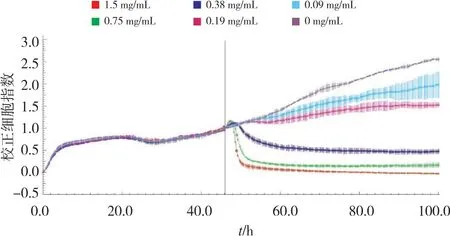
图3 RTCA测定CuO-NPs对BMECs的细胞毒性
2.3 刃天青法测定CuO-NPs的细胞毒性
为了比较从RTCA系统获得的结果,在染毒3、12、24、36和48 h时,通过刃天青法测量细胞活力。不同染毒时间下的细胞活力见图4。BMECs暴露于1.5和0.75 mg/mL的CuO-NPs时所产生的细胞毒性最大。CuO-NP剂量0.09 mg/mL染毒24 h以内、0.19 mg/mL染毒3 h细胞活力与对照组(0 mg/mL)无显著差异,其它受试剂量组各染毒时间点细胞活力均明显低于对照组,差异有统计学意义(P<0.05)。并且各染毒剂量组可观察到剂量依赖性细胞毒性。可见刃天青法测定结果与RTCA获得的结果相似。
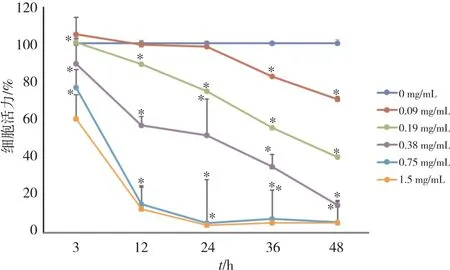
图4 刃天青法测定CuO-NPs的细胞毒性
2.4 RTCA及刃天青法所测CuO-NPs对于BMECs细胞IC50值的比较
本研究在两种毒性测定方法中都观察到类似的剂量依赖性,因此选择相同的暴露时间点(染毒3、12、24、36、48 h)计算其IC50值。RTCA方法通过RTCA分析系统计算各时间点的IC50值及回归系数R2,刃天青法通过拟合曲线计算Logistic回归系数R2值。结果如表1所示。
利用SPSS 16.0软件将两种方法在5个时间点测得的BMECs细胞IC50值进行统计分析,相关性分析显示两种方法所得IC50值相关系数为0.999,P=0.000,具有相关性。配对t检验结果显示,差异无统计学意义(t=1.125,P=0.323)。从计算IC50的R2值来看,RTCA拟合曲线R2值高于刃天青法Logistic回归系数R2值。
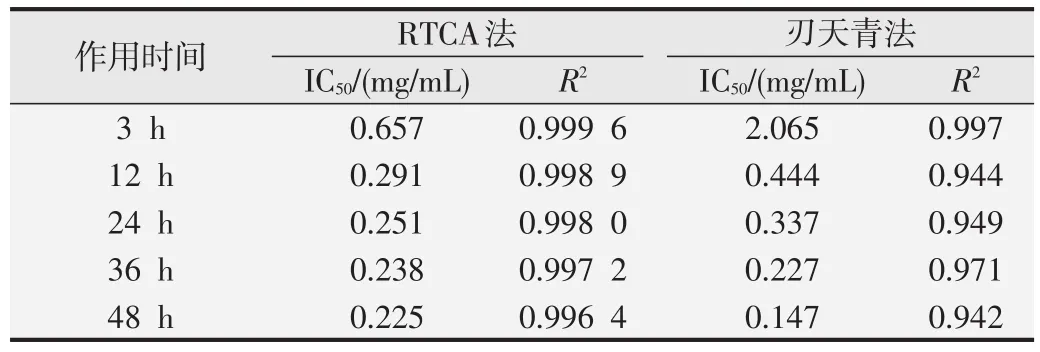
表1 两种方法检测CuO-NPs作用于BMECs不同暴露时间的IC50值及R 2值
3 讨论
细胞毒性测定是外源性化学物质体外机制研究的关键,也是毒性效应研究的基础。本研究通过采用2种毒性测定方式相比较的方法,研究纳米氧化铜对原代BMECs细胞的毒性作用,以探讨适用于纳米颗粒物的细胞毒性测定方法。
而纳米材料本身具有体积效应、表面效应、量子尺寸效应等特殊的物理特性,可能产生特有的细胞毒性作用[13]。常规的细胞毒性测定方法所得结果为某一个或几个时间点的数值,用于测定粒径仅为1~100 nm范围的纳米粒子,可能会出现忽略纳米材料作用于细胞毒性变化过程的情况。而RTCA是一种实时细胞分析技术,它基于微电子阻抗原理,反映细胞活性的无标记连续监测活细胞状态,不受受试物本身形态的影响,可避免纳米颗粒物易团聚而对结果产生的影响。另外,RTCA技术可根据需要进行实时测定,反映贴壁细胞的数量、形态及粘附能力等特征的综合指数,可反映整个毒性作用过程的变化情况。然而,RTCA方法是一种新兴的细胞毒性检测技术,其应用于纳米颗粒毒性测定的适用性及准确性还需经过多方面验证。因此本研究将RTCA方法与目前已被认可的常用的细胞毒性检测方法刃天青法进行比较。从分析结果中可以看出,两种方法所获得IC50值相关系数为0.999,P=0.000,具有相关性。通过配对t检测结果可见此两种方法的结果差异无统计学意义,说明这两种方法所得毒性结果在趋势上具有一致性,RTCA方法适合于纳米颗粒的细胞毒性测定。并且从计算IC50拟合曲线的R2值来看,RTCA拟合曲线R2值高于刃天青法Logistic回归系数R2值,说明RTCA所得结果更为精确。另外,RTCA方法可以实时监测到细胞的生长状态、提供动态分析数据、并可以观测到细胞毒性开始的起始点及整个生长过程中的变化,更为详细、准确的提供毒性数据结果,因此相比于经典的细胞毒性测试方法,更具优势。
本研究通过RTCA对不同接种浓度的BMECs进行细胞增殖分析,建立了BMECs完整生长周期的生长曲线,获得了细胞进行快速生长期的时间点并筛选出最佳接种浓度,确定后续试验研究的染毒时间为接种后40 h,最佳接种浓度为2.5×103个/孔,对于后续研究CuO-NP对血脑屏障功能影响的机制研究提供了可靠的数据支撑。

