枸杞多糖对酒精性肝损伤小鼠肾脏的保护作用
魏芬芬,王文娟,张 波*
(北京联合大学健康与环境学院,北京 100191)
据统计,全球每年大约有4%的死亡与酗酒有关,过量饮酒已经成为全世界的一个公共卫生问题。肝脏是酒精代谢的主要器官,但肾脏作为乙醇的排泄器官,酒精摄入后约有10%的酒精会在肾脏进行代谢。已有研究表明,肾脏中也存在乙醇代谢的关键酶(乙醇脱氢酶和乙醛脱氢酶),因此可以推断乙醇在肾脏中的代谢途径可能与肝脏类似,而乙醇在肾脏代谢过程中可能也会对肾脏造成损伤[1]。
枸杞属于茄科、枸杞属植物,是我国一种名贵的药食同源植物,在《神农本草》中记录其具有滋肝补肾、益精明目等功效[2]。枸杞多糖(lycium barbarum polysaccharides,LBP)则是枸杞的主要活性成分[3],已被证实具有多种生物活性,如抗肿瘤、抗炎、免疫调节等活性。枸杞多糖对酒精性肝损伤的保护作用已有许多研究,并且研究表明枸杞多糖可以通过增强肝脏的抗氧化作用,增强机体的应激能力,从而减轻酒精对肝脏的损害[4]。同理,既然肾脏作为乙醇最大的排泄器官,同时也负责代谢小部分乙醇,那么乙醇对肾脏是否也会产生类似肝脏的损伤作用,枸杞多糖对于肾脏的损伤是否也具有保护作用?基于以上疑问,本实验通过建立酒精性肝损伤小鼠模型,研究枸杞多糖对小鼠酒精性肾损伤的保护作用及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 枸杞多糖经水提醇沉工艺,最终获得纯度为60%的枸杞多糖,粉末状,由中国科学院兰州物理化学研究所提供;无水乙醇(分析纯)购于北京化工厂;丙二醛(malondialdehyde,MDA;批号201709027)、还原型谷胱甘肽(glutathione peroxidase,GSH;批号20171130)、总超氧化物歧化酶(superoxide dismutase,SOD,批号20170815)以及考马斯亮蓝(批号20170812)均购于南京建成生物工程所;小鼠肿瘤坏死因子-α(TNF-α,批号201609)和小鼠白介素-1β(IL-1β,批号201609)酶联免疫检测试剂盒购于上海沪尚生物科技有限公司。德国Eppendorf公司5804R型低温高速离心机;上海一恒科学仪器有限公司电热恒温培养箱;常州朗越仪器制造有限公司电动匀浆器;日本津岛仪器有限公司UV-2450紫外可见分光光度计;日本日立高新技术公司7180型全自动生化分析仪;上海民桥精密科学仪器有限公司FA2104N型电子天平;日本奥林巴斯有限公司cx23生物显微镜。
1.1.2 实验动物 SPF级雄性昆明小鼠60只,体质量(20±2)g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2012-0001。实验室条件:实验动物饲养于SPF级动物房,动物使用许可证号为SYXK(京)2012-0031,温度控制在(20±2)℃之间,空气相对湿度50%~70%,光照设定为12 h/12 h明暗交替,自由摄食和饮水,每日更换垫料。分笼饲养,饲料充足,饮水不限,适应环境喂养3 d后用于本实验。
1.2 方法
1.2.1 小鼠酒精性损伤模型的建立 60只昆明小鼠适应性饲喂3 d后,随机分为5组:正常对照组、模型组、枸杞多糖低(75 mg/kg)、中(150 mg/kg)、高(300 mg/kg)剂量组,本剂量设置时根据药典中,枸杞的人体推荐剂量6~12 g/d设置。第1~9天,枸杞多糖各剂量组每天经口灌胃受试物(20 mL/kg),正常对照组和模型组则给予等体积双蒸水。第10~16天,在灌胃受试物4 h后,枸杞多糖组和模型组小鼠均经口灌胃给予50%(V/V)浓度酒精进行造模,灌胃体积为12 mL/kg,正常对照组小鼠则给予等量双蒸水。
1.2.2 样品的收集与指标检测 末次灌胃后,各组小鼠禁食不禁水16 h。称量体质量,摘眼球取血,血浆静置30 min后,于4 000 r/min室温离心15 min,分离血清置于1.5 mL离心管中,4℃保存。
1.2.3 实验动物肾脏指数的计算 解剖取得小鼠两侧肾脏后,迅速用预冷的0.9%的生理盐水冲净表面浮血,滤纸拭干,称取质量,用于制备10%(V/V)肾脏组织匀浆液保存待测。按照此公式计算实验小鼠的肾脏指数:肾脏指数/%=小鼠肾脏质量/小鼠体质量×100%。
1.2.4 血清生化指标的检测 采用全自动生化分析仪测定血清中葡萄糖(glucose,GLU)、尿素氮(blood urea nitrogen,BUN)和肌酐(creatinine,CREA)的浓度。
1.2.5 肾脏组织氧化指标检测 取10%(V/V)肾脏组织匀浆液,分别测定肾脏组织中SOD、GSH和MDA,均按照SOD、GSH、MDA测定试剂盒说明书进行实验。
1.2.6 炎性因子检测 取10%(V/V)肾脏组织匀浆液,用ELISA试剂盒测定肾脏组织中TNF-α和IL-1β的浓度,均按照小鼠肿瘤坏死因子-α和小鼠白细胞介素-1β试剂盒说明书进行实验。
1.3 数据处理
采用SPSS 22软件对实验数据进行统计分析,结果以xˉ±s表示,显著性检验采用单因素方差分析。图片处理采用OringinPro 2017软件。
2 结果
2.1 枸杞多糖对酒精性损伤小鼠体质量及肾脏指数的影响
为了监测酒精对小鼠体质量变化的影响,各组体质量、肾脏质量以及肾脏指数如表1所示。由表1可见,各组实验小鼠初始体质量无明显差异,各剂量组小鼠在灌胃枸杞多糖期间体质量也正常增长,体质量与正常对照组小鼠无明显差异,表明枸杞多糖摄入对小鼠食欲健康等无明显影响。从实验第10天起,给予剂量组和模型组酒精干预,在酒精干预前,各组小鼠体质量无显著差异。而在实验结束时,与正常对照组相比,模型组小鼠体质量显著降低(P<0.01),表明实验小鼠在大量摄入酒精后,小鼠食欲受到影响,健康状态欠佳,导致体质量下降。与模型组相比,枸杞多糖各剂量组体质量均升高,中剂量组则显著升高(P<0.05),表明在枸杞多糖的干预下,酒精对小鼠健康的损害程度得到一定缓解。同时,与正常对照组相比,模型组小鼠肾脏指数显著上升(P<0.01),表明实验小鼠在受到酒精长期刺激后,肾脏发生肿胀,因此肾脏指数升高。与模型组相比,枸杞多糖各剂量组肾脏指数均显著降低(P<0.05或P<0.01),表明枸杞多糖能够缓解酒精对肾脏造成的损伤。
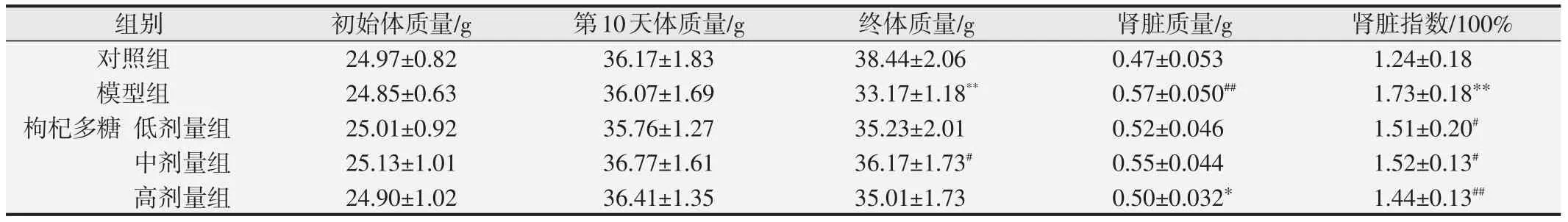
表1 枸杞多糖对小鼠体脂率及肾脏指数的影响
2.2 枸杞多糖对酒精性损伤小鼠血清GLU、BUN以及CREA的影响
如表2所示,与对照组相比,模型组小鼠血清GLU、UREA以及CRE浓度显均著升高(P<0.01),表明模型组小鼠肾脏在受到大量酒精刺激后,肾脏发生了损伤。与模型组相比,中剂量组和高剂量组小鼠血清GLU浓度显著降低(P<0.05);低剂量组和高剂量组UREA浓度均显著下降(P<0.05或P<0.01);高剂量组CREA浓度显著下降(P<0.05),表明在枸杞多糖干预下,实验小鼠肾脏损伤得到一定缓解。
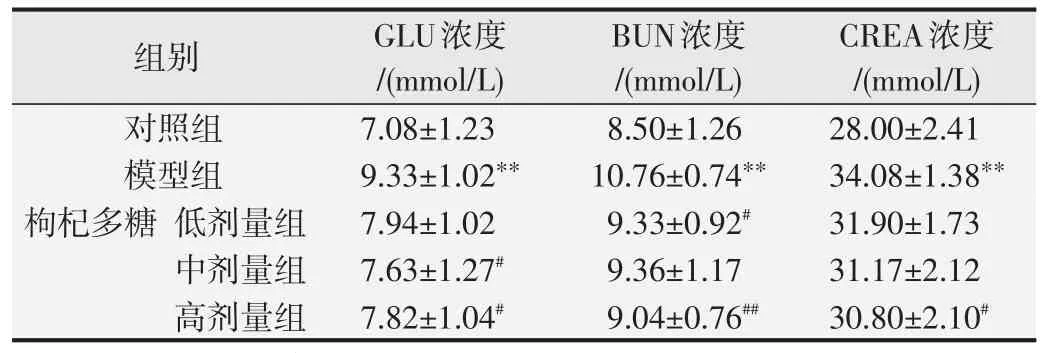
表2 枸杞多糖对小鼠血清GLU、BUN、CREA浓度的影响
2.3 枸杞多糖对酒精性损伤小鼠肾脏SOD、GSH、MDA的影响
酒精及其代谢物会在体内引起一系列的氧化损伤,为了检测酒精对肾脏的氧化损伤程度,我们测定了肾脏中的SOD、GSH以及MDA。由表3可知,与正常对照组相比,模型组小鼠的SOD和GSH均显著降低(P<0.01),MDA浓度显著升高(P<0.01),表明酒精的刺激,引起肾脏发生了氧化损伤,导致SOD和GSH均下降,脂质过氧化物MDA含量上升。与模型组相比,高剂量组的SOD活力显著升高(P<0.01),3个剂量组的GSH含量显著升高(P<0.01),MDA含量显著下降(P<0.05或P<0.01),实验结果表明,枸杞多糖对由酒精引起的氧化损伤具有一定的缓解作用,其中,对增强GSH和降低MDA含量比增强SOD活力的作用更明显。
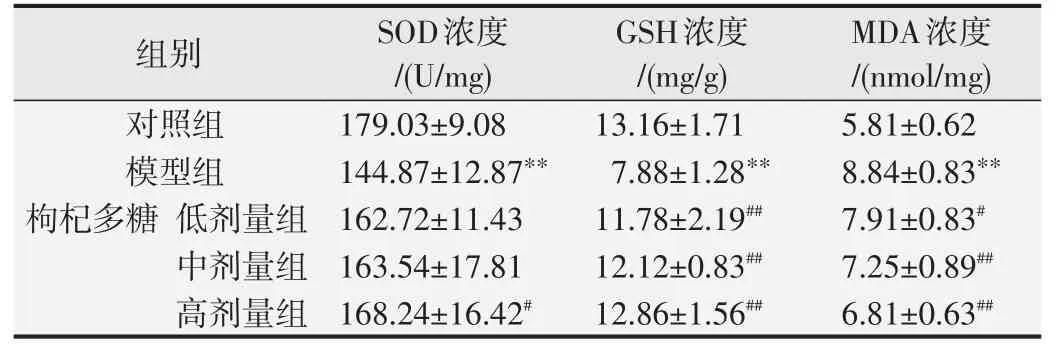
表3 枸杞多糖对小鼠肾脏SOD、GSH、MDA的影响
2.4 枸杞多糖对酒精性损伤小鼠肾脏TNF-α和IL-1β的影响
TNF-α和IL-1β作为两个重要的促炎因子,在酒精性损伤过程中被当作反映炎症损伤程度的重要指标。由表4可知,与对照组相比,模型组小鼠肾脏TNF-α和IL-1β浓度显著升高(P<0.01),表明模型组小鼠肾脏经酒精刺激后,发生了严重的炎症反应。与模型组相比,各剂量组TNF-α浓度显著降低(P<0.05或P<0.01),高剂量组的IL-1β浓度显著降低(P<0.05),低剂量和中剂量降低不明显(P>0.05),这表明枸杞多糖对改善炎症反应有明显的效果,且对TNF-α的清除能力要强于IL-1β。
3 讨论
目前,饮酒过量已成为全球最严重的健康卫生问题之一。全球大部分国家都在努力降低酒精的使用量,以减少酒精对健康的危害。研究表明,酒精对机体的危害主要是由于酒精及其代谢产物会在体内发生一系列的氧化应激、脂质代谢紊乱及细胞凋亡等,对组织器官造成损害[5-6]。肝脏是酒精代谢的主要器官,酒精性肝损伤也一直是人们的研究热点。但相关研究表明,肾脏也负担着约10%的酒精代谢[7],而肾脏中同样存在着类似于肝脏的酒精代谢途径即乙醇在乙醇脱氢酶的作用下,转变成乙醛,乙醛在乙醛脱氢酶的作用下转变成乙酸,最终排出体外[8]。那么在肾脏代谢乙醇的过程中,乙醇及其代谢产物同样会对肾脏产生一定的损害。
体质量变化和脏器指数是评估机体健康状态的一个重要指标。本实验结果显示,实验小鼠在连续灌胃酒精后,与正常对照组相比,模型组小鼠体质量显著降低,肾脏指数显著升高,表明模型组小鼠在连续受到酒精刺激后,食欲及消化吸收功能受到影响,导致体质量下降,肾脏发生肿胀或者脂肪浸润,导致肾脏指数上升。各剂量组与模型组相比,体质量显著回升,肾脏指数显著下降,表明枸杞多糖对酒精性损伤小鼠的健康有一定保护作用。血清中葡萄糖(GLU)浓度受到多种因素调节,其中肾脏对其也具有一定调节功能,主要是通过肾小管和集合管的重吸收作用发挥调节作用[9],而血清尿素氮(BUN)和肌酐(CREA)是临床上评价肾功能的重要指标,当血清中GLU、BUN和CREA浓度升高时,则表明肾功能可能出现异常。在本实验中,模型组小鼠GLU、BUN和CREA浓度显著高于正常对照组,提示酒精可能造成了小鼠的肾功能损伤,如肾小管的重吸收能力以及肾小球滤过功能受到影响,实验结果与王楠等[1]的研究一致,即乙醇长期刺激对小鼠肾功能的确有影响。与模型组相比,各剂量组小鼠GLU、BUN和CREA浓度均降低,表明枸杞多糖对肾功能损伤具有一定保护作用。
氧化应激是酒精性损伤的机制之一。乙醇及其代谢产物刺激机体产生的活性氧自由基会攻击机体正常的细胞,如攻击细胞膜内的不饱和脂肪酸,导致脂质过氧化物MDA增加,并通过链式反应使活性氧的攻击性更强。SOD是体内清除超氧阴离子自由基最有效的抗氧化酶,可直接将超氧阴离子自由基转变为H2O2,达到清除自由基的目的。GSH能够较好地清除体内多余的H2O2、LOOH等,是衡量机体抗氧化能力的重要指标之一[10]。同时,足量的GSH也能够增强对乙醇及其代谢物的解毒能力[11]。SOD和GSH构成了机体防御自由基攻击的重要屏障,他们通过清除超氧阴离子自由基并终止了自由基的链式反应,在抵抗氧化损伤中起了重要作用[12]。MDA作为脂质过氧化反应的产物,可以反映机体发生脂质过氧化反应的程度,从而间接反映机体受自由基攻击的程度[13-14]。已有研究表明,枸杞多糖与黄芪多糖联用可以升高GSH和降低MDA含量[14],铁皮枫斗多糖[15]能够提高SOD活性,黑牛肝菌多糖[12]和香菇多糖[16]均能显著提高SOD与GSH含量,使MDA含量显著降低。与上述多糖类似,本实验中,枸杞多糖能够显著提高SOD和GSH含量,减少脂质过氧化物MDA含量,表明枸杞多糖具有良好的抗氧化活性,能够有效抵抗由酒精引起的机体的氧化损伤。
炎症反应作为酒精性损伤的机制之一,也一直被人们所研究。乙醇在肾脏的代谢与排泄过程中,也会刺激肾脏发生炎症反应。其中肿瘤坏死因子TNF-α和白细胞介素IL-1β是两个重要的促炎因子,在炎症反应发生过程中起着重要作用。TNF-α可以促进T细胞产生各种炎性因子,从而促使炎症反应的发生[17]。IL-1β能够诱导其他的炎症细胞因子和趋化因子等的分泌,是炎症反应中重要的促炎因子[18]。除了可以直接作用,IL-1β还通过联合其他促炎症因子共同发挥作用,导致机体发生“炎症级联效应”,加重炎症损伤[19]。在本研究中,模型组小鼠TNF-α和IL-1β浓度显著升高,表明由于酒精的刺激,小鼠肾脏发生了炎症损伤。各剂量组与模型组相比,二者浓度均显著降低,提示枸杞多糖能够降低炎性因子浓度,减轻炎症损伤。
综上所述,枸杞多糖对酒精致小鼠肾脏损伤具有良好的保护作用,其作用机制可能是通过增强机体的抗氧化能力、减少自由基的产生、减轻炎症反应等方面发挥作用,但其具体作用机制还有待下一步研究。
(致谢:感谢中国科学院兰州物理化学研究所提供的枸杞多糖,感谢北京联合大学生物活性物质与功能食品北京市重点实验室提供实验设备)

