2,3,7,8-四氯二苯并二噁英染毒或联合高脂饮食致小鼠糖脂代谢紊乱的实验研究
廖 鼐,龙 子,海春旭,王 欣*
(空军军医大学军事预防医学院毒理学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室,陕西西安 710032)
近年来,肥胖、糖尿病等糖脂代谢紊乱疾病患病率在全球范围内急剧增加。全球有10亿以上的成年人存在超重(定义为体质指数超过25 kg/m2)的问题,超过3亿的成年人被归类为肥胖(体质指数大于30 kg/m2)[1]。经估算,在美国有超过35.7%的成年人和16.9%的儿童和青少年被认定为肥胖。2010年,全球糖尿病患病率为6.4%,患病人数2.85亿。到2030年,这些数字将分别增加到7.7%和4.39亿。目前,中国成年人糖尿病患病率为10.9%,糖尿病前期患病率为35.7%[2]。环境内分泌干扰物暴露与糖尿病、肥胖等糖脂代谢紊乱疾病的全球流行密切相关[3-4]。持久性有机污染物(persistent organic pollutants,POPs)是一类重要的环境污染物,这类环境污染物性质稳定,在环境和人体中都很难降解[5-6]。POPs能长时间滞留于环境中,在空气、水等媒介的作用下广泛传播,并可通过食物链(网)累积,呈现生物放大的作用,最终集聚于生物链顶部的人身体中。因POPs的高毒性和高亲脂性,使其容易沉积于脂肪组织或细胞之中,并且能够抗生物降解。人体内高水平的POPs与糖尿病和代谢紊乱的危险性具有相关性[7-10]。二噁英是一类重要的POPs,其中 2,3,7,8-四氯二苯并二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)是毒性最强的一种二噁英同类物[11-12]。TCDD可以促进肿瘤生成,引起致畸性、免疫毒性、内分泌代谢毒性,严重者可以致死。TCDD对内分泌代谢系统的影响是糖脂代谢紊乱疾病流行的重要原因之一。然而,TCDD导致糖脂代谢紊乱的机制还不明确。本研究将采用TCDD染毒或联合高脂饮食诱导制作小鼠糖脂代谢紊乱模型,分析TCDD对肝和脂肪组织氧化应激和炎症的影响,为明确TCDD导致糖脂代谢紊乱的分子机制提供实验依据。
1 材料与方法
1.1 材料与试剂
C57BL/6J小鼠由空军军医大学实验动物中心提供;TCDD、D-葡萄糖购自美国Sigma公司;Hoechst、Rho123、dihydroethidium(DHE)探针购自上海碧云天生物技术研究所;高脂鼠饲料购自江苏美迪森生物技术有限公司。
1.2 方法
1.2.1 实验分组与动物模型 60只小鼠随机分为4组:对照组、高脂饮食组组、TCDD染毒组、高脂饮食和TCDD染毒联合作用组。对照组和TCDD染毒组小鼠给予正常饮食。高脂饮食组和联合作用组小鼠给予脂肪热量为45%的高脂饲料。TCDD染毒组和联合作用组小鼠给予含4 mg/L TCDD的饮水。每只小鼠每天的饮水量约为4~5 mL,通过饮水摄入的TCDD剂量约为1 mg/(kg·d)。小鼠染毒时间为3周。染毒结束后,测定体质量,使用罗氏血糖仪和血糖试纸测定空腹和餐后血糖。处理完毕后,小鼠隔夜禁食,苯巴比妥钠麻醉,眼球摘除取血,颈椎脱臼处死,立即收集肝组织和脂肪组织等样本,测定肝质量和脂肪质量,计算肝体比(肝质量/体质量)和脂体比(脂肪质量/体质量)。取部分肝和脂肪组织立即在冰冻条件下切片,部分固定于10%多聚甲醛用于病理观察,剩余组织储存于-80°C备用。
1.2.2 糖耐量和胰岛素耐量测定 使用腹腔注射葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT)和胰岛素耐量试验(intraperitoneal insulin tolerance test,IPITT)来评价小鼠对葡萄糖和胰岛素的反应。染毒最后一天,小鼠禁食12 h,通过鼠尾滴血测定基础血糖水平。小鼠分别腹腔注射D-葡萄糖(1 g/kg)或诺和灵R胰岛素(0.75 U/kg)。分别于注射后30、60、120 min,测定血糖水平。绘制血糖随时间变化曲线,并计算曲线下面积(area under the curve,AUC)。该面积越大,说明小鼠对葡萄糖或胰岛素的反应性越差,反之亦然。
1.2.3 ROS水平测定 肝和脂肪组织冰冻切片于暗室用10μmol/L DHE和10μmol/L Hoechst(衬染细胞核)孵育30 min,PBS冲洗3遍,晾干。抗荧光淬灭封片剂封片,共聚焦显微镜观察拍照。每组选取6个样本,每个样本选取3个视野,Image J软件量化分析单位面积的荧光强度。
1.2.4 线粒体膜电位测定 肝组织冰冻切片于暗室中用10μmol/L Rho123和10μmol/L Hoechst(衬染细胞核)孵育30 min,PBS冲洗3遍,晾干。拍照及荧光强度检测同1.2.3。
1.2.5 实时荧光定量PCR 使用天根总RNA提取试剂盒提取总RNA。使用TaKaRa PrimeScriptTMRTPCR Kit将500 ng RNA反转录为cDNA。使用1μL cDNA(20μL反应体系)进行实时PCR反应。反应试剂为 SYBR Green PCR kit(Thermo Scientific,IL,USA),反应仪器为CFX96 real-time PCR system。反应条件:95℃预变性10 min,95℃变性1 min,53℃退火1 min,72℃延伸1 min,变性、退火、延伸循环30次,最后72℃延伸5 min。RNA相对含量用2-ΔΔCT的方法计算。β-actin为内参。引物序列如下:βactin,上游 5'-AGGCCAACCGTGAAAAGATG-3',下游5'-TGGCGTGAGGGAGAGCATAG-3';IL-1ɑ,上游5'-CCCGTGTTGCTGAAGGAG-3',下游5'-ACTTTGT TCTTTGGTGGC-3';IL-6,上游 5'-TTCCAATGCTCT CCTAAC-3',下游 5'-TGACCACAGTGAGGAATG-3';M-MCP1,上游 5'-CATCTGCCCTAAGGTCTT-3',下游 5'-CATCACAGTCCGAGTCACAC-3'; GPx1,上 游5'-GAAGCGTCTGGGACCTCG-3',下游5'-CCAGGTC GGACGTACTTG-3';GCLC,上游 5'-TACGGAGGAA CGATGTCT-3',下游 5'-CTGTGTTCTGGCAGTGTG-3';SOD2,上游 5'-CTCAGGTCGCTCTTCAGC-3',下游 5'-AGCCTCCAGCAACTCTCC-3';Nrf2,上游 5'-CCACATTCCCAAACAAGA-3',下游5'-GGGCAGTG AAGACTGAAC-3'。
1.2.6 统计学方法 数据均用 xˉ±s表示。采用Graphpad Prism软件进行统计学分析。采用单因素方差分析多组间差异,如果多组间方差有统计学意义,进一步使用Newman-Keuls方法对4个组进行两两组间比较分析,以α=0.05为检验水准。
2 结果
2.1 TCDD染毒或联合高脂饮食对小鼠体质量、肝质量、肝体比和脂体比的影响
本研究首先检测TCDD染毒或联合高脂饮食对小鼠体质量、肝体比和脂体比等的影响,结果见图1。与对照组相比,TCDD染毒、高脂饮食或两者联合作用均使小鼠体质量增加,肝体比降低,附睾脂肪质量增加,附睾脂体比增加(P均<0.05),但未对肝质量产生显著影响(P>0.05)。TCDD染毒联合高脂饮食组小鼠的体质量、肝体比、附睾脂肪大小和脂肪质量、脂体比,与高脂饮食组比较差异均无统计学意义(P>0.05)。
2.2 TCDD染毒或联合高脂饮食对小鼠血糖水平、糖耐量和胰岛素耐量的影响
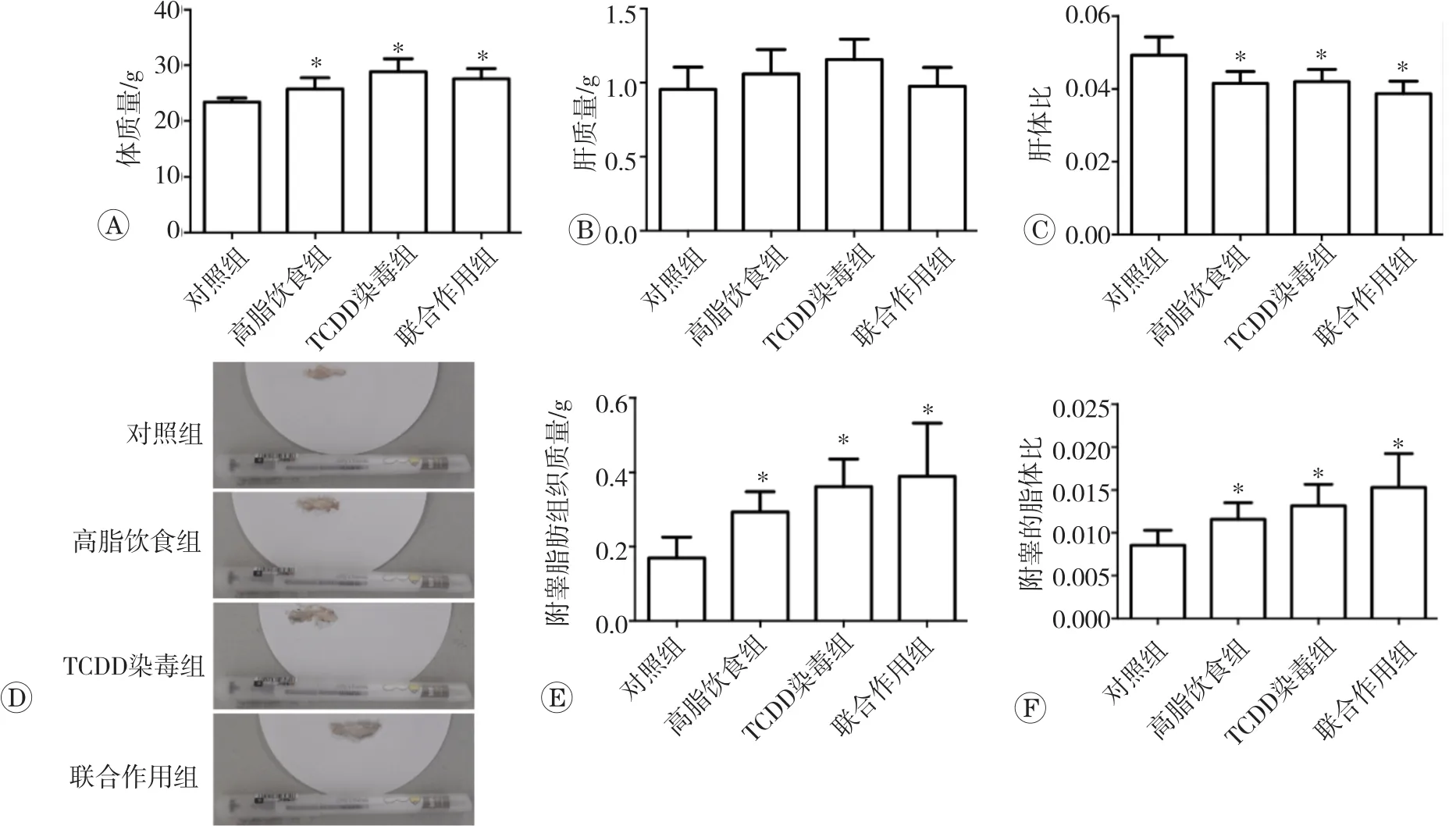
图1 TCDD染毒或联合高脂饮食对体质量、肝质量、肝体比和脂体比的影响
血糖检测、糖耐量和胰岛素耐量试验结果见图2,与对照组相比,TCDD染毒、高脂饮食或两者联合作用均使小鼠空腹血糖增加,餐后血糖增加,糖耐量曲线下面积增加,胰岛素耐量曲线下面积增加(P均<0.05)。此外,TCDD染毒和高脂饮食联合作用的效果大于TCDD单独处理和高脂饮食作用之和,表明TCDD可加重高脂饮食引起的糖耐量和胰岛素耐量损伤,TCDD染毒和高脂饮食联合作用对空腹血糖和餐后血糖的影响具有协同作用。
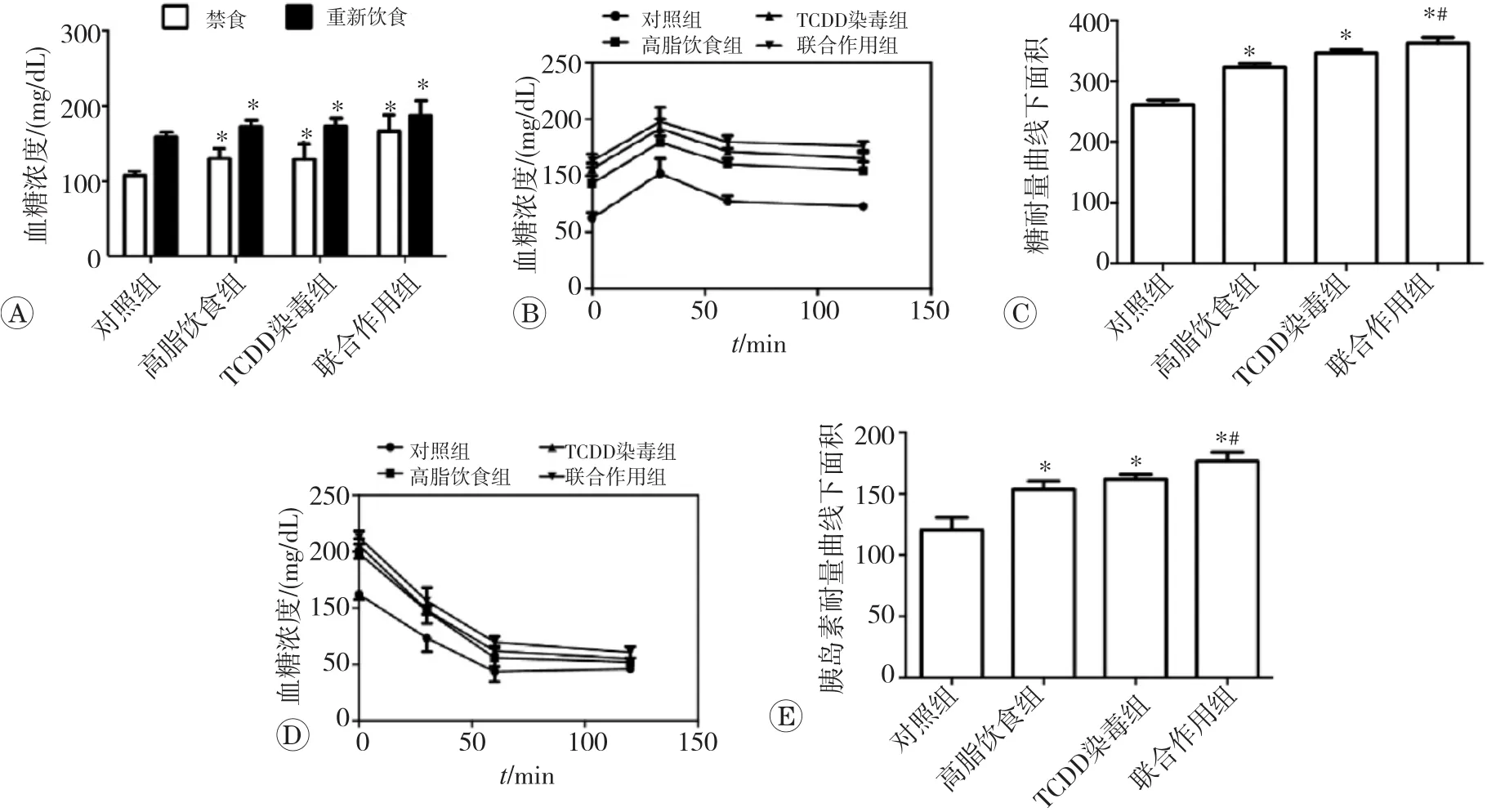
图2 TCDD染毒或联合高脂饮食对血糖水平、糖耐量和胰岛素耐量的影响
2.3 TCDD染毒或联合高脂饮食对小鼠肝细胞线粒体膜电位和ROS水平的影响
我们采用Rho123和DHE探针检测线粒体膜电位和ROS水平,结果见图3。高脂饮食组小鼠肝组织Rho123和DHE荧光,与对照组比较差异无统计学意义(P>0.05)(图3)。与对照组相比,TCDD染毒、TCDD染毒联合高脂饮食使小鼠肝组织Rho123和DHE荧光强度均增强(P<0.05)。与高脂饮食组相比,联合作用组小鼠肝组织Rho123和DHE荧光强度亦均增强(P<0.05)。此外,联合作用的效果大于TCDD染毒和高脂饮食作用之和。以上结果表明,TCDD诱导肝组织线粒体膜电位和ROS水平明显增加,TCDD染毒和高脂饮食联合作用对线粒体膜电位和ROS水平的影响具有协同作用。
2.4 TCDD染毒或联合高脂饮食对小鼠脂肪组织ROS水平的影响
脂肪组织ROS水平检测结果见图4。与对照组相比,TCDD染毒、高脂饮食或两者联合作用均使小鼠脂肪组织DHE荧光强度增强(P<0.05)。与高脂饮食组相比,联合作用组小鼠脂肪组织DHE荧光强度增强(P<0.05)。此外,联合作用的效果大于TCDD染毒和高脂饮食作用之和。以上结果表明,TCDD诱导脂肪组织的ROS水平明显增加,TCDD和高脂饮食联合作用对ROS水平的影响具有协同作用。
2.5 TCDD染毒或联合高脂饮食对小鼠脂肪组织抗氧化酶m RNA表达的影响
实时荧光定量PCR结果见图5。与对照组相比,高脂饮食使小鼠脂肪组织Nrf2 mRNA水平升高,GCLc mRNA水平降低,GPx1 mRNA水平升高(P<0.05);TCDD染毒使小鼠脂肪组织Nrf2、GCLc和SOD2 mRNA水平均降低(P<0.05);TCDD染毒联合高脂饮食使小鼠脂肪组织Nrf2、GCLc和SOD2 mRNA水平降低(P<0.05),而 GPx1 mRNA 水平升高(P<0.05)。与高脂饮食组相比,联合作用组小鼠脂肪组织Nrf2、GCLc和SOD2 mRNA水平均降低(P<0.05)。以上结果表明,TCDD染毒降低小鼠脂肪组织抗氧化酶的表达,TCDD和高脂饮食联合作用对Nrf2和SOD2 mRNA表达的影响具有协同作用。
2.6 TCDD染毒或联合高脂饮食对小鼠脂肪组织炎症因子mRNA表达的影响
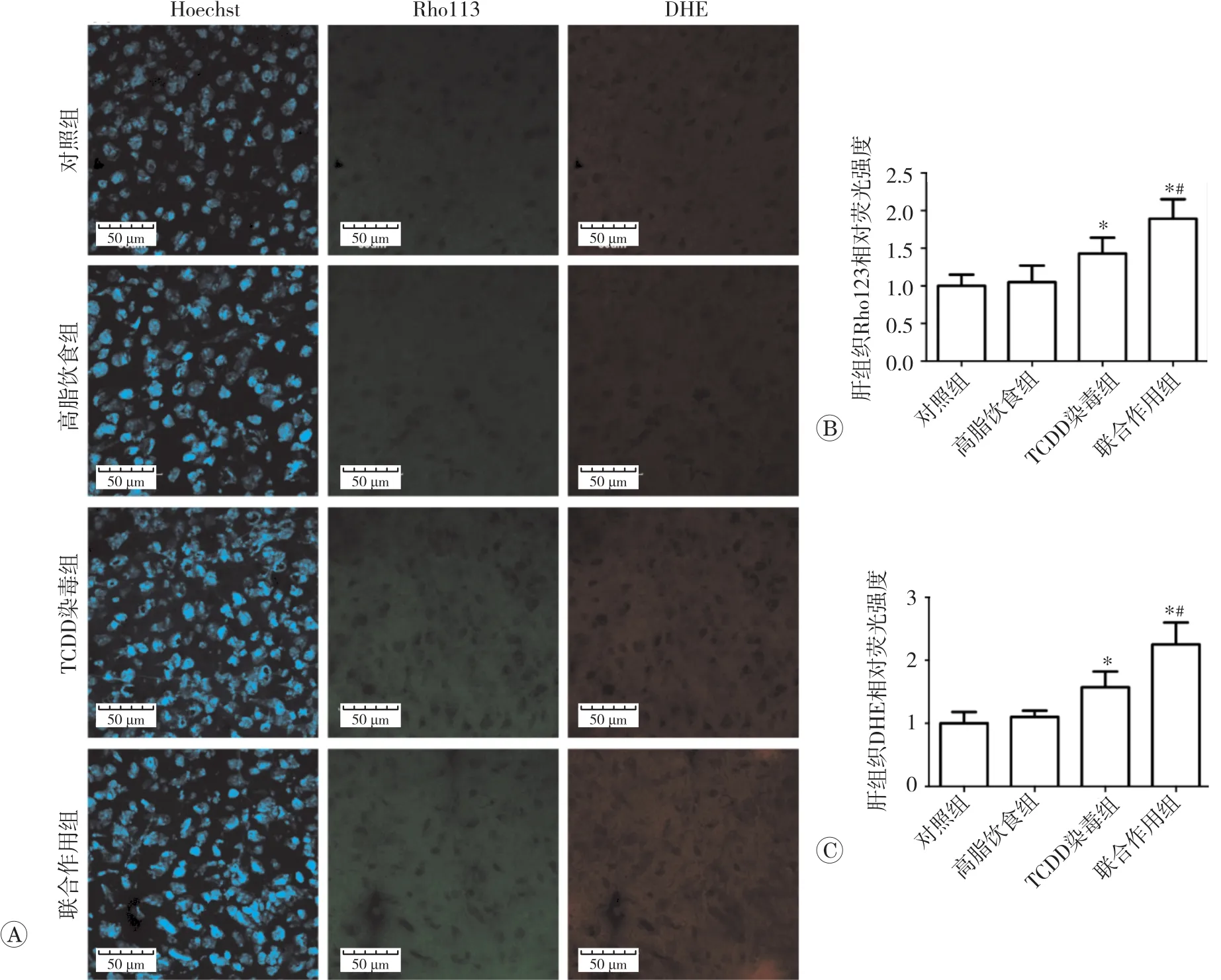
图3 TCDD染毒或联合高脂饮食对肝细胞线粒体膜电位和ROS水平的影响
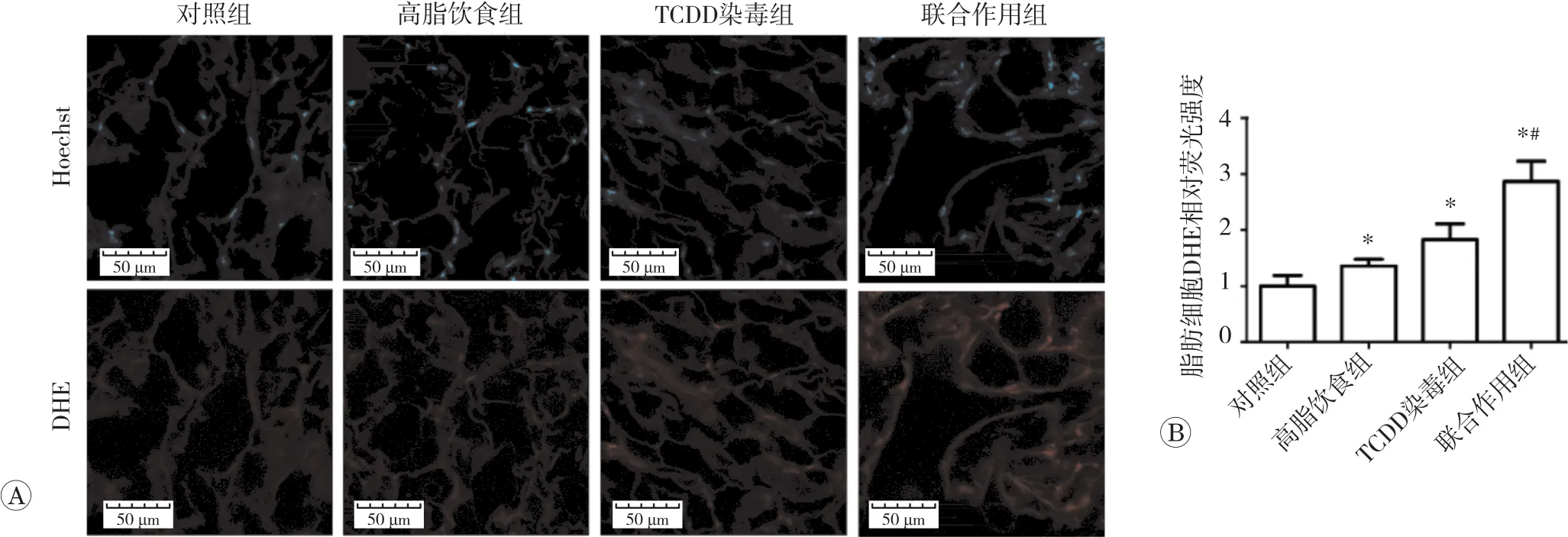
图4 TCDD染毒或联合高脂饮食对脂肪细胞ROS水平的影响
实时荧光定量PCR结果见图6。与对照组相比,TCDD染毒、高脂饮食或两者联合作用均使小鼠脂肪组织 IL-1α、IL-6、MCP-1 mRNA 水平升高(P<0.05)。与高脂饮食组相比,联合作用组小鼠脂肪组织IL-1α、IL-6、MCP-1 mRNA水平均升高(P<0.05)。此外,联合作用的效果大于TCDD染毒和高脂饮食作用之和。以上结果表明,TCDD可诱导小鼠脂肪组织炎症因子的表达,TCDD染毒和高脂饮食联合作用对炎症因子表达的影响具有协同作用。
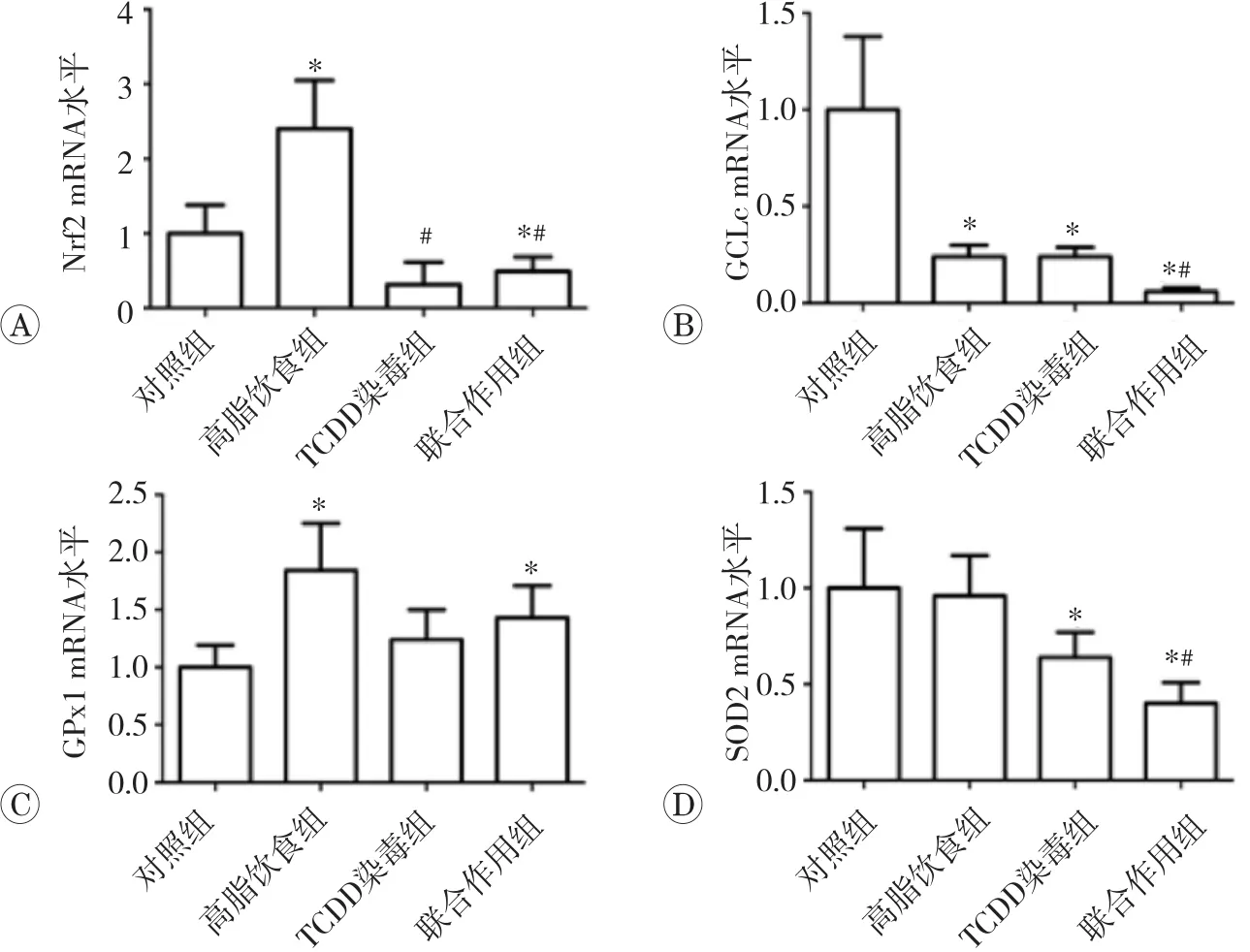
图5 TCDD染毒或联合高脂饮食对小鼠脂肪组织抗氧化酶m RNA表达的影响
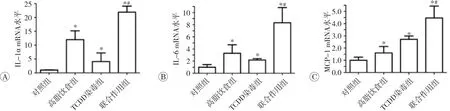
图6 TCDD染毒或联合高脂饮食对小鼠脂肪组织炎症因子m RNA表达的影响
3 讨论
环境因素和生活方式是肥胖、糖尿病等糖脂代谢紊乱疾病发生的重要原因。作为一种重要的环境内分泌干扰物和持久性有机污染物,二噁英(TCDD为主要代表)暴露与糖脂代谢紊乱密切相关。此外,过量营养摄入在肥胖、糖尿病等的发病中发挥至关重要的作用。然而,以上两种因素联合作用对糖脂代谢的影响及机制还不明确。在本研究中,我们评价了TCDD单独暴露或TCDD染毒和高脂饮食联合对小鼠糖脂代谢的影响。本研究的结果提示,TCDD单独暴露、TCDD染毒与高脂饮食联合均可诱导小鼠糖脂代谢紊乱,主要表现为附睾脂肪组织含量增加、血糖水平的升高和糖耐量、胰岛素耐量受损。与单独作用相比,TCDD和高脂饮食联合作用对糖脂代谢的影响明显增强,提示TCDD和高脂饮食联合暴露导致糖脂代谢紊乱的危险性显著增加。
在糖脂代谢的调节过程中,肝和脂肪组织的作用至关重要。肝组织通过调节糖异生、糖原合成与分解、脂质合成与分解影响糖脂代谢。脂肪组织,是由脂肪细胞组成的一种疏松结缔组织,在哺乳动物体内存在两种脂肪组织:白色脂肪组织和棕色脂肪组织[13-14]。作为一个具有新陈代谢功能的器官,白色脂肪组织的作用在于脂质的摄取、合成和以甘油三酯形式的储存。一旦细胞处于能量缺乏的情况,例如空腹,储存在白色脂肪中的甘油三酯会进行脂肪动员,分解为游离脂酸和甘油,以用作细胞的能量来源[15]。一些使用脂肪缺乏或脂肪代谢障碍模型的研究证明了在缺乏功能完整的脂肪细胞时,甘油三酯会倾向于储存于肝脏或肌肉中,使机体产生胰岛素抵抗[16-17]。机体的氧化还原稳态对于多种正常生理、生化过程至关重要,氧化还原失衡导致氧化应激,是多种疾病发生发展的重要诱因。过量的ROS可以通过直接损伤DNA、蛋白质、脂质等大分子或作为信号分子影响信号传递等方式,调节机体多种功能。文献和本课题组前期的研究表明,氧化还原稳态失衡致氧化应激在肥胖和2型糖尿病等疾病中发挥关键性作用。线粒体氧化磷酸化和各种代谢酶是细胞内ROS最主要的来源。在本研究中,我们重点关注了TCDD染毒或联合高脂饮食对肝和脂肪组织氧化应激的影响。本研究发现,在肝组织中,TCDD染毒或联合高脂饮食可以显著诱导肝组织线粒体超极化和ROS水平增加,并且TCDD和高脂饮食联合作用对线粒体和ROS的影响显著增强。在脂肪组织中,TCDD染毒或联合高脂饮食可以显著促进ROS生成,且TCDD和高脂饮食联合作用对ROS的影响显著增强。结果提示,TCDD和高脂饮食联合作用可以显著增强诱导的氧化应激。
基于氧化还原反应的多来源、多环节、多靶点、瞬时反应、链式反应与抗氧化的相对靶向性等特点,本课题组提出了“氧化还原链”的概念[18-19]:氧化还原系统的各种复杂分子构成了不同水平的氧化还原链,主要包括ROS链、ROS生成酶链、抗氧化复合链和转录因子链等。细胞内一种ROS通常会通过链式反应产生其他类型的ROS,某一位点生成的ROS也会诱发其他部位生成ROS,这些在不同时空位点生成的ROS构成“ROS链”。ROS主要由各种关键酶所产生,主要包括线粒体和内质网中ROS生成酶、NADPH氧化酶(NOXs)、黄嘌呤氧化酶(XOR)、一氧化氮合酶(NOS)、脂氧合酶(LOX)、环氧合酶(COX)、细胞色素P450酶系(CYPs)以及其他未确定的ROS生成酶。这些ROS生成酶在广泛分布在细胞膜、线粒体、内质网等部位,构成ROS生成酶链。在不同的生理病理条件下,ROS生成酶链的特定酶被激活,生成ROS。不同的生理病理条件决定了某种或多种ROS生成酶被激活。细胞内持续不断地生成ROS,抗氧化防御系统对于对抗ROS、维持氧化还原的动态平衡至关重要,这个抗氧化防御系统构成了抗氧化复合链,其由抗氧化非酶链和抗氧化酶链构成。抗氧化非酶链是指脂溶性及水溶性的多种抗氧化剂及抗氧化大分子组成,它是机体抵抗ROS威胁的第一道防线。一系列催化氧化还原反应的抗氧化酶构成了对抗潜在氧化损伤的第二道防线——抗氧化酶链,主要包括SOD、CAT、GCL、GPx、GST、Trx、Prx、HO-1、NOQ1、硒蛋白P和基质金属蛋白酶(MTs)等。一般认为,在氧化与抗氧化的对抗中,氧化处于优势地位。抗氧化非酶链和抗氧化酶链联合构成抗氧化复合链,抵御潜在的氧化威胁,维持氧化还原的动态平衡。此外,氧化还原稳态还受到更高水平的转录因子调控,这些氧化还原敏感的转录因子构成转录因子链,主要包括Nrf2、PGC-1α、p53、NF-κB和FoxOs等。这些转录因子相互作用,共同转录调节ROS生成酶和抗氧化复合链,在更高的水平动态调控氧化还原平衡。此外,表观遗传和翻译后修饰等一些新的调控机制也可以通过影响各种氧化还原链而调节氧化还原平衡。这些氧化还原链在不同的时空位相发生精细的相互作用,共同调控氧化还原稳态。其中,Nrf2是调控氧化还原平衡的核心转录因子,已知的绝大部分抗氧化酶,如SOD、CAT、GCL、GPx、HO-1、NOQ1等,都受到Nrf2的调控。Nrf2与其调控的各种抗氧化酶共同构成Nrf2-抗氧化酶链,是机体内最为重要的抗氧化防御体系。在本研究中,我们评价了TCDD和高脂饮食对脂肪组织Nrf2及关键抗氧化酶的影响,发现,TCDD可以显著降低Nrf2、GCLc和SOD2的表达,TCDD和高脂饮食联合作用,Nrf2及关键抗氧化酶的下降更为显著。结果提示,TCDD和高脂饮食联合作用对Nrf2及关键抗氧化酶的影响可能是其诱导氧化应激的关键因素。
此外,白色脂肪还是一个重要的内分泌器官,分泌脂联素、acrp30等脂肪因子,和肿瘤坏死因子-α(tumor necrosis factor- α, TNF- α)、 白 介 素 -1β(interleukin-1β,IL-1β)、IL-1α、IL-6、IL-8、IL-10、MCP-1等促炎性细胞因子[20]。这些炎症因子可以激活多种信号通路,并与氧化应激相互促进,最终导致胰岛素抵抗和糖尿病的发生。在本研究中,我们发现TCDD和高脂饮食使脂肪组织IL-1α、IL-6和MCP-1的表达显著升高,且联合作用组升高得更为明显。结果提示,TCDD和高脂饮食可以产生协同作用,促进炎症因子表达。
本研究提示,TCDD和高脂饮食可产生协同作用,导致糖脂代谢功能紊乱。肝组织和脂肪组织是TCDD和高脂饮食影响糖脂代谢的重要靶器官。氧化应激和炎症可能是TCDD和高脂饮食联合作用导致糖脂代谢紊乱的重要机制。Nrf2及其调控的抗氧化酶可能是TCDD和高脂饮食联合作用的关键靶点。还需进一步的实验明确TCDD和高脂饮食联合作用影响Nrf2抗氧化系统以及糖脂代谢的分子机制,为环境内分泌干扰物相关糖脂代谢紊乱的干预提供实验基础。

