响应面法优化链霉菌S10A09发酵产纤维素酶条件
霍光明,张李阳,朱枳穆,俞丽娜
(1.南京晓庄学院食品科学学院,江苏南京211171; 2.江苏省高校“特殊生物质废弃物资源化利用”重点建设实验室,江苏南京211171)
纤维素酶在许多工业应用过程中都起着重要作用,已被用在食品加工、纸张回收、清洁生产和动物饲料添加剂等领域[1-2]。将木质纤维素转化为大宗化学品是一项具有挑战性的中心工作[3]。因此,寻找转化效率高、稳定性好、适应能力强且价格便宜的产纤维素酶菌株是研究热点之一。
放线菌是一类具有降解纤维素能力的重要微生物,具有将纤维素转化为可发酵糖的能力,可用于生产大宗化学品,受到研究者关注[4-5]。链霉菌是放线菌中数量最大、研究最多的一类菌。链霉菌属中的许多种菌具有分解纤维素的能力,但一般分解纤维素能力较弱,且多为高温放线菌;虽然有中温放线菌对纤维素分解的报道,但大多仍属形态学、生态学方面的观察[1]。
本研究报道了1株来源于南京方山鞭蝎Typopeltiscrucifer肠道的链霉菌Streptomycessp.S10A09,具有较强的分解纤维素的能力,采用软件Minitab 15中的Plackett-Burman(PB)设计法、CCD中心组合设计法和响应面分析方法(RSM)对Streptomycessp.S10A09进行摇瓶发酵培养基的优化,以期为纤维素酶的生产提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种来源
从Typopeltiscrucifer肠道中分离获得的能降解纤维素的菌株Streptomycessp.S10A09,保存于中国典型培养物保藏中心(CCTCC),保存编号为CCTCC M 2014462。
1.1.2 培养基
种子液培养基(羧甲基纤维素钠(CMC-Na)培养基)(g/L):CMC-Na 10、NH4NO31.0、酵母膏1.0、MgSO4·7H2O 0.5、KH2PO41.0。
发酵产酶培养基(g/L): CMC-Na 10、(NH4)2SO44、KH2PO42、MgSO40.3、FeSO4·7H2O 0.01、NaCl 0.2、ZnSO40.002、MnCl20.002、CoCl20.002。
1.2 实验方法
1.2.1 产纤维素酶菌株液体发酵
将初筛到的菌株活化后接种于种子培养基中,培养温度28 ℃、摇床转速150 r/min的条件下培养4 d。种子液以体积分数10%接种量转接于装有100 mL产酶培养基中的体积250 mL三角瓶中,于28 ℃、150 r/min的条件下培养4 d。
1.2.2 粗酶液的制备
将发酵培养液于4 ℃、4 000 r/min离心10 min,取上清液测定酶活。
1.2.3 纤维素酶活力的测定(DNS法)
1)总酶活(滤纸酶活力(FPA))测定。参照文献[7]并稍作修改。取稀释10倍后的粗酶液0.5 mL,加入1.0 mL 0.05 mol/L的柠檬酸缓冲液(pH 4.8)和50 mg新华滤纸,以不加底物为对照,50 ℃反应60 min,加入3 mL 3,5-二硝基水杨酸(DNS)溶液,沸水浴5 min,再将试管置于冷水浴中,待试管冷却后,加入18 mL蒸馏水。以空白管做对照,采用分光光度计测540 nm处的OD540值。
2)纤维素内切酶(羧甲基纤维素酶)活力测定。参照文献[8]并稍作修改。取稀释10倍后的粗酶液0.5 mL,加入1.0 mL、pH 4.8的1%CMC-Na溶液,对照管中不加底物,50 ℃反应30 min,加入3 mL DNS溶液,沸水浴5 min,再将试管置于冷水浴中,待试管冷却后,加入18 mL蒸馏水。以空白管做对照,采用分光光度计测540 nm处的OD540值。
3)纤维素外切酶(微晶纤维素酶)活力测定。参照文献[9-11]并稍作修改。取0.5 mL稀释3倍后的酶液,加入1.0 mL、1%的微晶纤维素溶液(pH 4.8),以不加底物为对照,50 ℃反应60 min,加入3 mL DNS溶液,沸水浴5 min,再将试管置于冷水浴中,待试管冷却后,加入18 mL蒸馏水。以空白管做对照,采用分光光度计测540 nm处的OD540值。
4)β-葡萄糖苷酶活力测定。参照文献[12]并稍作修改。取0.5 mL稀释3倍后的酶液,加入1.0 mL、1%的水杨苷溶液(pH 4.8),以不加底物为对照,50 ℃反应30 min,加入3 mL DNS溶液,沸水浴5 min,再将试管置于冷水浴中,待试管冷却后,加入18 mL蒸馏水。以空白管做对照,采用分光光度计测540 nm处的OD540值。
5)FPA酶活力计算方法。酶活力定义:在pH 4.8、50 ℃条件下,每1 mL酶液在1 min内水解底物生成1 μg葡萄糖的酶量称作一个酶活力单位(U)。
纤维素酶活力=1 000Gn/(0.5t)
(1)
式中:G为所测得的OD540值在葡萄糖标准曲线上查出的还原糖质量浓度(mg/mL),n为酶液的稀释倍数,1 000为毫克换算成微克,0.5为反应酶液的体积(mL),t为酶和底物反应时间(min)。
1.2.4 菌株产纤维素酶的发酵条件优化
1)碳源对产酶的影响。在基础培养基的基础上,通过单因素实验,确定产纤维素酶的最佳碳源。分别以CMC-Na 10 g、葡萄糖5 g、玉米浆10 g、蔗糖5 g、甘油5 g、甲壳素5 g以及黄芪药渣粉10 g为碳源。生长好的种子液按照体积分数10%的接种量转接到发酵培养基中,30 ℃、150 r/min摇床培养5 d。发酵液在5 500 r/min下离心10 min,上清液即为粗酶液,测定其FPA。通过FPA确定最佳碳源。
2)氮源对产酶的影响。在确定最佳碳源的基础上,用不同的氮源代替发酵基础培养基中的(NH4)2SO4,选择的氮源有(NH4)2SO4、麸皮、蛋白胨、酵母膏和黄豆粉共5种氮源,将种子液以体积分数10%的接种量接种到发酵培养基中,30 ℃、150 r/min恒温振荡培养5 d。发酵液5 500 r/min离心10 min,得到的上清液即为粗酶液。通过测定FPA确定最佳氮源。
3)金属离子对放线菌产酶活性的影响。在碳氮源相同的情况下,选择7种金属离子进行筛选,研究对纤维素酶活力有影响的金属离子,见表1。
4)Plackett-Burman 实验设计和CCD中心组合设计。利用Minitab 15软件[13],实验中选用N=12的 PB 设计,把每个因素设计成高(+1) 和低(-1) 2 个水平。然后根据PB实验筛选出的对纤维素酶活具有显著影响的因素,采用CCD中心组合设计方法进行实验条件优化,建立回归方程并进行响应面分析。
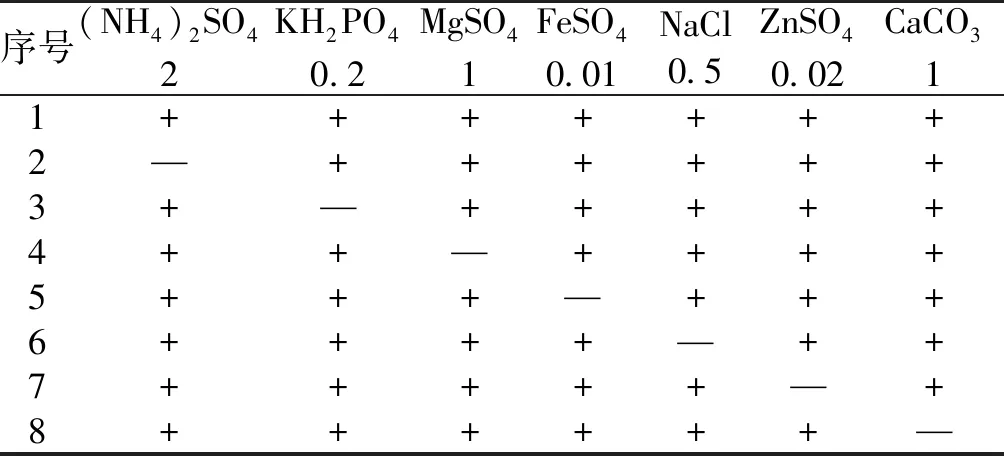
表1 对纤维素酶活力影响的7种金属离子
注:“+”表示含有该培养基成分;“—”表示未添加该培养基成分。
5)验证试验。根据PB和CCD实验建立的模型的最佳发酵条件进行验证实验,所有实验重复3次,测定FPA作为验证指标。
2 结果与讨论
2.1 碳源对产酶的影响
纤维素酶是一种诱导酶,因此纤维素既可以作为碳源来源,又可以作为主要诱导物。通过单因素实验筛选了7种不同的碳源进行发酵,结果见表2。
由表2可知,CMC-Na和葡萄糖作为碳源,产生的总酶活(FPA)最高可达43 U/mL以上。由于CMC-Na价格低于葡萄糖,且产生生物量大,综合考虑选择CMC-Na为碳源。
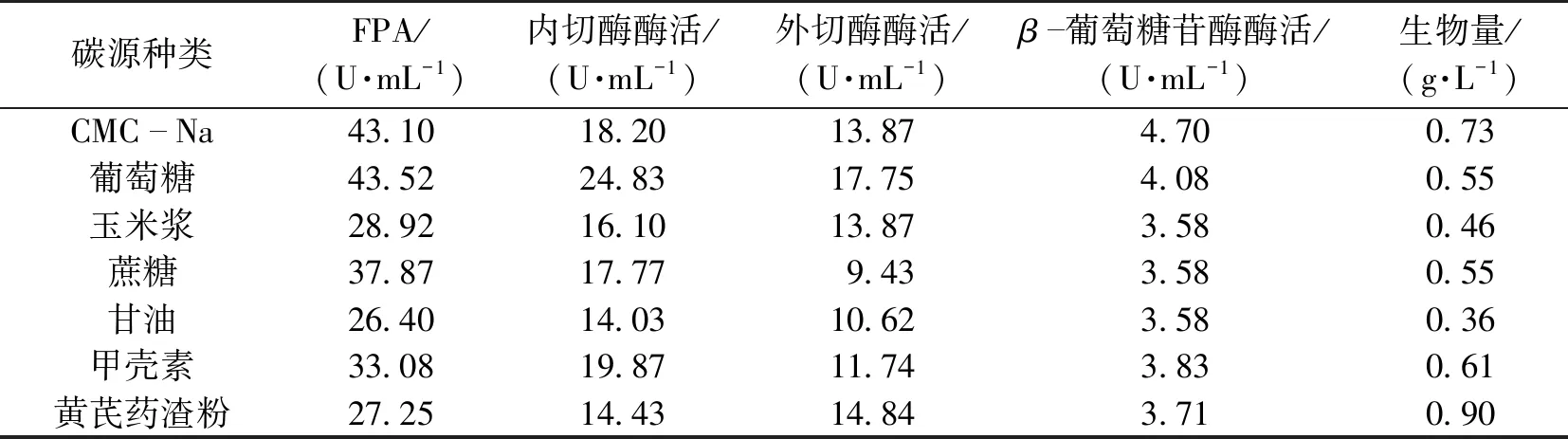
表2 碳源对产酶的影响
2.2 氮源对产酶的影响
在基础培养基基础上,通过单因素实验筛选5种类型的氮源进行发酵,测定不同氮源对产酶的影响,结果如表3所示。
由表3可以发现,以(NH4)2SO4组成的无机氮源发酵后产生的总酶活FPA最高,明显高于有机氮源的培养基。故选择(NH4)2SO4作为氮源。
2.3 金属离子对产酶的影响
通过单因素实验筛选不同类型的金属离子进行发酵试验,测定不同金属离子对产纤维素酶活力的影响,结果见表4。
由表4可知,Zn2+和Ca2+对产纤维素酶有抑制作用[16],而K+和Fe3+缺少会降低酶活。
2.4 PB实验设计筛选重要因素
运用PB实验设计的方法,快速筛选出培养基不同类型成分中对放线菌Streptomycessp.S10A09 产纤维素酶影响的显著因素,PB实验结果和主效应分析见表5和表6。
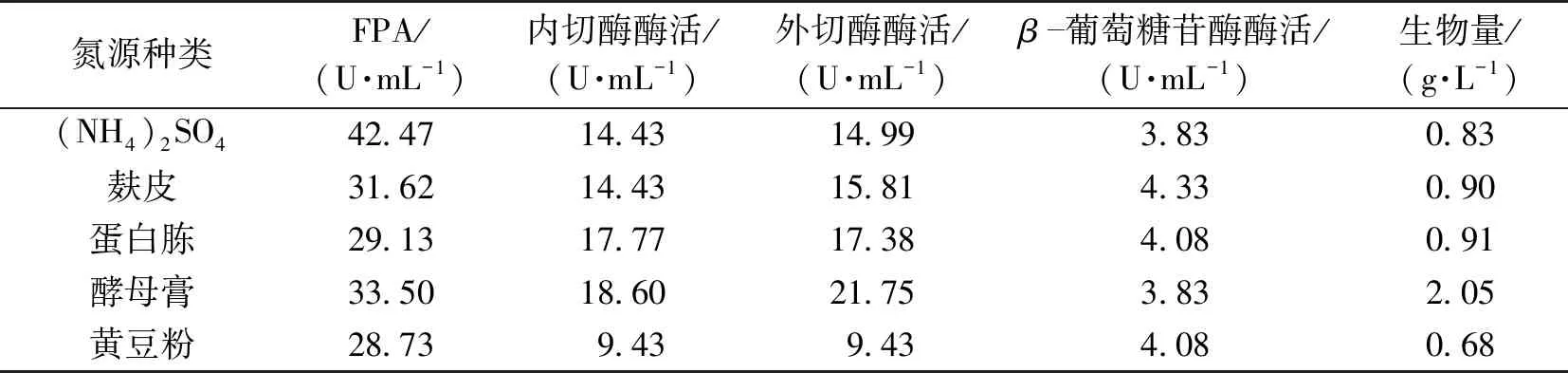
表3 氮源对产酶的影响
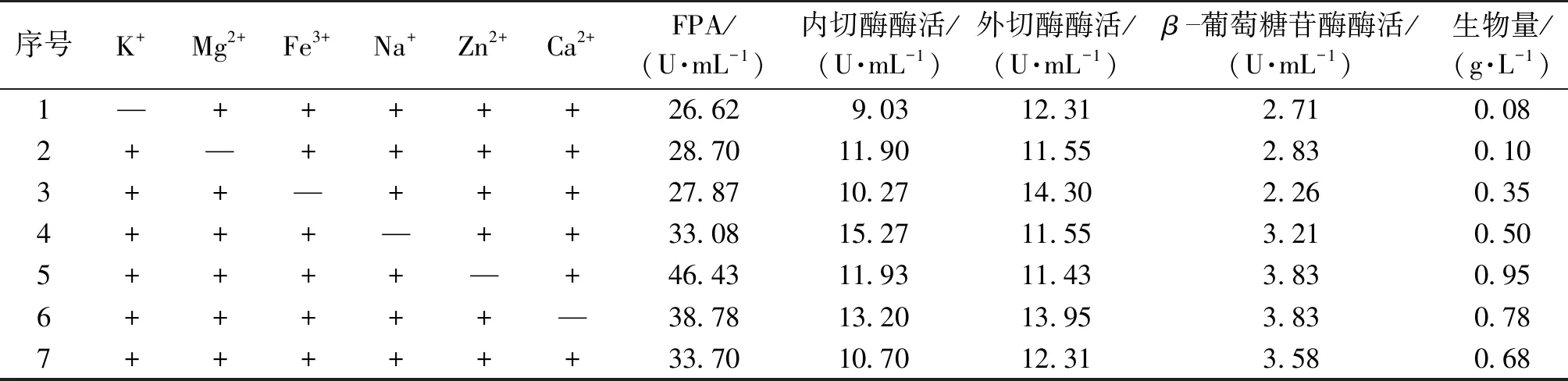
表4 金属离子对产酶的影响
注:+表示含有该培养基成分;—表示未添加该培养基成分。
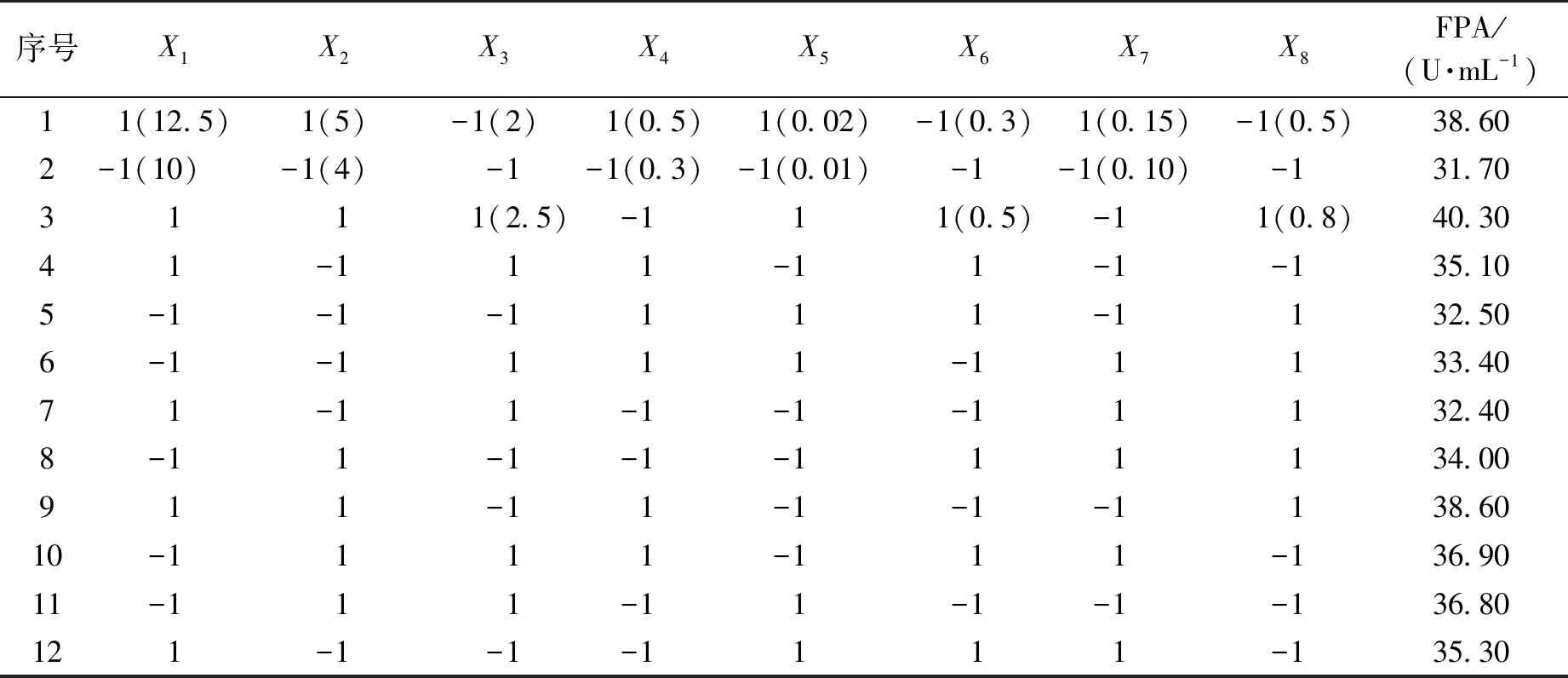
表5 Plackett-Burman试验结果
注:X1~X8分别代表CMC-Na、(NH4)2SO4、KH2PO4、FeSO4、NaCl、InSO4和CaCO3的质量浓度(g/L)。
由表5~6可知:影响Streptomycessp.S10A09产纤维素酶活的2个显著因素为X1和X2(P<0.05),即CMC-Na和(NH4)2SO4质量浓度。采用2因素3水平的CCD试验寻找产酶条件的最佳组合。R2=95.41%,R2(调整)=83.18%,说明PB实验拟合度较高。
2.5 中心组合试验
2.5.1 CCD中心组合试验
根据PB设计实验筛选出对纤维素酶活具有显著影响的因素,采用中心组合设计方法进行实验条件的优化,实验平行3次,结果取平均值。实验设计和数据分析使用软件Minitab 15.0。中心组合实验变量水平及结果如表7所示。
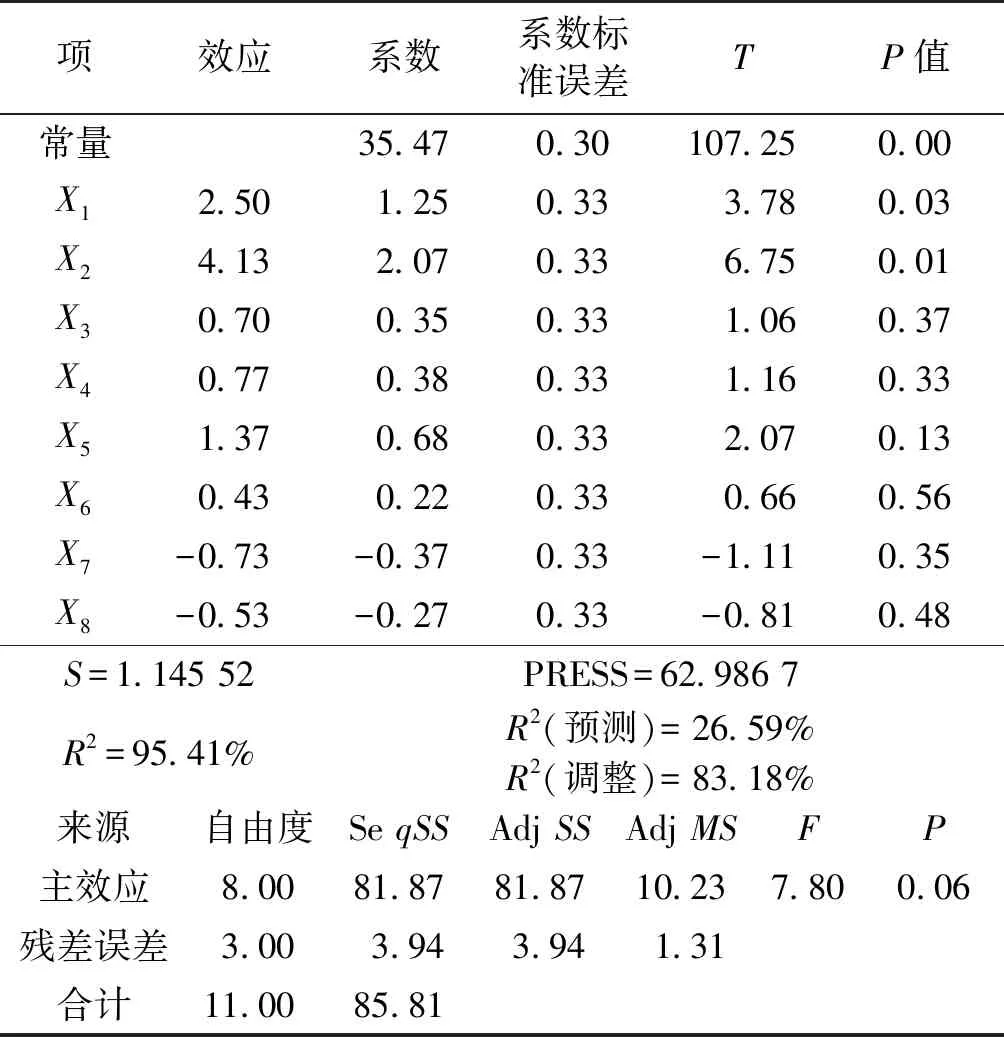
表6 Plackett-Burman试验因素水平及其主效应分析
注:T为检验统计量;P值为检验P值,若P值小于5%,驳回归属假设。
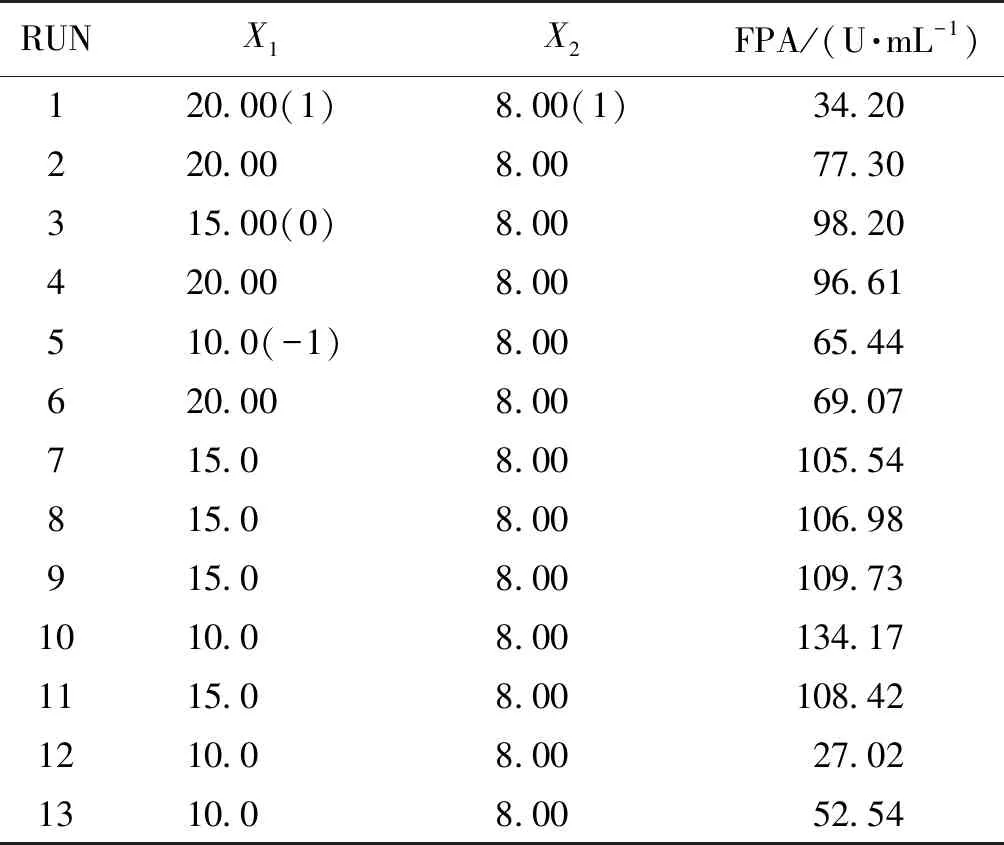
表7 中心组合试验变量水平及结果
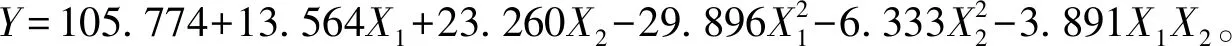
由表9可以看出,回归的整体、一次项、二次项P值均小于0.05,说明都显著有效;而交叉乘积项则不显著。失拟(Lack-of-Fit)值为0.10(大于0.05),表示二次多项式回归模型正确。R2=97.33%,说明二次多项式回归效果非常好。

表8 滤纸酶活的估计回归系数
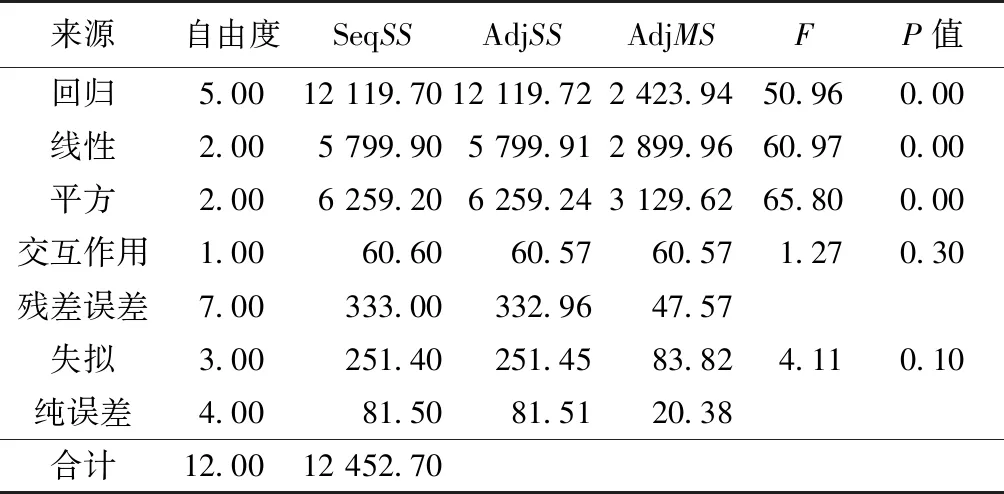
表9 滤纸酶活的方差分析
图1和2为依据回归方程绘出的响应面图。响应面代表着两个独立变量之间的相互作用。
由图1和2可见:CMC-Na(X1)对滤纸酶FPA活力的影响极其显著,表现为较陡的曲面;(NH4)2SO4(X2)对FPA活力影响较小,曲面较平滑。
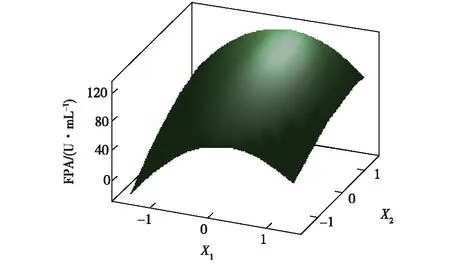
图1 滤纸酶响应面图Fig.1 Response surface figure of filter paper activity
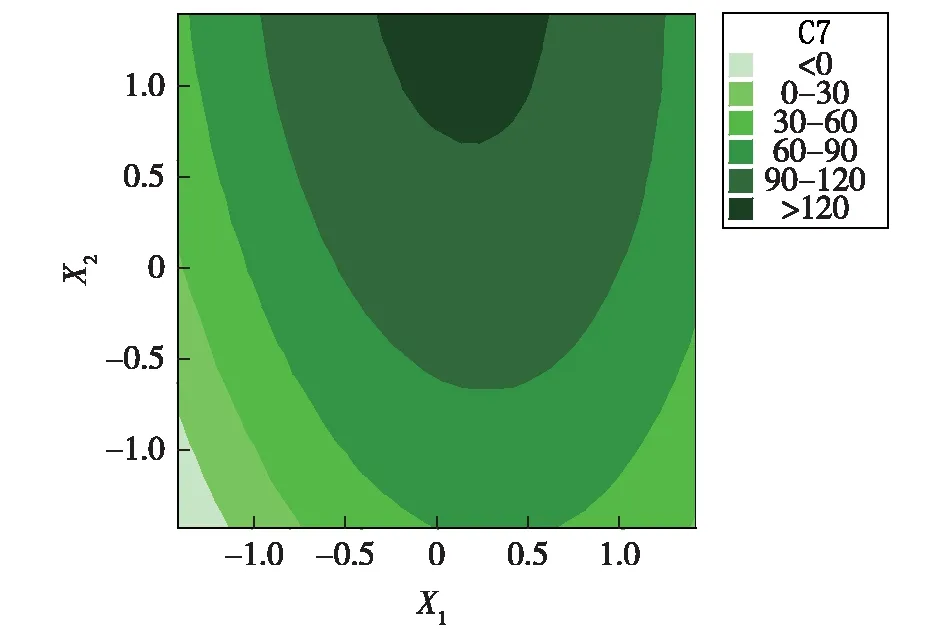
图2 滤纸酶响应面图及等高线图Fig.2 Response surface figure and contour map of filter paper activity
2.5.2 优化结果验证
根据模型预测,产酶最优条件为:X1=0.128 565(2.57 g/ L),X2=1.414 210(11.31 g/L),此时,预测的FPA最大响应值为126.54 U/mL。为了进一步确证模型预测的准确性,在优化的理论最佳条件下进行验证试验,所得FPA为125.96 U/mL,可见该模型能较好地预测实际发酵情况。且Strptomycessp.S10A09 产纤维素酶FPA接近优化前的3倍,高于已报道的Streptomycesruber、Streptomycesnoboritoensis等菌产纤维素酶的活性[14-16]。
3 结论
利用PB单因素、中心组合设计与响应面结合的方法,借助Minitab软件分析,对放线菌Strptomycessp.S10A09 产纤维素酶的发酵条件进行研究并得到优化结果,最终确定Strptomycessp.S10A09液体发酵产生纤维素酶的最优发酵培养基(g/L)为CMC-Na 2.57、(NH4)2SO411.31、KH2PO40.2、MgSO41、FeSO40.01。优化后,FPA达到125.96 U/mL,接近优化前的3倍。Strptomycessp.S10A09具有培养基简单、可利用无机氮源以及活性较高等特点,有利于工业化应用。在进一步研究中,将对其纤维素酶蛋白进行纯化,为进一步应用奠定基础。

