盐单胞菌S62 β-半乳糖苷酶合成低聚半乳糖的研究
朱五二,缪明永,顾正华,李由然,丁重阳,石贵阳
(1. 江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡214122; 2. 江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122; 3. 第二军医大学生物化学与分子生物学教研室,上海200433)
β-半乳糖苷酶(EC 3.2.1.23)俗称乳糖酶(lactase),属于糖基水解酶类(glycosyl hydrolases),可以水解β-1,4-糖苷键,同时还具有半乳糖苷转移酶活性[1],用于功能性食品低聚半乳糖(GOS)的合成。β-半乳糖苷酶广泛存在于微生物(细菌、真菌和酵母)、植物(尤其是杏仁、桃、杏和苹果)和动物器官中[2-4]。微生物酶具有较高的生产力,能降低生产成本。目前已有古细菌、细菌、真菌和酵母的β-半乳糖苷酶研究报道[5],从真菌(米曲霉和黑曲霉)和酵母(乳酸克鲁维酵母和脆弱克鲁维酵母)获得的酶显示出巨大的商业潜力,来自乳酸克鲁维酵母的β-半乳糖苷酶是使用最广泛的酶之一[6-9]。
低聚半乳糖是以乳糖作为供体和受体底物,利用β-半乳糖苷酶的转糖基化活性产生的具有高达9聚合度(DP)的寡糖混合物[9],主要结构由葡萄糖末端连接可变数目的半乳糖单元组成,半乳糖单元的数目通常为2~5[10],半乳糖单元通过β(1→3),β(1→6)和β(1→4)键连接,而半乳糖-葡萄糖键在大多数情况下是β(1→4)[11]。不同来源的酶合成低聚半乳糖是有差异的,其中低聚半乳糖主要包含三糖、四糖、五糖,以及异乳糖和半乳二糖[12]。
低聚半乳糖是一种调节结肠微生物菌群的益生元,具有改善矿物质吸收和预防结肠癌的功效[13]。研究表明,低聚半乳糖大大增加了双歧杆菌的数量及其在肠道中的代谢活性[14-16],可降低过敏发生率[17-18]和病原体的黏附[15,18-19],并且能介导肠道免疫系统。此外,低聚半乳糖有效治疗代谢性疾病[20]。因此,低聚半乳糖广泛应用在饮料和婴儿奶粉的配方中[21]。
我国目前仍存在β-半乳糖苷酶产量低的问题,从而限制了β-半乳糖苷酶在工业中的应用。如何寻找一种高产、高酶活的β-半乳糖苷酶仍是国内研究的难点。缪明永课题组的Wang等[22]对中国东海海水和海泥来源的海洋微生物进行筛选,获得了1株产S62β-半乳糖苷酶的盐单胞菌S62(Halomonassp. S62),并对其低温β-半乳糖苷酶基因(GenBank登录号JQ337961)进行了重组表达研究。
在以上基础上,笔者对S62β-半乳糖苷酶合成低聚半乳糖的反应条件进行探索,以获得最大低聚半乳糖产率,以期为利用低温β-半乳糖苷酶进行工业生产低聚半乳糖提供重要的理论依据。
1 材料与方法
1.1 试剂与仪器
一水合乳糖、葡萄糖、半乳糖,国药集团化学试剂有限公司;乙腈,TEDIA公司。
电热恒温水浴锅,上海医用恒温设备厂;超高效液相色谱串联四级杆飞行时间质谱仪(UPLC-Q-TOF-MS)、高效液相色谱仪(HPLC),美国Waters公司。
1.2 低聚半乳糖的检测
1.2.1 低聚半乳糖种类检测
采用 Waters Acquity BEH Amide柱(2.1 mm × 100 mm,1.7 μm)分离,质谱检测器,时间为20 min。流动相A相:80%乙腈加0.1%氨水;B相:30%乙腈加0.1%氨水。柱温45 ℃,流速0.3 mL/min,进样量1 μL。线性梯度洗脱程序见表1。
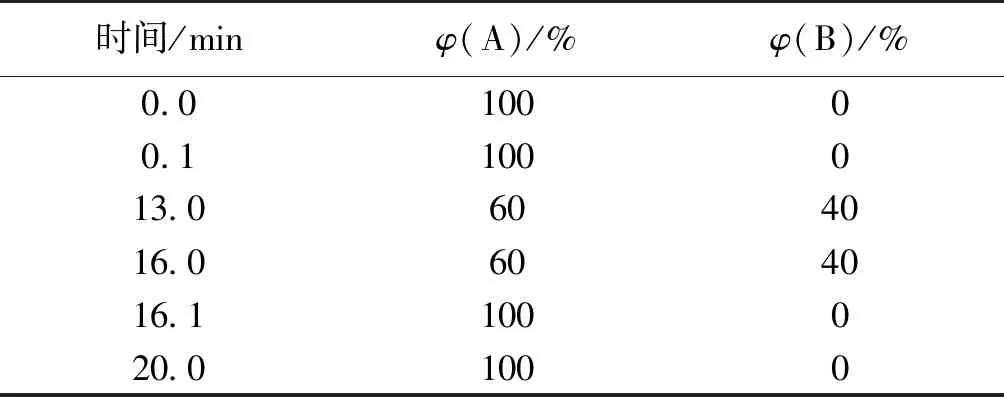
表1 LC-MS洗脱条件
注:质谱离子化方式为负离子(ESI-),毛细管电压为3.5 kV,锥孔电压为20 V,脱溶剂气温度为400 ℃,脱溶剂气流速为700 L/h,碰撞能量为6 eV,质量范围为10~1 000,检测电压为1 800 V。二级质谱碰撞能量为6 eV,锥孔电压为50 V,选择离子质荷比为341、503、665。
1.2.2 低聚半乳糖含量的检测
实验采用双柱法检测[23-24],并计算低聚半乳糖含量。
葡萄糖和半乳糖检测:用伯乐公司的Aminex HPX-87C柱(300 mm×7.8 mm,9 μm)测出葡萄糖和半乳糖含量,流动相为纯水,检测器为示差检测器,流速为0.6 mL/min,柱温为50 ℃,检测器灵敏度为8,检测器温度为30 ℃,进样量为20 μL。
乳糖检测:使用Waters公司的Amide柱(4.6 mm × 250 mm,5 μm)测出乳糖含量,流动相为70%乙腈,检测器为示差检测器,流速为1.0 mL/min,柱温为40 ℃,检测器灵敏度为8,检测器温度为30 ℃,进样量为20 μL。
低聚半乳糖质量分数计算见式(1)。
w(GOS)=w(Lac)-w1(Gal)-w1(Glu)-
w(H+)-w1(Lac)
(1)
式中:w1(Gal)=w(Gal)×(180-17)/180;
w1(Glu)=w(Glu)×(180-1)/180;
w(H+)=[n(Glu)-n(Gal)]×1。
w(Gal)、w(Glu)、w(Lac)、w1(Lac)分别为水解半乳糖质量分数、水解葡萄糖质量分数、初始乳糖质量分数、反应后乳糖质量分数;n(Glu)、n(Gal)分别为葡萄糖和半乳糖的摩尔数。
乳糖消耗率和低聚半乳糖产率的计算见式(2)和(3)。
乳糖消耗率=w1(Lac)/w(Lac)×100%
(2)
低聚半乳糖产率=w(GOS)/w(Lac)×100%
(3)
1.3 单因素条件优化
1.3.1 pH对低聚半乳糖合成的研究
用磷酸缓冲液配制pH为6.0~8.0的乳糖溶液,质量浓度为250 g/L,用纯水配制酶液600 U/mL,取1.9 mL乳糖溶液加入0.1 mL酶,在30 ℃下反应6 h。计算出低聚半乳糖产率及乳糖消耗率。
1.3.2 底物浓度对低聚半乳糖合成的研究
采用单一变量法控制反应,底物质量浓度为150~350 g/L,pH为7.0,其他条件如1.3.1节所述。计算出低聚半乳糖产率及乳糖消耗率。
1.3.3 温度对低聚半乳糖合成的研究
采用单一变量法控制反应,反应温度为25~45 ℃,pH为7.0,其他条件如1.3.1节所述。计算出低聚半乳糖产率及乳糖消耗率。
1.3.4 反应时间对低聚半乳糖合成的研究
采用单一变量法控制反应,反应时间为4~12 h,pH为7.0,其他条件如1.3.1节所述。计算出低聚半乳糖产率及乳糖消耗率。
1.3.5 加酶量对低聚半乳糖合成的研究
采用单一变量法控制反应,加酶量为15~75 U/mL,pH为7.0,其他条件如1.3.1节所述,计算出低聚半乳糖产率及乳糖消耗率。
1.4 低聚半乳糖合成正交试验
在前期的基础上,控制反应时间为4 h,以温度、底物浓度、pH、加酶量为考察因素,以低聚半乳糖含量为指标,进行L9(34)的正交试验。
1.5 最适条件低聚半乳糖合成及酶稳定性
在正交最适条件下进行反应8 h,定时取样,使用HPLC测糖组分,并测定40 ℃下酶的稳定性。
2 结果与讨论
2.1 低聚半乳糖种类鉴定
通过液相色谱-质谱(LC-MS)鉴定S62β-半乳糖苷酶合成低聚糖的种类,结果如图1所示。
由图1可知:出峰时间8.71、9.17和9.72 min为3种二糖,其质谱图依次为b、c、d,分别为乳糖、异乳糖和半乳二糖;出峰时间11.30和12.25 min为2种低聚半乳三糖,质谱图为e、f;出峰时间13.51和14.23 min为2种低聚半乳四糖,质谱图为g、h。此前,Rodriguez-Colinas等[25]鉴定了来自乳酸克鲁维酵母的β-半乳糖苷酶产生的低聚半乳糖混合物中的5种低聚半乳糖。Urrutia等[26]从米曲霉的β-半乳糖苷酶产生的低聚半乳糖混合物中发现了9个种类。Yanahira等[27]从环状芽孢杆菌的β-半乳糖苷酶产物中分离出11种低聚半乳糖。S62β-半乳糖苷酶以乳糖为底物合成了6种低聚半乳糖,可以看出S62β-半乳糖苷酶同样具有较高的转糖基酶活。

(a)—选择离子色谱图;(b)、(c)、(d)—二糖质谱图;(e)、(f)—三糖质谱图;(g)、(h)—四糖质谱图图1 低聚半乳糖种类分析Fig.1 Analysis of types of GOS
2.2 pH对低聚半乳糖合成的影响
Torres等[5]总结了细菌β-半乳糖苷酶转糖基反应最适pH为6.0~8.0。以磷酸盐缓冲液控制反应体系pH,考察pH对低聚半乳糖合成的影响,结果如图2所示。
由图2可知:S62β-半乳糖苷酶在pH 6.0~8.0稳定性较好,表现出较好的转糖基作用,低聚半乳糖产率为26%~30%,乳糖转化率为69%~75%,其中在pH为7.0时,有最大低聚半乳糖产率(29.46±0.66)%,乳糖消耗率为(73.40±0.85)%。因此,在此反应体系中,最适pH为7.0。
2.3 底物浓度对低聚半乳糖合成的影响
在乳糖存在时,β-半乳糖苷酶存在着水解活性与转糖基化活性相互竞争现象,即当反应开始时,乳糖浓度较高,转糖基作用占主导作用,但是随着反应进行,水解活性逐渐增强,最终生成葡萄糖和半乳糖[28]。由此可见高浓度的乳糖有利于低聚半乳糖的合成。因此,选择150~350 g/L的乳糖,研究其对低聚半乳糖合成的影响,结果如图3所示。
由图3可知:当乳糖质量浓度大于200 g/L时,乳糖转化率随着底物浓度的增加逐渐降低,其原因主要是在一定的反应时间内,底物过饱和,酶结合底物能力有限,进而转化率下降;而底物质量浓度为150 g/L时,底物浓度降低,酶水解活性增强,导致乳糖和低聚半乳糖被降解为葡萄糖和半乳糖。所以当酶量为30 U/mL,反应时间为6 h,底物质量浓度为200 g/L,其低聚半乳糖产率为(26.57±0.36)%,乳糖消耗率最高为(67.40±0.55)%。
2.4 温度对低聚半乳糖合成的影响
低温酶在低温条件下通常保留着较高的酶活。Fan等[29]等研究了来自Rahnellasp. R3的低温β-半乳糖苷酶,以乳糖为底物,在4~35 ℃的宽温度范围内显示高活性;Coker[30]报道了AntarcticArthrobacterβ-半乳糖苷酶以乳糖为底物时最适为15~20 ℃。笔者研究了温度对低聚半乳糖合成的影响,结果如图4所示。
由图4可知:乳糖存在时,S62β-半乳糖苷酶同样在25~45 ℃时,表现出较高的酶活,最适转糖基化温度为40 ℃,此时低聚半乳糖产率为(36.15±0.01)%,乳糖消耗率为(82.45±0.01)%。温度过高时,S62β-半乳糖苷酶在较短的时间内失活,导致温度为45 ℃时的酶活比40 ℃时的酶活下降明显。
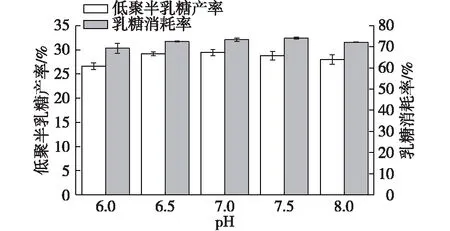
图2 pH对低聚半乳糖合成的影响Fig.2 Effects of pH on GOS synthesis
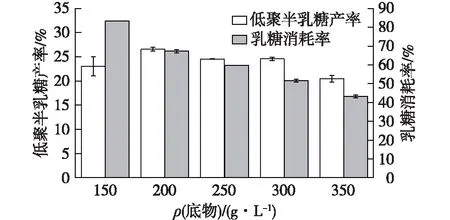
图3 乳糖浓度对低聚半乳糖合成的影响Fig.3 Effects of lactose concentration on GOS synthesis
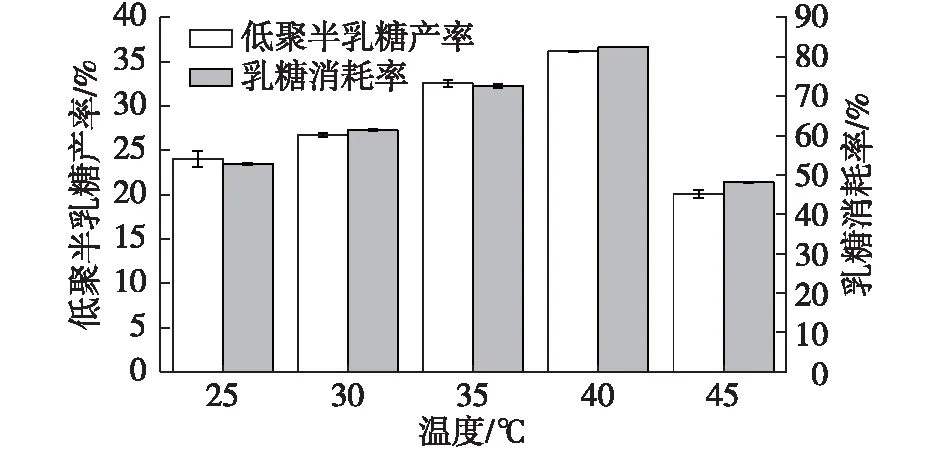
图4 温度对低聚半乳糖合成的影响Fig.4 Effects of temperature on GOS synthesis
2.5 加酶量对低聚半乳糖合成的影响
在酶催化过程中为了保证底物高效利用以及产物高得率,酶用量适当是关键因素。S62β-半乳糖苷酶加酶量的实验结果如图5所示。
由图5可知:当加酶量为15 U/mL时,加酶量低,转化效率不高,乳糖消耗率和低聚半乳糖产率都最低;当加酶量为75 U/mL时,加酶量高,在6 h内反应速度过快,乳糖消耗率最高,但低聚半乳糖产率降低,此时低聚半乳糖更多的被降解。所以在此反应体系中,S62β-半乳糖苷酶最适加酶量为60 U/mL,此时乳糖消耗率为(82.51±0.79)%,GOS转化率为(33.88±0.01)%。
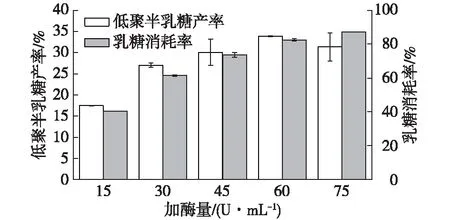
图5 加酶量对低聚半乳糖合成的影响Fig.5 Effects of enzyme amount on GOS synthesis
2.6 反应时间对低聚半乳糖合成的影响
β-半乳糖苷酶反应工艺中要求的是高效高产低耗,所以反应时间的控制有利于提高工艺效率。S62β-半乳糖苷酶的反应时间对合成的影响结果如图6所示。
由图6可知:乳糖消耗率随着反应时间的增加而增加,但低聚半乳糖产率先增加后降低,在反应时间为10 h时,低聚半乳糖产率达到最大值,为(33.1±0.32)%,乳糖消耗率为(77.87±0.28)%。

图6 反应时间对低聚糖合成的影响Fig.6 Effects of time on the GOS synthesis
2.7 低聚半乳糖合成正交试验
在以上的单因素条件基础上,设定反应时间为4 h,以底物浓度、反应温度、加酶量、pH为考察对象,设计正交试验表如表2所示,试验结果和结果分析如表3和表4所示。

表2 正交试验设计表

表3 正交试验结果表

表4 结果分析表
由表2~4可知:最适反应条件为反应温度40 ℃、底物质量浓度300 g/L、反应pH 7.0、加酶量50 U/mL,得到最高低聚半乳糖产率为(37.87±0.11)%,此时乳糖消耗率为(75.90±0.43)%。不同因素对低聚半乳糖产率的影响顺序从大到小依次为底物浓度、加酶量、pH、温度。
2.8 低聚半乳糖合成最适条件
在上述正交试验结果的最优反应体系下,每隔1 h取样1次,结果如图7所示。
由图7可知:低聚半乳糖产率和乳糖降解率随着反应时间的延长而增加,在4~8 h内,低聚半乳糖产率都维持在40%,在反应6 h时可获得最大低聚半乳糖产率(41.91±0.27)%,乳糖消耗率为(82.47±0.38)%。
目前,大部分β-半乳糖苷酶用于合成低聚半乳糖时,乳糖的高效利用率和低聚半乳糖高产率无法兼得。Aburto等[11]对米曲霉β-半乳糖苷酶进行了研究,在其最优反应体系中,低聚半乳糖产率为40%,40.3%的乳糖发生转化,但其乳糖利用率不高。Geiger等[31]报道了嗜热链球菌β-半乳糖苷酶在37 ℃、80%乳糖转化时,低聚半乳糖产率达到总糖含量的34.2%;在94%~95%的乳糖转化率下,低聚半乳糖产率降低至30%,乳糖利用率高,但低聚半乳糖产率低。Vasiljevic等[32]报道了保加利亚乳杆菌的β-半乳糖苷酶以质量分数30%的乳糖为底物,在50 ℃下获得最佳的低聚半乳糖产量,为20%。而本研究中的S62β-半乳糖苷酶在乳糖转化率接近90%时,反应4~6 h时,低聚半乳糖产率始终可保持40%以上,所以S62β-半乳糖苷酶可以在较长的时间内维持高低聚半乳糖产量。
对40 ℃下S62β-半乳糖苷酶剩余酶活进行检测,8 h时酶活仅剩60%左右。由于S62β-半乳糖苷酶属于低温酶,温度高时,酶的半衰期短,后期酶活降低,减慢了低聚半乳糖的水解,这也可能是低聚半乳糖产率在长时间内维持在40%以上的原因之一。
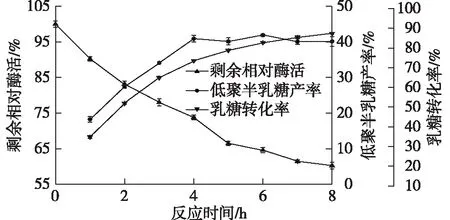
图7 最适条件反应结果及剩余酶活变化Fig.7 Optimum reaction conditions and the remaining changes of enzyme activity
3 结论
笔者对S62β-半乳糖苷酶产低聚半乳糖工艺进行了研究,反应体系为1.9 mL反应液,0.1 mL酶液,得到最适产低聚半乳糖条件如下:反应温度40 ℃、底物质量浓度300 g/L、反应pH 7.0、加酶量50 U/mL,反应6 h时可获得最大低聚半乳糖产率(41.91±0.27)%,此时乳糖消耗率为(82.47±0.38)%。反应4~8 h内,低聚半乳糖产率均维持在40%以上。而在本实验中,当乳糖转化率接近90%时,低聚半乳糖产率仍可维持在40%左右,即乳糖转化率与低聚半乳糖产率均可维持在较高水平,不仅获得了高附加值的产物,也在一定程度上提高了原料的利用率,这可为后续的S62β-半乳糖苷酶工艺应用提供技术参考,同时也有利于低聚半乳糖的工业化生产。

