D-泛解酸内酯水解酶的固定化及酶学性质
王开放,张 梁,辛 瑜,曾 伟,丁重阳,石贵阳
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122; 2.江南大学生物工程学院,江苏无锡214122; 3.大连韦德生化科技有限公司,辽宁大连116000)
D-泛解酸内酯被认为是生产D-泛酸的重要中间体,广泛用作食品和饲料添加剂[1]。D-泛解酸内酯水解酶作为酶源代替昂贵和有毒的化学拆分剂来处理DL-泛解酸内酯,成本较低且对环境无污染[2],但是游离酶难以回收和重复利用,不利于工业生产的稳定和连续化,对该酶进行固定化研究成为大规模生产研究的热点[3-4]。例如Sakamoto等[5-6]利用固定化细胞技术对特定菌株进行固定化,选择性水解DL-泛解酸内酯中的D-构型,将水解产物D-泛解酸分离出来,再经过内酯化转变成D-泛解酸内酯,此方法已由日本第一制药(FUJI)公司申请了专利,并投入工业化生产;汤一新等[7-9]利用海藻酸钠法和戊二醛交联固定化霉菌法对1株产D-泛解酸内酯水解酶的菌株FusariummoniliformeSW902进行固定化,成功应用于工业化生产;Yu等[10]利用海藻酸钙对镰孢霉菌属的Fusariumsp. BU-011进行固定化;黎明课题组[11-12]对腐皮镰孢菌酶(Fusariumproliferatumvar.proliferatumAS3.4783)破碎后,用大孔吸附树脂D380对破碎液进行了固定化研究,固定化酶活达到4 U/g树脂。然而目前所报道的对D-泛解酸内酯水解酶的固定化研究是以野生菌为出发菌株进行的,野生菌酶产量低,对酶的固定化造成了一定的困难[13]。
本研究中,笔者以前期构建的重组乳酸克鲁维酵母(KluyveromyceslactisGG799/pZL505-DL)所产的D-泛解酸内酯水解酶为酶源,进行固定化方面的研究,以期为工业化应用奠定基础。
1 材料与方法
1.1 材料与仪器
D-泛解酸内酯水解酶基因来源于串珠镰孢菌Fusariumverticillioides(GenBank:AY728018.1),重组乳酸克鲁维酵母(KluyveromyceslactisGG799/pZL505-DL),笔者所在课题组成员前期构建;DL-泛解酸内酯,安徽酷尔生物工程有限公司;D-泛解酸内酯,美国Sigma公司;其他试剂均为市售国产分析纯。
高效液相色谱仪(chromaster),日本日立公司;HYL-C型组合式摇床,太仓市实验设备厂;DKZ-450B型电热恒温振荡水槽,上海森信试验仪器有限公司;AL104型分析天平,瑞士梅特勒-托利多公司。
1.2 实验方法
1.2.1 固定化载体的筛选
选择树脂D301、树脂D315、树脂D380、琼脂糖颗粒和杂化纳米花hybrid nanoflowers (hNFs),对D-泛解酸内酯水解酶的固定化效果进行初筛,确定最佳的固定化载体。
1.2.2 固定化方法的确定
取适量经过处理的树脂放入50 mL锥形瓶中,每种树脂每瓶添加1 g,各设3个平行,放入总酶活为12 U的酶液,然后置于摇床中,30 ℃、200 r/min 吸附3 h,在4 ℃预冷,再加入适宜浓度的戊二醛,交联1 h,最后用去离子水反复冲洗除去游离酶。
琼脂糖颗粒固定化参照文献[14]。
hNFs的固定化参照文献[15]。
1.2.3 酶学性质研究
酶活定义:在一定条件下,每分钟水解1 μmol D-泛解酸内酯所需要的酶量定义为1个酶活力单位(U)。
D-泛解酸内酯的HPLC测定方法:将反应后样品12 000 r/min离心30 min,取200 μL于内衬管中。色谱柱为ZORBAX SB-C18,4.6 mm×250 mm×3.5 μm,流速0.5 mL/min,紫外检测波长为215 nm,柱温25 ℃,流动相组成为V(乙腈)∶V(KH2PO4(0.02 mol/L)=1∶ 19,用稀盐酸调pH至3.0,进样量10 μL。
游离酶和固定化酶最适反应温度的测定:以质量分数4%D-泛解酸内酯水溶液为底物,以pH 7.5的2 mol/L Tris-HCl为缓冲液,将底物和缓冲液在各个温度条件下预热5 min后加入适量酶液,反应一定时间后,进行酶活测定,以灭活的酶作为空白对照。
固定化酶和游离酶的温度耐受性测定:以质量分数4%D-泛解酸内酯水溶液为底物,以pH 7.5的2 mol/L Tris-HCl为缓冲液,取固定化酶和游离酶,并在各个温度条件下放置30 min, 之后将各个温度处理过的游离酶和固定化酶取出适量,以未处理的游离酶作为对照,反应一定时间,测定剩余酶活力。
固定化酶和游离酶的最适pH测定:以质量分数 4%D-泛解酸内酯水溶液为底物,取适量酶液,在不同pH条件下反应一定时间后,进行酶活测定。
固定化酶和游离酶的pH耐受性:将固定化酶和游离酶在不同的pH缓冲液保温1 h后测定其剩余酶活力。
1.2.4 固定化酶填充床反应
为探究固定化酶的高浓度底物水解效果和测定拆分产物的光学纯度,自制填充床反应器。拆分产物D-泛解酸内酯的提取方法:将经填充床反应的高浓度底物用相同体积的乙酸乙酯萃取,有机相萃取未参加反应的L-泛解酸内酯和剩余的D-泛解酸内酯,待分层后,有机相用旋转蒸发仪获得DL-泛解酸内酯,水相加盐酸调pH至1.0,静置12 h,再次用乙酸乙酯萃取,蒸干有机相获得结晶,即D-泛解酸内酯粗品。取适量结晶,溶于水后用全自动旋光仪测定旋光度。
2 结果与讨论
2.1 酶的固定化
2.1.1 固定化载体的确定
利用树脂D301、树脂D315、树脂D380、琼脂糖颗粒和hNFs进行D-泛解酸内酯水解酶的固定化预试验,结果如表1所示。
由表1可知:在弱碱性阴离子树脂中只有D380固定化酶检测到酶活,推测该树脂的功能基团和骨架结构有利于该酶的固定化;hNFs法不适用于该酶的固定化;用琼脂糖颗粒进行酶的固定化,由于其固定化方法的复杂,成本较高,且酶活回收率和比酶活均低于树脂D380。因此本实验中,笔者选用D380作为固定化载体,进行固定化研究。
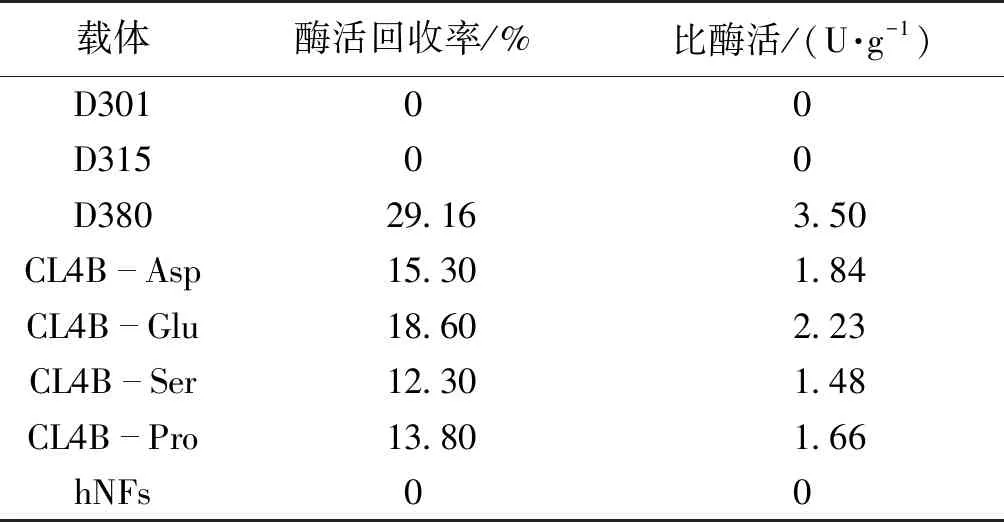
表1 载体对固定化酶活力的影响
2.1.2 固定化加酶量的选择
取1 g预处理的湿树脂于50 mL锥形瓶中,放入酶量分别为9、12、15、20、30、50、80、160、200和300 U/g的树脂,吸附时间为3 h,吸附温度为30 ℃,吸附酶液的pH为7.0,戊二醛终体积分数为0.2%,交联时间为1 h,结果如图1所示。
由图1可知:随着酶量的增加,固定化的比酶活逐渐增加。可能由于随着酶量的增加,酶分子与树脂功能基团上结合的概率越来越大,到约30 U/g树脂时,吸附达到饱和,此时固定化比酶活为(8.60±0.16) U/g,高于此加酶量,固定化酶的比酶活增加不明显,所以选择的加酶量为30 U/g树脂。
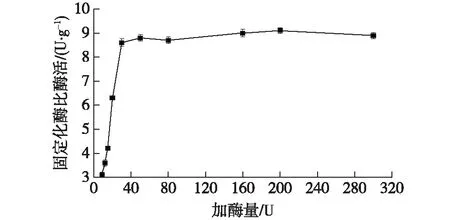
图1 加酶量对固定化效果的影响Fig.1 Effect of enzyme addition on immobilization
2.1.3 固定化pH的选择
取预处理的湿树脂于50 mL锥形瓶中,每瓶放入1 g湿树脂,将酶液的pH分别调为6.5、7.0、7.5、8.0和8.5,加酶量为30 U/g树脂,吸附时间为3 h,吸附温度为30 ℃,戊二醛终体积分数为0.2%,交联时间为1 h,结果如图2所示。
由图2可知:在pH为7.5时,固定化效果最好,所以选择的固定化pH为7.5,其固定化比酶活为(9.60±0.21) U/g。D380是阴离子交换树脂,pH只有大于蛋白的等电点,才能更好地发挥与载体之间的吸附交联作用,但pH过大则会影响酶的催化效果。
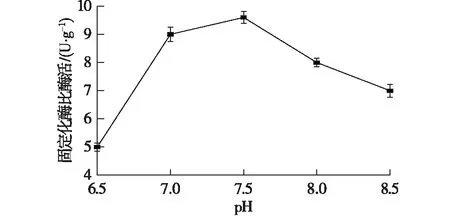
图2 pH对固定化效果的影响Fig.2 Effect of pH on immobilization
2.1.4 固定化吸附时间的选择
取预处理的湿树脂于50 mL锥形瓶中,每瓶放入1 g湿树脂,吸附时间分别设为1、2、3、4、5、7 和9 h,吸附pH为7.5,选择的加酶量为30 U/g树脂,吸附温度为30 ℃,戊二醛终体积分数为0.2%,交联时间为1 h,结果如图3所示。
由图3可知:最佳的吸附时间为5 h,比酶活为(10.9±0.16) U/g;时间超过5 h,固定化效果出现下降的趋势,推测是由于长时间的振摇导致酶部分失活。
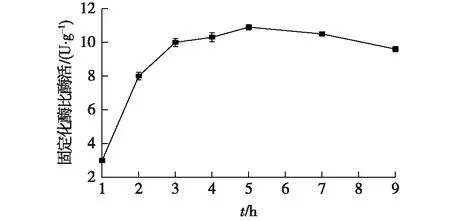
图3 吸附时间对固定化效果的影响Fig.3 Effect of adsorption time on immobilization
2.1.5 固定化吸附温度的选择
取预处理的湿树脂于50 mL锥形瓶中,每瓶放入1 g湿树脂,吸附温度分别为10、15、25、30、35、40和45 ℃,吸附时间为5 h,吸附pH为7.5,选择的加酶量为30 U/g树脂,戊二醛终体积分数为0.2%,交联时间为1 h,结果如图4所示。
由图4可知:在10~30 ℃时,随温度的升高固定化效果越好,30 ℃固定化酶的比酶活最高,为(11.2±0.14) U/g,可能是由于温度升高,分子运动加剧,加快了酶分子与载体之间的相互作用;高于此温度时,固定化效果下降趋势明显,推测该酶在较高温度下酶活力下降较快,因此选择最佳的吸附温度为30 ℃。

图4 吸附温度对固定化效果的影响Fig.4 Effect of adsorption temperature on immobilization
2.1.6 戊二醛体积分数对固定化效果的影响
取预处理的湿树脂于50 mL锥形瓶中,每瓶放入1 g湿树脂,交联的戊二醛体积分数分别设定为0.05%、0.1%、0.15%、0.2%、0.3%和0.4%,吸附温度为30 ℃,吸附时间为5 h,吸附pH为7.5,选择的加酶量为30 U/g树脂,交联时间为1 h,结果如图5所示。
由图5可知:戊二醛体积分数高于0.1%时,固定化酶的比酶活变化不大,且比酶活已达到最高,为(11.3±0.32) U/g,戊二醛浓度较低时,只有少量的酶蛋白与载体交联,且与载体结合不牢固,过高的戊二醛浓度也会使酶失活,所以选择戊二醛体积分数为0.1%。
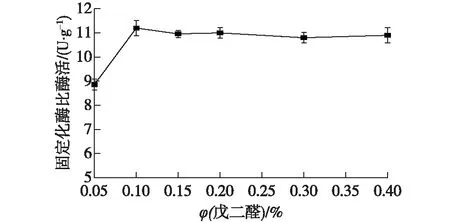
图5 戊二醛体积分数对固定化效果的影响Fig.5 Effect of glutaraldehyde concentration on immobilization
2.1.7 交联时间对固定化效果的影响
取预处理的湿树脂于50 mL锥形瓶中,每瓶放入1 g,戊二醛交联的时间分别设为0.5、1、1.5、2、3和4 h,选择的戊二醛体积分数为0.1%,吸附温度为30 ℃,吸附时间为5 h,吸附pH为7.5,选择的加酶量为30 U/g树脂,结果如图6所示。
由图6可知:交联时间为1 h时,固定化效果最好,比酶活达到(11.5±0.12) U/g,随着时间的增加,交联反应逐渐结束,固定化酶比酶活力不再增加,因此选择最佳的交联时间为1 h。
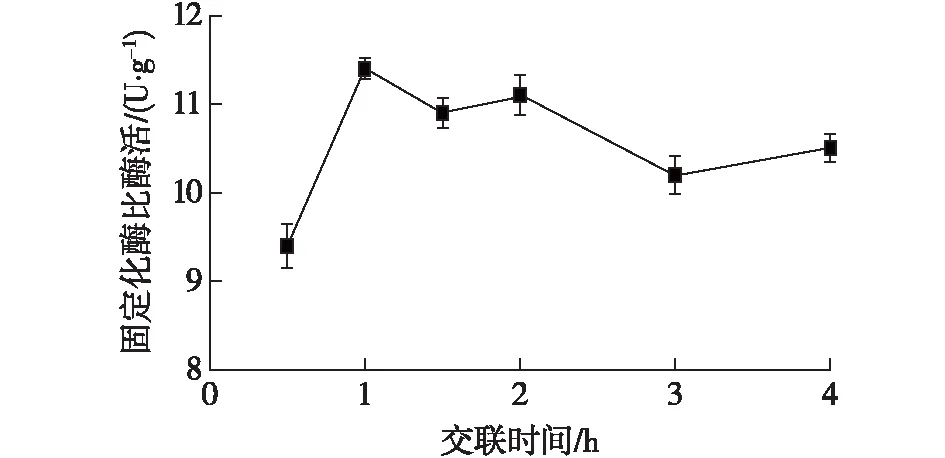
图6 交联时间对固定化效果的影响Fig.6 Effect of cross-linking time on immobilization
通过以上方法对重组乳酸克鲁维酵母所产D-泛解酸内脂水解进行固定化,得到的固化酶制剂为11.5 U/g,相对黎明等[11]得到的4 U/g的固定化酶,具有一定的优势。
2.2 酶学性质研究
2.2.1 酶反应的最适温度
温度的升高一方面能够加快反应速度,提高酶活,另一方面会使蛋白变性,导致酶失活。探究不同温度对固定化酶和游离酶的酶活影响,以最高酶活为100%,测定的温度分别为20、25、30、37、40、45、50、55、60、65、75和85 ℃,结果如图7所示。
由图7可知:温度在37 ℃时酶活力最高,高于此温度时,酶失活的速度大于提高酶活的速度,所以选择游离酶和固定化酶的最适反应温度为37 ℃。
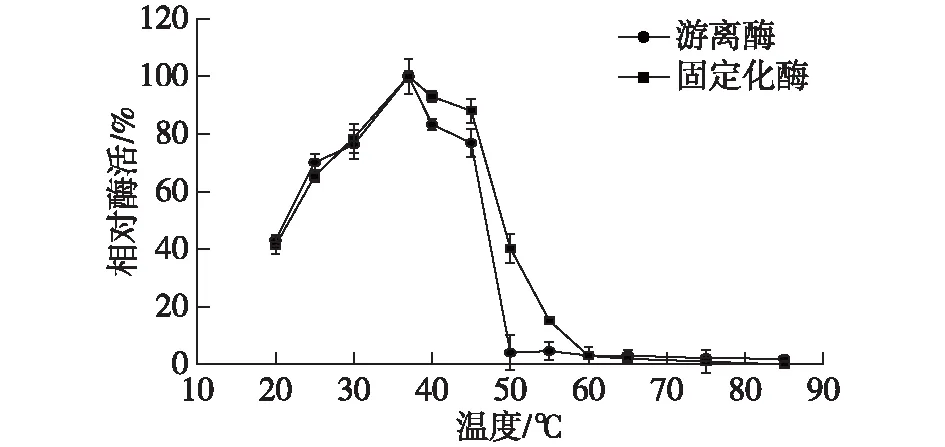
图7 温度对酶活的影响Fig.7 Effects of temperature on enzyme activity
2.2.2 酶的热稳定性
以未经处理酶的酶活为100%,将纯酶分别置于20、25、30、37、40、45、50、55、60、65、75和85 ℃条件下反应30 min,然后测定酶活,结果如图8所示。
由图8可知:在50 ℃处理30 min,固定化酶仍保有约最高酶活力的75%,而游离酶只剩余约最高酶活力的45%,固定化酶的热稳定性高于游离酶,推测是由于固定化载体对酶蛋白具有一定的保护作用。
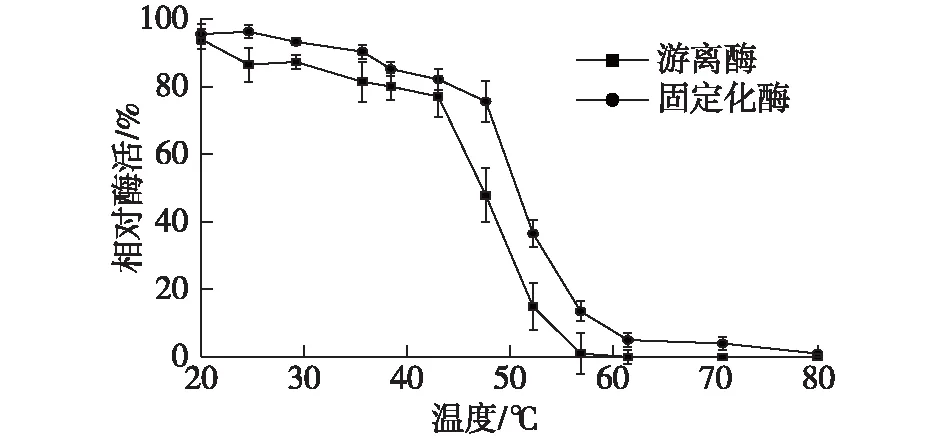
图8 温度对酶稳定性的影响Fig.8 Effects of temperature on enzyme stability
2.2.3 酶反应的最适pH
用不同pH的PBS缓冲液(pH 4.5~7.0)和Tris-HCl缓冲液(pH 7.0~9.5)配制底物,配制的底物在半小时内进行酶活测定,同时用灭活的酶作为对照,减少自发水解带来的误差,结果如图9所示。
由图9可知:酸性条件下底物基本未水解,推测原因是底物水解的反馈抑制作用引起的。pH>8时,酶活最高,但此时底物的非特异性水解率较高,得到的D-泛解酸内酯的光学纯度相对较低。综合底物自发水解的情况,选择酶反应的最佳pH为7.5。
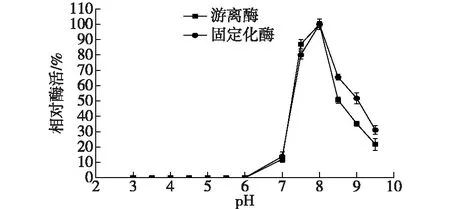
图9 pH对酶活的影响Fig.9 Effects of pH on enzyme activity
2.2.4 酶pH的稳定性
用不同pH的PBS缓冲液(pH 4.5~7.0)和Tris-HCl缓冲液(pH 7.0~9.5)稀释浓缩的酶液,30 ℃放置2 h,然后测定剩余酶活力,以不经过处理的酶的酶活力作为100%,结果如图10所示。
由图10可知:固定化酶对低pH的耐受性高于游离酶,可能是由于载体表面的基团对周围微环境的pH起到一定的缓冲作用。在pH 9.5条件下游离酶和固定化酶的剩余酶活力仍达到75%以上,表明该酶适宜在碱性条件下储存。
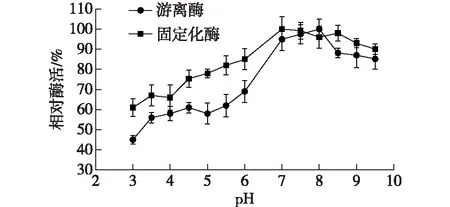
图10 pH对酶稳定性的影响Fig.10 Effects of pH on enzyme stability
2.2.5 金属离子对酶反应的影响
金属离子对固定化酶和游离酶的影响如图11和12所示。
由图11和12可知:Ca2+对游离酶和固定化酶的酶活有激活作用,Mn2+和Zn2+对游离酶和固定化酶有明显的抑制作用,固定化酶对Cu2+、Ni2+和Co2+等离子的耐受性高于游离酶。
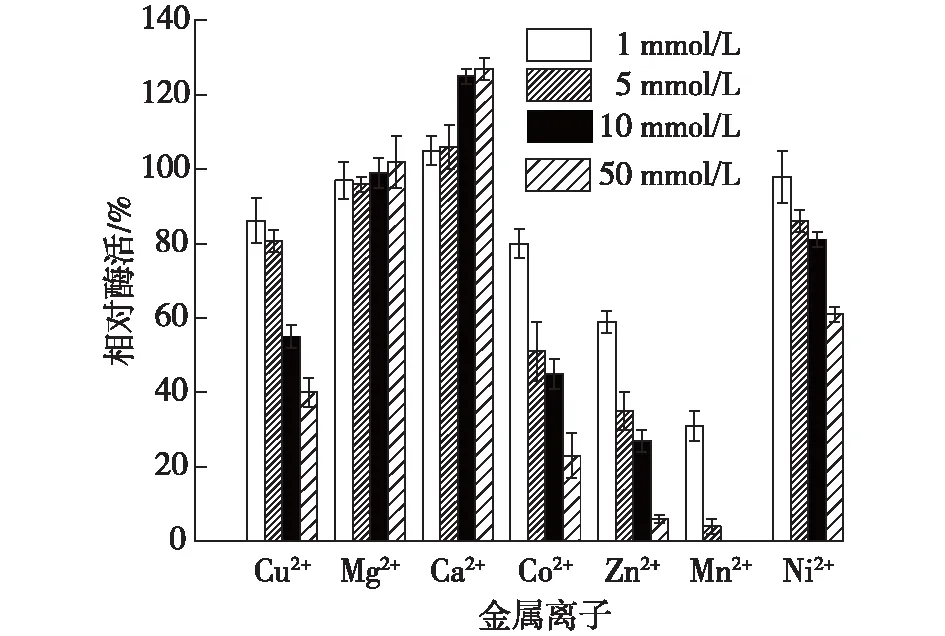
图11 金属离子对固定化酶酶活的影响Fig.11 Effects of metal ions on immobilized enzyme activity
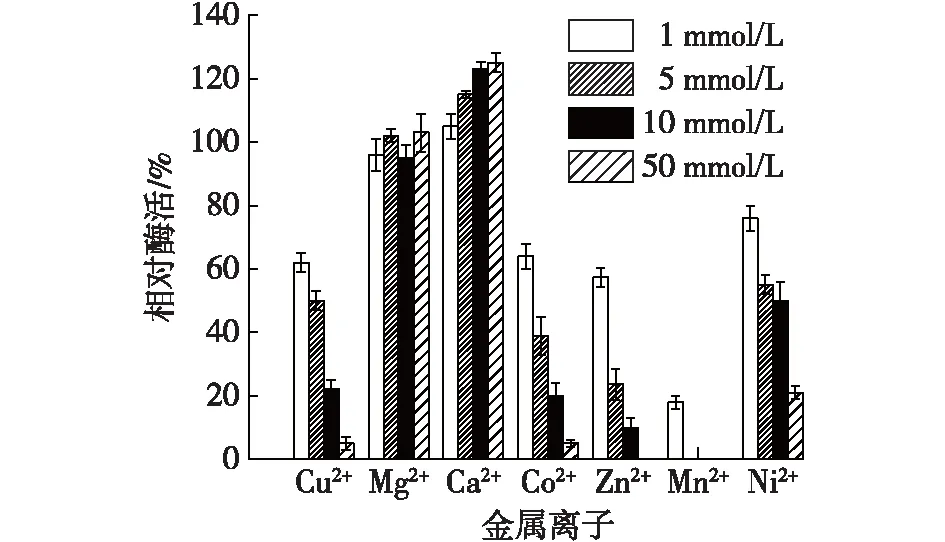
图12 金属离子对游离酶酶活的影响Fig.12 Effects of metal ions on free enzyme activity
2.3 米氏常数的测定
米氏常数Km是酶催化反应的最基本的特征常数,在同一条件下只与酶的性质有关,与酶的浓度无关,Km越大表示酶与底物的亲和性越小[16]。
由于游离酶和固定化酶的反应体系和比酶活力不同,为测定方便,以D-泛解酸内酯为反应底物,选择测定固定化酶动力学参数的反应底物质量浓度为8、10、12、16、20、24、36、50、60和70 g/L,游离酶动力学参数的反应底物质量浓度为10、20、30、40、60、70、80、90和100 g/L,利用双倒数法测定D-泛解酸内酯水解酶的动力学常数,以底物浓度的倒数S-1为横坐标,初始反应速率的倒数v-1为纵坐标,绘制的双倒数图如图13所示。经计算得出游离酶Km=170.25 mmol/L,固定化酶Km=207.601 mmol/L,固定化酶对底物的亲和力比游离酶对底物的亲和力弱,可能是由于固定化酶的空间位阻较大,不利于底物扩散。
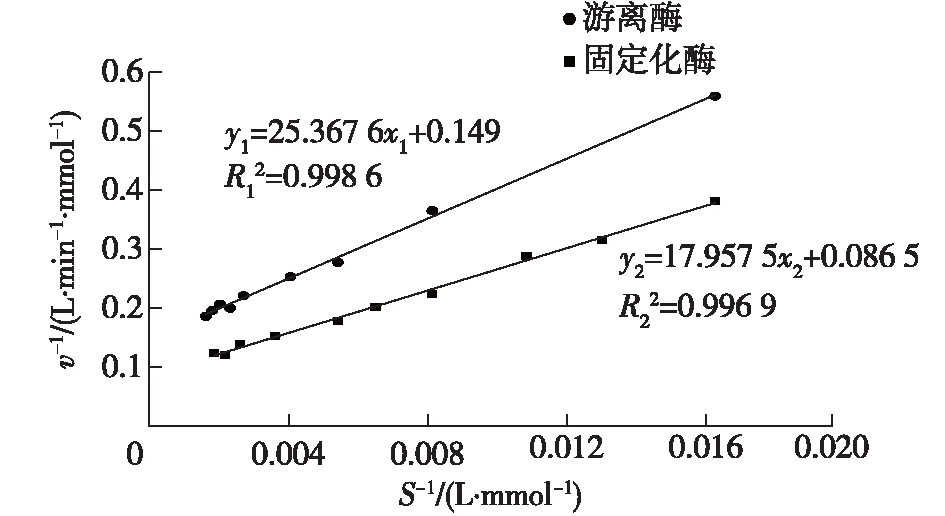
图13 固定化酶和游离酶的动力学曲线Fig.13 Kinetic curves of immobilized and free enzymes
2.4 固定化酶填充床反应
在水解较高浓度底物(25%)时,缓冲液难以有效控制pH的下降,导致水解反应难以继续进行,为此,笔者设计小型的水解装置(图14),免去了手动每隔10 min添加氨水调pH的操作,也保持了酶水解反应的稳定进行,每隔一定时间取少量反应液测定pH和水解率,并校正氨水流加速率,底物总量为30 mL,氨水总添加量约4 mL,结果见图15。
由图15可知:在反应约6 h时,水解率达到27%,水解效率较高,延长反应时间,水解率升高缓慢。经拆分得到的D-泛解酸内酯的光学纯度为97.8%,该固定化酶催化效率达到工业化生产的要求。
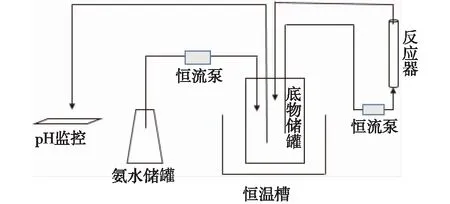
图14 固定化酶水解装置Fig.14 The device of immobilized enzyme hydrolysis
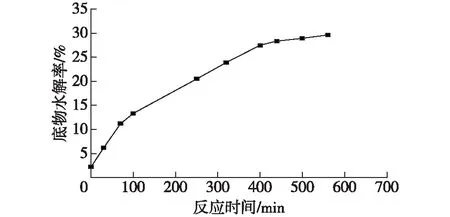
图15 固定化酶水解的时间曲线Fig.15 Time curve of immobilized enzyme hydrolysis
2.5 固定化酶的操作稳定性
对固定化酶填充床反应器进行操作稳定性实验,反应底物的质量分数为20%~25%,每批的反应时间为4~6 h,以第1批次的酶活为100%,进行15批次的实验,结果如图16所示。
由图16可知:固定化酶填充床反应器在使用15次之后,酶活降低为原来的70%左右,但增加反应时间,水解率仍能达到30%,与华蕾等[17]得到平均批反应时间7 h、水解率35%~40%的固定化细胞水解效率相当,具有一定的实用价值。
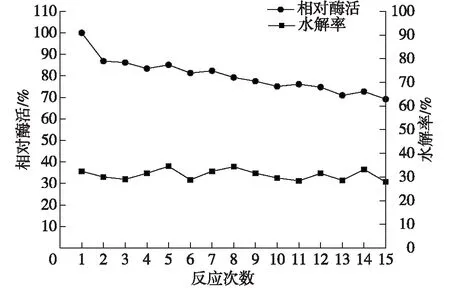
图16 固定化酶的操作稳定性Fig.16 Operating stability of immobilized enzyme
3 结论
对D-泛解酸内酯水解酶的固定化进行研究,确定使用的固定化载体为大孔吸附树脂D380,以戊二醛作为交联剂,对固定化条件进行了优化,较优的结果为:酶的吸附添加量为30 U/g湿树脂,吸附pH 7.0,吸附温度30 ℃,吸附时间5 h,戊二醛体积分数0.1%,戊二醛交联时间1 h,在此固定化条件下得到的固定化酶的比酶活为(11.5±0.12) U/g。研究得到游离酶和固定化酶的最适反应温度均为37 ℃,在20~40 ℃时有较好的稳定性,最适反应pH均为7.5,反应pH低于7时,固定化酶和游离酶表现为无酶活。游离酶的动力学常数Km为170.25 mmol/L,固定化酶的动力学常数Km为207.60 mmol/L,Ca2+对酶促反应有激活作用,Mn2+对该酶有较强的抑制作用。
后续实验将进一步探究合适的固定化酶反应器,实现固定化酶对DL-泛解酸内酯催化反应的自动化和连续化操作。

