血压神经调控性别差异的关键:Ah型髓鞘化压力感受器神经元
刘 丽,乔国芬,李柏岩
(哈尔滨医科大学药学院药理学教研室,黑龙江省生物医药工程重点实验室-省部共建国家重点实验室培育基地,心血管药物研究教育部重点实验室,黑龙江 哈尔滨 150081)
大量临床资料显示,正常生理状态下,成年男性的动脉血压明显高于同龄女性[1],且高血压的发病率呈现相同的趋势[2],但这种性别差异在女性绝经期后消失。另外,多种与内脏传入神经反射功能密切相关的疾病同样存在明显的性别差异,例如,应激性结肠综合征(irritable bowel syndrome,IBS)[3]、哮喘[4]和心绞痛等[5]。还有临床资料显示,虽然帕金森病发病率男性高于女性[6],但早期运动功能障碍出现之前的体位性血压变化(卧位高血压-直立低血压)女性明显多于男性[7],患者餐后低血压同样女性多于男性[8]。与单纯性绝经后期骨质疏松症相比,帕金森病患者骨质疏松的病例全部出现在女性患者[9],且Ⅰ型多巴胺受体(dopamine receptor,DAR1)和DAR2激动剂在抑制乳腺癌骨转移的同时,明显增加骨质疏松动物模型鼠的骨密度[10-11]。尽管如此,上述性别差异的病理生理机制始终不明,因而很难找到确切的治疗方案。显而易见,性激素(雌激素)发挥了重要作用,但将性激素作为性别差异靶点的深入研究并未揭开性别差异的谜底。虽然性激素的作用不能被排除,但并非所有生理功能表现出明显性别差异的结果暗示,内脏感觉传入神经系统中某种特定神经解剖学基础存在性别差异,其功能直接受性激素(雌激素)的调节,进而产生特定系统内的功能出现性别差异。令人兴奋的是,经过我们课题组20年的不懈努力,采用电生理学、药理学、分子生物学和形态学等多种现代科学技术,通过在体和离体动物模型,细胞和离子通道水平的研究发现,成年雌性大鼠内脏感觉传入/压力反射传入通路中,包括结状神经节(nodose ganglion,NG)的一级神经元和孤束核(nucleus tractus solitarius,NTS)二级神经元均分布雌性-特异性分布的神经元亚群,即NG中一种具有传导速度类似于髓鞘化A型(myelinated A-type)并伴随非髓鞘化C型(unmyelinated C-type)特有复极驼峰(repolarization hump)动作电位特征的神经元,即Ah型内脏感觉/压力感受器(baroreceptor)神经元(Ah中:“A”代表髓鞘化纤维,“h”代表复极期驼峰)和NTS中Ah型内脏/压力感受性(baroreceptive)神经元。这种雌性特异性分布的Ah-型神经元的存在被认为是上述性别差异产生的神经解剖学基础,从而合理地解释了内脏感觉神经系统/血压神经调控过程中性别差异产生的细胞学机制。
1 主动脉压力反射传入通路
主动脉压力反射(baroreflex)功能是生理状态下机体维持血压稳态的关键。主动脉压力反射环路由传入和传出2个部分组成。传入环路包括分布于主动脉根部的压力感受器神经末梢(baroreceptor terminals),对压力变化而导致的管腔直径改变的机械牵张敏感(mechanosensitive),感知血压实时变化并将压力变化引起主动脉壁的机械牵张信号转变成电信号,再由神经末梢汇聚而成主动脉减压神经(aortic depressor nerve,ADN)将电信号传送到位于NG内的一级神经元胞体,经过外周整合后再由其中枢突通过突触传递将信号中继到位于NTS中的二级神经元,实现一对一的压力反射传入通路的传递过程。主动脉压力反射传出通路支配心脏和血管进而实现对血压反射性调控的过程并不作为重点内容加以讨论。
1.1 离体实验条件下验证Ah型压力感受器神经元(baroreceptor neurons,BRN)
众所周知,内脏感觉神经系统,包括压力反射传入功能,根据纤维传导速度(conduction velocity,CV)区分为髓鞘化A型和非髓鞘化C型神经元(图1)。尽管以往研究存在差异,但普遍认为A型的比例在10%~15%之间,其余为C型[12-13]。虽然该领域的研究一直在继续,但在本课题组深入报道之前,无关于髓鞘化Ah型内脏感觉/压力感受器神经元的相关报道。其原因可能是:①为避免雌激素对研究结果带来的影响,研究人员尽可能使用雄性动物作为研究对象;②几乎绝大多数研究结果显示,分离神经元是研究人员最常用的研究对象,理由是分离神经元操作简单、结果易于重复,便于进行电生理学和药理学实验研究等。但显而易见的缺点是感觉神经元分类唯一可靠的标准是测量纤维CV,但实验方法复杂、对于实验人员的技术要求高,不宜进行药理学实验等。迄今为止,除了本课题组建立的成年大鼠迷走神经-结状神经节(vagus-NG)实验模型外[14-16],仍无离体实验条件下用于测量CV的实验技术。
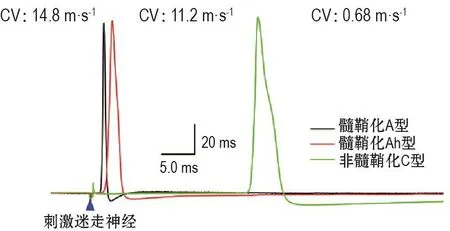
图1 利用成年雌性SD大鼠迷走神经-结状神经节切片方法,并通过刺激迷走神经诱发典型的髓鞘化A和Ah型,以及非髓鞘化C型神经元,其纤维传导速度(CV)分别为14.8,11.2和0.68 m·s-1.
通过采用成年雌性大鼠制备Vagus-NG实验模型,近心端刺激Vagus/ADN,NG神经元胞体全细胞电流钳记录神经诱发动作电位,其结果令人意外。在室温和体温条件下,均记录到CV速度近似于A型(4~20 m·s-1,图1),动作电位复极期带有明显的、近似于C型驼峰样切记(图2)的一类神经元。因此,Ah型神经元的CV和hump可分别用于鉴别C型和A型。在接近体温条件下Ah型神经元的CV更快,但复极期Hump依然存在。利用成年雄性大鼠制备Vagus-NG并重复上述实验只能观察到A和C型。

图2 成年雌性SD大鼠迷走神经-结状神经节切片方法,并通过刺激迷走神经诱发动作电位,并计算传导速度分别鉴定出典型髓鞘化A型(黑)、髓鞘化Ah型(红)和非髓鞘化C型(绿)神经元.通过分析动作电位变化瞬间的电流变化(蓝色)的结果证明髓鞘化Ah型同样存在复极期驼峰切记(垂直虚线:驼峰切记),而髓鞘化A型复极期驼峰切记阴性.
在上述实验条件下记录到的Ah型神经元只能说明内脏感觉神经元中存在雌性特异性Ah型的分布,并不能证明NG中存在Ah型BRN。为了上述目的,实验采用体质量为75 g(4周龄)的雌性大鼠,麻醉状态下分离ADN,并以亲脂性荧光染料(Dil)标记,采用牙科专用硅胶封闭ADN以防止染料同时标记到Vagus。待大鼠成年后(14周龄)制备Vagus-NG标本,选择荧光阳性神经元(图3)重复上述实验,得到完全一致的实验结果,证实雌性大鼠NG中同样特异性分布有能够接收压力传入信号的Ah型BRN[16-18]。
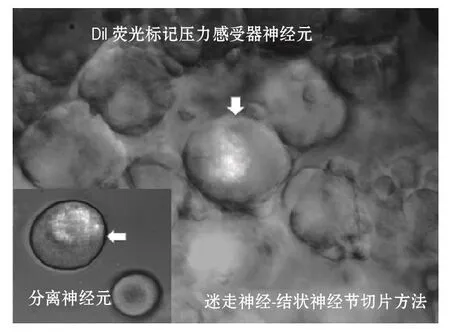
图3 利用急性分离和迷走神经-结状神经节切片方法,并结合Dil荧光技术标记的典型压力感受器神经元.
1.2 在体实验条件下验证Ah型BRN
为了在体观察Ah型神经元的功能活动,实验采用麻醉状态下成年雌性大鼠,游离ADN并记录刺激诱发的复合动作电位(compound action potential,CAP),即同一纤维类型的动作电位同时出现而形成波谷(valley)的方法,近心端刺激Vagus或者ADN,远心端记录CAP。令人兴奋的是,在成年雌性大鼠Vagus和ADN均可以观察到最早出现A型CAP(Avalley),和紧随其后的Ah型CAP(Ah-valley),其出现的位置恰恰在2~10 m·s-1区间(图4)[19],雄性成年大鼠的相同区域内未观察到类似于雌性的Ah型CAP。这一结果进一步提示Ah型神经元的雌性特异性分布。

图4 利用成年雌性SD大鼠麻醉状态下,通过双极恒压刺激主动脉减压神经(ADN)成功诱发并记录髓鞘化A型、髓鞘化Ah型,以及非髓鞘化C型复合动作电位(CAP).
1.3 形态学验证ADN中Ah型神经纤维分布
在体和离体功能学的实验结果均提示,雌雄大鼠ADN传入纤维分布存在性别差异,这种差异必定会在形态学上有所体现。因此,我们对比了雌雄成年(>14周龄)大鼠ADN的超微结构,结果发现雌性成年大鼠ADN的直径[14]、纤维总数、有髓纤维的直径,及髓鞘的厚度均小于成年雄性[19-20]。上述研究结果具有明显的时间依赖性,选取50日龄雌雄大鼠的对比研究显示(图5),所有观察指标明显偏低,这与髓鞘化完全至少需要14周吻合。显而易见,采用15日龄大鼠制备Vagus-NG模型的难度虽然降低,但由于髓鞘化不完全及ADN长度偏短等因素,实际测量ADN的形态学参数及CV误差将明显增大[21]。

图5 50日龄雌雄SD大鼠主动脉减压神经髓鞘化和非髓鞘化纤维的分布.
既然在体和离体以及电生理学和形态学结果都证实了Ah型神经元的雌性特异性存在,那么Ah型BRN参与血压神经调控的结果必然导致大鼠压力反射传入功能的性别差异。基于这一假设,课题组采用麻醉状态下雌性成年大鼠,电刺激ADN的同时观察血压变化情况(图6)。结果显示,选择性激活ADN有髓纤维诱导压力反射过程导致动脉血压降低程度雌性是雄性的3~7倍,更重要的是诱导这一反应所需要的刺激强度雌性(5~10 Hz)明显小于雄性(50 Hz)[20-22]。总而言之,我们的实验结果充分证明,成年雌性大鼠压力反射传入途径中髓鞘化纤维的性别差异,可能是导致自主神经调控内脏/心血管功能出现显著性别差异的主要因素。
2 孤束核Ah型压力感受性神经元

图6 利用成年雌性SD大鼠电刺激(2 V/50 Hz)减压神经记录到的典型的平均动脉压反射性变化.绿色剪头:刺激开始;红色剪头:刺激结束.平均动脉压下降超过30 mmHg.1 mmHg=0.133 kPa.
压力反射传入通路起始于主动脉减压神经末梢,通过机械牵张感受器(PIEZO)[23-26]将机械信号转化成生物电信号,传入其位于NG中的一级神经元胞体,再由其中枢端与位于NTS内二级神经元形成突触传递。目前普遍认为在这一反射传入途径中,信号为一对一的传递。既然NG中分布有Ah型BRN,NTS必然存在Ah型压力感受性二级神经元。基于上述假设,我们课题组采用雌雄成年大鼠孤束核脑片技术[27],结合Dil标记技术和全细胞膜片钳技术[15],同时利用辣椒素(capsaicin,Cap)结合选择性大电导钙激活钾通道(KCa1.1)抑制剂(iberiotoxin,IbTX)的敏感性鉴别髓鞘化A和Ah型压力感受性NTS神经元[22,28]。研究结果表明,NTS中同样分布有感知血压变化的髓鞘化Ah型神经元,具有Cap不敏感和IbTX敏感的特性。在IbTX存在的条件下,兴奋性突触后电流(excitatory postsynaptic currents,EPSC)显著增加,提示突触前膜释放谷氨酸,压力反射传入功能激活,反射性动脉血压下调。A型对Cap和IbTX均不敏感,而C型对Cap和IbTX均敏感。课题组另一项研究结果表明,NTS中Ah型压力感受性神经元自发EPSC出现的频率,或者EPSC/抑制性突触后电流(inhibitory post-synaptic currents,IPSC)的比值成年雌性明显高于雄性和去卵巢(ovariectomy,OVX)大鼠[29-30],而去除卵巢前后A型和C型自发EPSC出现的频率并未改变,这与NG的结果完全一致[31],即Ah型存在显著的雌激素依赖性。而NTS中Ah型压力感受性神经元对IbTX敏感,提示细胞膜功能性表达KCa1.1,这一结果与NG一级神经元胞体的记录结果也完全吻合[32],表现为:①频率依赖性动作电位时程延长[28],即KCa1.1的频率依赖性失活所致,兴奋性增加;②IbTX同样延长动作电位时程,上调兴奋性。
3 主动脉Ah型压力感受器神经末梢
压力反射传入通路的一级和二级神经元均分布雌性特异性的髓鞘化Ah型BRNs/压力感受性神经元,由于内脏感觉传入具有一对一信息传递的特性。由此可见,雌性成年大鼠主动脉压力感受器神经末梢同样特异性分布Ah型传入纤维应该在意料之中。为了证明这一推断,本课题组建立了离体记录ADN单纤维放电的实验模型[33],实时记录压力变化诱导的瞬时放电。令人兴奋的是,雌性成年大鼠ADN单纤维记录的结果证明,随着压力升高记录到3种截然不同的瞬时放电曲线(图7),即A型(图7A和D),Ah型(图7B和E),和C型(图7C和F)。通过以下证据可以证明我们的结论:①通过对单纤维放电的阈值、曲线的斜率以及瞬时放电频率(instant firing frequency,IFF)分析,3种单纤维放电的性质截然不同;②在有Cap存在的条件下,只有图7C和F的放电消失,根据其对Cap的敏感性可以鉴定为非髓鞘化C型,其他2种为髓鞘化纤维;③由于Ah型电活动具有明确的雌激素依赖性,不难想象去除卵巢后A和C型的单纤维放电将不受影响,Ah型则不然。上述假设与实际实验结果高度吻合。由此得出结论,主动脉压力感受器同样存在雌性特异性分布的髓鞘化Ah型神经末梢。
4 BRN功能分布特性及鉴别

图7 利用成年雌性SD大鼠离体主动脉弓-主动脉减压神经(ADN)单纤维记录方法,通过改变主动脉内压力诱发代表性ADN单纤维瞬时放电.上排:相同压力斜坡下单纤维放电;下排:瞬时单纤维放电与时间的关系.A和D:雌激素非依赖及辣椒素非敏感的髓鞘化A型单纤维放电;B和E:雌激素依赖及辣椒素非敏感的髓鞘化Ah型单纤维放电;C和F:雌激素非依赖及辣椒素敏感的非髓鞘化C型单纤维放电.
由此可见,Ah型神经元在压力反射传入通路的不同水平均得到证实,并具有与传统A型和C型神经元明显不同的生物学、电生理学和化学敏感性等特征,为血压神经调控的性别差异奠定了神经解剖学基础,具体可归纳为:①成年雌性特异性分布,占比与A型相似(<20%),因此,成年雌性大鼠的髓鞘化纤维明显多于同龄雄性,又由于Ah型的雌激素依赖性,生理状态下对血压的波动更为敏感,通过反射性调节导致雌性大鼠血压低于雄性不难理解;②在压力反射传入通路的不同水平均证明Ah型神经元的分布;③纤维CV是唯一可靠的感觉纤维分类标准,结合CV和动作电位复极时相的驼峰切记,可以确切证实Ah型神经元是完全不同于A和C型的神经元亚型;④Ah型对Cap和IbTX的敏感性不同于传统的A型和C型,以此作为鉴别三种传入纤维的工具;⑤Ah型存在雌激素依赖性,在没有雌激素支持的条件下(如OVX)电生理学特性消失,即兴奋性显著降低,反射性下调血压的作用不复存在,从而解释为什么成年女性绝经期后动脉血压的水平与男性持平;⑥虽然均为髓鞘化神经元,在功能性表达KCa1.1方面A型和Ah型截然不同[22,28,32,34];由于功能性表达KCa1.1,Ah型动作电位时程延长呈现明显频率依赖性(KCa1.1渐进性失活)[34],虽然分子生物学和免疫组织化学结果证明A型同样表达KCa1.1,但功能学结果并不支持的原因可能是A型中N型钙通道和KCa1.1之间不存在偶联关系[34],这一推测得到计算机模型数据的支持,但还需要进一步的实验验证;另外,KCa1.1 b-4亚基的存在并非导致A型神经元对IbTX不敏感的因素[35];⑦HCN1非特异性阳离子通道是影响神经元兴奋性的另一关键因素。实验结果表明,3种神经元均表达HCN1,但A型和Ah型HCN1电流密度明显高于C型,这可能是二者具有较高神经兴奋性和放电频率的合理解释[30,36-38];⑧ 延迟关闭的电压依赖性钠通道(Nav1.9)是影响神经兴奋性的重要离子通道;我们的研究结果显示,Ah型神经元不仅功能性表达Nav1.7(河豚毒素敏感型)和Nav1.8(河豚毒素抵抗型)[39-43],同样表达Nav1.9,使其具有高神经兴奋性[19,44-45];⑨ 对于神经元化学敏感性,非髓鞘化C型对Cap敏感,且同工凝集素B4(isolectin B4,IB4)检测阳性,HCN1检测阴性,而髓鞘化A型和Ah型对aβ甲基化ATP(ab-methyl-ATP,ab-mATP)敏感,HCN1检测阳性,但对Cap不敏感且IB4检测为阴性;因此,HCN1和IB4适合免疫组织化学方法鉴定传入纤维的种类,HCN1结合KCa1.1特异性抗体同时标记用于鉴别Ah型。
5 主动脉压力减压神经末梢机械牵张感受器-非选择性阳离子通道——PIEZO
尽管对主动脉压力反射传入途径中一级神经元(如NG)和二级神经元(如NTS)所在部位研究广泛而深入,但由于结构的复杂性和研究方法的限制,对于主动脉根部压力感受器神经末梢的研究工作始终处于探索阶段。但研究人员普遍认为主动脉壁外层中的压力感受器神经末梢部位存在机械牵张感受器,感受血压变化引起主动脉壁牵张的机械信号转变为生物电信号,完成由压力感受器神经末梢,经ADN向NG和NTS传递的初试过程。令人兴奋的是主动脉机械牵张感受器终于被人们发现,并被命名为压电转换器(PIEZO,包括PIEZO1和PIEZO2),属于非选择性阳离子通道。这一发现是近十年来血压神经调控和神经科学领域令人瞩目的发现之一[25-26,46],尽管支持PIEZO作为主动脉压力感受功能的证据链理论上仍存在不足[47],但这一发现使得压力反射传入功能的解释趋于完善。我们前期大量的研究结果证明,无论是NG和NTS均分布有性别特异性分布的髓鞘化Ah型BRN,构成了血压神调控性别差异的神经解剖学基础。基于上述观点以及压力反射传入通路中神经纤维点对点投射的原则,可以想象PIEZOs阳离子通道的功能性表达必然存在性别差异和激素依赖特性,因此,对于PIEZO在生理和病理状态下表达的变化、功能学、电生理学和药理学等方面的深入研究应该受到足够的重视。
6 Ah型BRN功能异常与疾病
6.1 Ah型BRN的功能与血压神经调控和高血压
大量研究结果表明,多种神经递质或血管活性物质均参与血压的神经调控过程,但压力反射传入途径在生理和高血压病理生理条件下发挥何等重要作用,现有的研究十分有限,主要原因之一是缺少合适的在体实验方法。本课题组经过反复摸索建立了大鼠麻醉状态下NG内显微注射的实验技术,并结合电生理学和分子生物学,以及单细胞qRT-PCR技术等,对多种神经递质和血管活性物质的实验证明,血管紧张素Ⅱ(angiotensinⅡ,Ang-Ⅱ)[48],血清素(serotonin,5-HT)[49],P物质[50],神经肽Y[51-52],以及组胺[53-54]等均不同程度直接参与内脏传入-压力感觉传入功能的调节。
Ang-Ⅱ型受体(ATR2)在雌性特异性分布的Ah型BRN相对高表达,且NG内微量注射Ang-Ⅱ显著下调雌性大鼠血压可能是导致血压神经调控出现性别差异的部分原因[48]。目前普遍认为成纤维细胞生长因子21(fibroblast growth factor-21,FGF-21)同时参与循环和代谢异常所致高血压的发病过程,我们近期的实验结果显示,FGF-21直接参与并通过其受体表达等方式参与原发和继发性高血压的病理生理过程[55-57]。
6.2 Ah型BRN功能激活与心脏感觉下行性抑制和无痛心绞痛
临床研究资料显示,成年女性无痛性心绞痛和非典型心肌梗死的发生率明显高于同龄男性[58-59],这种临床现象可能与压力感受器功能失调和压力反射激活而导致的心脏感觉下行抑制有关[60-61],但始终没有得到实验数据的直接证实。我们的研究结果显示,NG微量注射5-HT及其Ⅲ型受体(5-HT3R)激动剂对雌性的降压作用明显大于雄性;雌性大鼠心肌梗死模型血浆中5-HT的量显著升高,同时心包腔内给予Cap诱导斜方肌放电的结果显示,雌性大鼠斜方肌放电的频率显著降低时程缩短。上述结果提示,心肌梗死时血浆中升高的5-HT直接兴奋主动脉压力感受器神经末梢,使心脏下行性疼痛感知能力减退,即临床上表现为无痛性心绞痛/非典型性心肌梗死;电生理学结果显示,Ah型BRN对5-HT极其敏感,单细胞qRT-PCR结果表明,5-HT3AR在Ah型BRN中的分布和表达明显高于A和C型,而A型对5-HT并不敏感,提示心梗血浆升高的5-HT直接兴奋雌性特异性分布的Ah型BRN可能是下行性抑制心脏疼痛感受的细胞学机制;同时由于心肌梗死高水平的5-HT激活压力感受器,反射性血压下降,外周疼痛敏感性增高,这也进一步解释了女性心绞痛患者外周疼痛过敏的临床表象[49]。是否直接激活压力感受器导致心脏疼痛消失或减弱,未来可以采用PIEZO激动剂直接作用于主动脉压力感受器神经末梢,或者NG微量注射直接兴奋压力感受器神经元加以证实。
6.3 Ah型神经元对组胺的敏感性及其受体表达与哮喘发病性别差异的关系
现有的临床资料显示,哮喘的发病率成年女性明显高于同龄男性。我们的研究结果显示,组胺Ⅱ受体在Ah型神经元中高表达,可能是成年女性哮喘高发的病理生理机制之一[53-54]。进一步电生理学的研究结果显示[62],成年雌性大鼠Ah型神经元对组胺高度敏感;单细胞qRT-PCR结果证实[53],Ⅱ型组胺受体(H2R)在Ah型神经元中的表达明显高于A型(对组胺不敏感)和C型(受体表达主要在细胞核内)。综合上述结果,我们有理由相信,雌性特异性分布的Ah型神经元对组胺的高敏感性,以及H2R在细胞中差异表达可能是哮喘发病出现性别差异重要的分子生物学机制。
7 展望
主动脉压力反射是血压神经调控的重要组成部分,与血压神经调控和内脏神经传入功能的病理生理密切相关。临床上常见有高血压、无痛性心绞痛/非典型性心肌梗死、哮喘以及应激性结肠综合征等,而且上述疾病存在显著的性别差异;除此之外,大量的临床研究显示,帕金森病作为高发的老年神经退行性病变,在其运动功能障碍出现之前,表现出明显自主神经功能衰竭的现象,即卧位高血压和直立低血压,是心脑血管意外和骨折的高危因素,很显然这与压力反射功能失调密切相关。但目前的研究水平仍无法给出合理的解释。由此可见,通过对主动脉压力感受器传入功能的研究可能对阐明帕金森病发病机制发挥至关重要的作用。

