快速老化模型小鼠海马组织间液中单胺类神经递质水平的昼夜节律变化和增龄变化
王 静,程肖蕊,周文霞,张永祥,王淑美
(1.广东药科大学中药学院,广东 广州 510006;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
快速老化模型小鼠(senescence-accelerated mouse,SAM)由日本京都大学竹田教授经过筛选培育而成,包括快速老化亚系(SAM-prone,SAMP)和抗快速老化亚系(SAM-resistant,SAMR)。SAMP系具有品系特异的病理表型,SAMR系则具有相对正常的生命期,常作为SAMP系的对照。其中SAMP8亚系的特征是中枢学习记忆功能随增龄进行性快速衰退,与SAMR1亚系相比,SAMP8亚系病理特征明显且稳定,对药物治疗具有良好的反应。因此,目前SAMP8亚系被认为是研究阿尔茨海默病(Alzheimer disease,AD)等老化相关疾病发生机制及其防治药物的较为理想的动物模型[1]。
神经系统紊乱与学习记忆功能密切相关[2-3]。已有研究表明,SAMP8脑中的神经信号传递异常。与同月龄SAMR1相比,12月龄SAMP8海马中M1受体与其阻断剂哌仑西平(pirenzepine)、N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体与其拮抗剂MK-801、苯二氮类受体与其激动剂氟硝西泮(flunitrazepam)、5-羟色胺1A(5-hydroxytryptamine 1A,5-HT1A)受体与其激动剂8-羟基-2-(双-n-丙胺基)-四氢萘、蛋白激酶C与其激活剂佛波醇-12,13-二丁酸酯的结合能力下降;而在皮质中,M1受体与其阻断剂哌仑西平、苯二氮类受体与其激动剂氟硝西泮、5-HT1A受体与其激动剂8-羟基-2-(双-n-丙胺基)-四氢萘结合能力增加。在SAMP8海马神经细胞胞质和胞膜中,蛋白激酶C与其激活剂佛波醇-12,13-二丁酸酯的结合能力降低[4]。上述结果提示,SAMP8脑中谷氨酸能和5-HT能神经传递发生异常。对于涉及去甲肾上腺素(norepinephrine,NE)能、多巴胺(dopamine,DA)能和5-HT能单胺类神经递质,本研究室前期研究发现,SAMP8大脑皮质、海马和下丘脑内单胺类神经递质水平多明显高于同龄SAMR1,且随增龄明显增高,提示SAMP8学习记忆能力的衰退可能与其相关脑区单胺类神经递质水平的变化密切相关[5]。然而对于SAMP8脑中单胺类神经递质的昼夜节律及其增龄性变化尚缺乏系统的研究。
单胺类神经递质在神经系统中起着重要的调节作用[6]。为使SAMP8更好地应用于老化相关疾病如AD的发生机制以及防治药物研究,本研究采用微透析方法获得主管学习记忆的关键部位海马的组织间液,利用高效液相色谱(high-performance liquid chromatography,HPLC)-电化学方法测定组织间液中单胺类神经递质及其代谢产物水平,包括NE、DA及其代谢产物高香草酸(homovanillic acid,HVA)和3,4-二羟基苯乙酸(3,4-dihydroxy phenylacetic acid,DOPAC)、5-HT及其代谢产物5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA),观察其昼夜节律及增龄性变化,这对于揭示AD等老化相关疾病发生机制及相关药物药理学研究具有重要意义。
1 材料与方法
1.1 动物、试剂和仪器
SAMP8和SAMR1由日本京都大学引进,雄性,体质量29.1~50.9 g,共70只,本研究室繁殖饲养。其中,3月龄SAMR1 6只,6,9,12和15月龄均5只,18月龄7只;3和18月龄SAMP8均5只,6月龄8只,9月龄7只,12和15月龄均6只。
NE,DA,DOPAC,HVA,5-HT和5-HIAA标准品及辛烷磺酸钠均购自美国Sigma公司;柠檬酸、柠檬酸钠、无水亚硫酸钠、乙二胺四乙酸二钠和NaCl均购自国药集团化学试剂有限公司;甲醇(色谱纯)购自中国赛默飞世尔科技有限公司;实验用水为Mili-Q超纯水(美国Millipore公司Mili-Q纯水机制造);人工脑脊液(artificial cerebrospinal fluid,aCSF)购自石家庄四药有限公司;3,4-二羟基苄胺(3,4-dihydroxybenzylamine,DHBA)购自美国Sigma公司。Waters e2695液相色谱工作站及电化学检测器和SunFireTM C18色谱柱(5 μm,250 mm×4.6 mm,美国Waters公司);自发活动箱(400 mm×400 mm×600 mm,上海吉量,JLBehv-LAG-9);超低温冰箱(-80℃,海尔公司);CMA120清醒动物装置、微注射泵和BAS(2 mm)微透析探针均购自美国BAS公司。
1.2 海马组织间液样品采集
小鼠ip给予戊巴比妥钠70 mg·kg-1,麻醉后开始底座植入手术。将小鼠俯卧固定于立体定位仪上,调整齿夹和耳夹使颅骨面水平。剪开颅骨上皮肤和皮下组织,用3%H2O2浸湿的棉签烧灼止血并充分暴露颅骨表面,调节门齿杆使前后囟在同一水平面。以横纵坐标定位前囟,并确定所定位海马的坐标:前囟后2.7 mm,前囟侧3.0 mm,颅骨面下1.5 mm。按上述坐标,垂直插入引导管,并以牙科水泥使之固定于颅骨面;手术完毕后单笼饲养,72 h后透析。
透析前1 d,新的微透析探针(透析膜长度2 mm)浸泡于纯水中过夜。将小鼠置自发活动箱中。用乙醚轻微麻醉,小心取出引导管内钢芯,将探针置入,探针事先通过MF-5366型连接管〔0.025 OD(外径)×0.005 ID(内径)〕与微量注射泵和收集器的收集针相连,将微量注射泵的流速调到2 μL·min-1灌流脑脊液代替物(artificial cerebrospinal fluid,aCSF),调节收集器的温度为4℃。从12∶00开始采样,每隔4 h采集1个样品,收集24 h,采样时间点分别为12∶00,16∶00,20∶00,24∶00及次日4∶00和8∶00,每个样品35 μL,每收集完1个样品立即加入6 μL高氯酸溶液1.1 mol·L-1并混匀,以防止递质被降解,然后保存于-80℃冰箱。
1.3 海马组织间液神经递质水平的测定
1.3.1 液相色谱条件
电化学检测器使用玻璃碳工作电极,固态Ag/AgCl作为参比电极。检测电压为+0.70 V。流动相由柠檬酸85 mmol·L-1,无水乙酸钠100 mmol·L-1,Na2EDTA 0.2 mmol·L-1,辛烷磺酸钠 0.9 mmol·L-1,NaCl 2 mmol·L-1,15% 甲醇组成,pH值3.70。柱温8℃,柱压+0.70 V,流速1.0 mL·min-1,进样35 μL。
1.3.2 标准曲线制作
用HPLC-电化学法检测递质的含量,每次进样35 μL,以峰面积外标法进行定量。首先分别称取DA 3.79 mg,5-HT 4.25 mg,NE 3.38 mg,DOPAC 3.36 mg,HVA 3.62 mg,5-HIAA 3.82 mg,分别超声溶解于2 mL aCSF中配制成10 mmol·L-1的贮存液。随后,从每种递质标准品贮存液中各取100 μL合并,再加 aCSF 400 μL 稀释至1 mmol·L-1;然后用 aCSF 依次稀释 50 倍至 20 μmol·L-1,再稀释20倍至1 μmol·L-1,最后再用aCSF依次2倍倍比稀释至500,250,125,62.5,31.25,15.6,7.8,3.9和1.9 nmol·L-1。取各倍比稀释液35 μL,分别加内标DHBA 4 μL和1.1 mmol·L-1高氯酸 6 μL,混匀后取35 μL进样。以单胺类神经递质峰面积与内标DHBA峰面积的比值为纵坐标,以标准品浓度为横坐标,制作NE、DA及其代谢产物HVA和DOPAC、5-HT及其代谢产物5-HIAA的标准曲线。
1.3.3 单胺类神经递质及代谢产物水平测定
各时间点浓度的测定:取各时间点采集的样品35 μL,加1.1 mmol·L-1高氯酸6 μL混匀。测定时向混合液中加内标DHBA 4 μL,混匀后取35 μL进样。递质的浓度用递质峰面积与内标峰面积的比值从上述相应标准品曲线计算获得。
12∶00至次日8∶00递质及其代谢产物时间-浓度曲线下面积(area under curve,AUC)计算:计算海马组织间液中NE、DA及其代谢产物HVA和DOPAC、5-HT及其代谢产物5-HIAA 12∶00至次日8∶00时间-浓度AUC,表示海马组织间液递质及其代谢产物昼夜总含量,分析SAMR1和SAMP8海马组织间液中单胺类神经递质增龄性变化。
1.4 统计学分析
2 结果
2.1 单胺类神经递质及其代谢产物标准曲线
采用HPLC-电化学法检测NE,DA,HVA,DOPAC,5-HT和5-HIAA标准品1.9,3.9,7.8,15.6,31.25,62.5,125,250和500 nmol·L-1溶液峰面积,以峰面积与内标DHBA峰面积的比值为纵坐标,标准品浓度为横坐标,制作其标准曲线。NE:y=0.005694x+0.01428(R2=0.9965,P<0.01);DA:y=0.008431x+0.001449(R2=0.9959,P<0.01);DOPAC:y=0.005029x+0.003377(R2=0.9989,P<0.01);HVA:y=0.008840x+0.001874(R2=0.9956,P<0.01);5-HT:y=0.003838x+0.03145(R2=0.9988,P<0.01);5-HIAA:y=0.001490x+0.01020(R2=0.9994,P<0.01)。
2.2 SAMR1和SAMP8海马组织间液中NE水平的变化
2.2.1 昼夜节律变化
结果表明(图1),12∶00至次日8∶00,SAMP8海马组织间液中NE浓度的变化,除3月龄与SAMR1一致外,6~18月龄与SAMR1均不一致,其中6和18月龄昼夜节律变化差异更为明显。6月龄:16∶00 SAMP8 NE浓度明显低于SAMR1(P<0.01),随后逐渐升高,至次日 4∶00~8∶00 SAMP8 明显高于SAMR1(P<0.01)。18月龄:12∶00~16∶00 SAMP8 NE浓度高于SAMR1(P<0.05),20∶00低于SAMR1(P<0.01),随后逐渐升高,至次日4∶00又升高于SAMR1(P<0.01)。

Fig.1 Changes in norepinephrine(NE)concentration in hippocampal interstitial fluid of male senescenceaccelerated prone 8 mice(SAMP8)and SAM resistance 1(SAMR1)detected by HPLC-ECD.A-F:3,6,9,12,15 and 18 months of old,respectively.±s,n=5-7.*P<0.05,**P<0.01,compared with SAMR1 of the same time.
2.2.2 增龄变化
结果表明(图2),12∶00至次日8∶00,3~18月龄SAMP8海马组织间液中NE总含量变化趋势与SAMR1一致,均为3和6月龄较高,随后随增龄降低。SAMP8与SAMR1的差异为15月龄SAMP8低于SAMR1(P<0.05),18月龄SAMP8高于SAMR1(P<0.05)。

Fig.2 Changes in NE total content in hippocampal interstitial fluid of male SAMP8 and SAMR1 with aging detected by HPLC-ECD.AUC:area under curve.±s,n=5-7.*P<0.05,compared with SAMR1 of the same age.
2.3 SAMP8和SAMR1海马组织间液中DA及其代谢产物水平的变化
2.3.1 昼夜节律变化
结果表明(图3),DA昼夜节律:12∶00至次日8∶00,3~12月龄SAMP8 DA昼夜节律变化与同月龄SAMR1均不一致,几乎相反。DOPAC昼夜节律:除15和18月龄其浓度低于检测限,3~12月龄SAMP8 DOPAC浓度与同月龄SAMR1昼夜节律变化亦不一致;特别是3和9月龄,SAMP8与SAMR1几乎相反。HVA昼夜节律:3,6,9和18月龄SAMP8 HVA浓度变化与同月龄SAMR1均不一致,12和15月龄昼夜节律变化相似。
2.3.2 增龄变化
结果表明(图4),3~12月龄SAMP8 DA总含量随增龄变化趋势与SAMR1相似,差别是SAMP8 3月龄高于SAMR1(P<0.05),6月龄低于SAMR1(P<0.05)。SAMP8 DOPAC总含量的增龄变化趋势与SAMR1一致,差别是12月龄SAMP8低于SAMR1(P<0.05)。SAMP8 HVA总含量的增龄变化趋势除3月龄外基本一致,差别是3和12月龄高于SAMR1(P<0.01),18月龄低于SAMR1(P<0.05)。

Fig.3 Changes in concentrations of dopamine(DA),3,4-dihydroxy phenylacetic acid(DOPAC)and homovanillic acid(HVA)in hippocampal interstitial fluid of male SAMP8 and SAMR1 detected by HPLC-ECD.A-D:DA of 3,6,9 and 12 months old,respectively;E-H:DOPAC of 3,6,9 and 12 months old,respectively;I-N:HVA of 3,6,9,12,15 and 18 months old,respectively.±s,n=5-7.*P<0.05,**P<0.01,compared with SAMR1 of the same time.
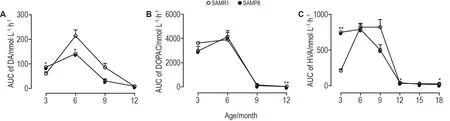
Fig.4 Changes in total contents of DA(A),DOPAC(B)and HVA(C)in hippocampal interstitial fluid of male SAMP8 and SAMR1 with aging detected by HPLC-ECD.±s,n=5-7.*P<0.05,**P<0.01,compared with SAMR1 of the same age.
2.4 SAMP8和SAMR1海马组织间液中5-HT及其代谢产物水平
2.4.1 昼夜节律变化
结果表明(图5),5-HT昼夜节律:12∶00至次日8∶00,SAMP8 5-HT昼夜变化除12月龄与SAMR1一致外,其余月龄均不一致,特别是9,15和18月龄与SAMR1几乎相反;5-HIAA昼夜节律:3~15月龄SAMP8 5-HIAA浓度变化与同月龄SAMR1均不一致,特别是3,6和9月龄几乎相反。
2.4.2 增龄变化
结果表明(图6),3~18月龄SAMP8 5-HT总含量增龄变化趋势,除18月龄外(P<0.05),与SAMR1基本一致;3~15月龄SAMP8 5-HIAA总含量增龄变化趋势,除6月龄外,与SAMR1基本一致,差别是6,9,12和15月龄SAMP8高于SAMR1(P<0.05)。

Fig.5 Changes in concentrations of serotonin(5-HT)and 5-hydroxyindoleacetic acid(5-HIAA)in hippocampal interstitial fluid of male SAMP8 and SAMR1 detected by HPLC-ECD.A-F:5-HT of 3,6,9,12,15 and 18 months old,respectively;G-K:5-HIAA of 3,6,9,12 and 15 months old,respectively.±s,n=5-7.*P<0.05,**P<0.01,compared with SAMR1 of the same time.
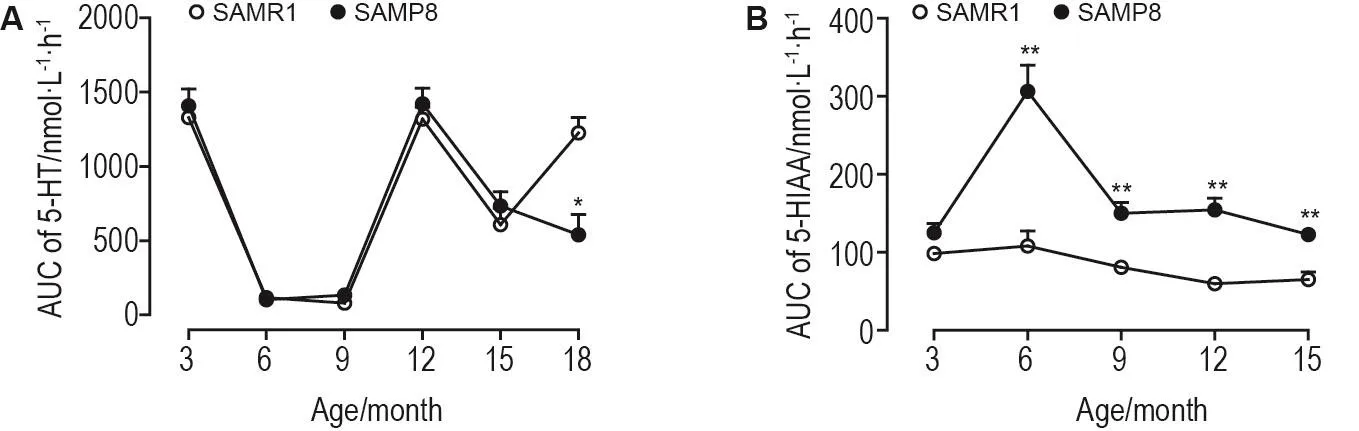
Fig.6 Changes in total contents of 5-HT(A)and 5-HIAA(B)in hippocampal interstitial fluid of male SAMP8 and SAMR1 with aging detected by HPLC-ECD.±s,n=5-7.*P<0.05,**P<0.01,compared with SAMR1 of the same age.
3 讨论
单胺类神经递质中NE与焦虑抑郁相关,5-HT与情绪相关,DA能神经系统则在快感与行为动机方面起着极其重要的作用[7],因此一直受到科学研究的关注。在人体以及啮齿类动物的大脑内5-HT,DA和NE含量的研究很多,同时也出现了不少难以解释的矛盾性结果。如在人体,5-HT和NE含量在皮质、海马、基底神经节和脑干部位随增龄保持稳定[8-11]。也有报道称,因从尸检大脑得到的单胺检测结果易受死亡时间、解剖时间间隔等影响[12-13]。在脑区5-HT能神经元5-HT水平随增龄变化报道不一,有的报道不变[3,14-15],有的报道下降[16-17],也有报道增加[18-19]。在啮齿类动物,Godefroy等[20]以3,10和27月龄SD大鼠为研究对象,检测皮质和纹状体部位DA及其代谢产物增龄性变化。结果发现,躯体运动皮质部位DA水平随增龄性增加,颞叶皮质部位则降低。前边缘皮质、梨状皮质和颞叶皮质部位HVA水平随增龄性降低,3-甲氧酪胺(3-methoxytyramine,3-MT)在前边缘皮质、梨状皮质、扣带回区域和颞叶皮质部位增加。纹状体部位DA和HVA水平降低,但3-MT水平不变。3和27月龄大鼠皮质区域NE增加。DA代谢产物HVA和3-MT水平的变化表明,DA的释放在某些皮质区域随增龄增加。由此提示,单胺及其代谢产物在大鼠皮质区域并未完全呈年龄依赖性降低变化,但却是一个复杂的、区域特定性的变化。本研究结果表明,SAMP8海马组织间液中NE、DA及其代谢产物DOPAC和HVA、5-HT及其代谢产物5-HIAA水平的昼夜节律发生紊乱,增龄性变化与SAMR1基本相似,与上述研究结果不完全一致,可能原因是研究部位不同[20]。如有研究报道,年老大鼠和年轻大鼠相比,前额皮质和隔膜部位3,4-二羟苯基乙二醇(3,4-dihydroxyphenylglycol,MHPG)和MHPG/NE比例降低;隔膜部位DA和DOPAC水平增加,但DOPAC/DA比例降低。纹状体部位MHPG/NE比例增加,DOPAC水平增加,海马和丘脑部位5-HIAA水平增加,表明在衰老早期大脑单胺神经系统单胺类神经递质随部位选择性改变[21]。
已有多项研究结果表明,AD患者5-HT能、DA能和NE能系统发生异常改变,并导致记忆力减退、抑郁和注意力不集中[22-24]。β淀粉样前体蛋白(β-amyloid precursor protein,APP)/早老素1(presenilin 1,PS1)转基因小鼠是家族型AD的动物模型,Von Linstow等[25]以6,12,18和24月龄B6C3 WT小鼠及14和18月龄APP/PS1转基因小鼠为研究对象,通过HPLC方法检测新皮质区域、海马、纹状体、脑干和小脑部位5-HT,DA和NE含量。结果发现,WT小鼠随增龄单胺水平无变化,但18月龄转基因小鼠与WT小鼠相比,单胺水平呈区域特定性的改变,新皮质区域5-HT,DA和NE分别下降了30%,47%和32%;脑干部位5-HT增加了18%。新皮质区域,14月龄APP/PS1转基因小鼠与其WT小鼠相比,无显著性差异。同时发现,5-HT,DA和NE增龄性变化无显著性差异[25]。SAMP8是研究散发型AD发病机制的一个良好模型[1],为揭示其中枢学习记忆功能障碍的机制,本研究团队前期检测了脑组织裂解液中单胺类神经递质的水平,发现SAMP8多明显高于同龄SAMR1,且随增龄明显增高[5]。除此之外,目前尚未见对SAMP8脑内单胺类神经递质水平进行细致研究的报道。本研究系统研究了SAM小鼠海马组织间液中单胺类神经递质及其代谢产物水平的昼夜节律及增龄性变化,为该模型小鼠的进一步应用奠定了基础。

