异氟烷对糖尿病模型大鼠缺血再灌注肾损伤的保护作用及其机制
张 瑜,温 娟,聂 刚,李向云,唐慧菁
(1.中山大学附属第七医院皮肤科,广东 深圳 518000;2.中山大学附属第五医院内分泌科,广东 珠海 519000)
肾缺血再灌注(ischemia-reperfusion,I/R)损伤是糖尿病患者进行大中型手术术后较易出现的严重并发症,引起大范围肾小管上皮细胞坏死,肾功能严重受损,甚至引起肾功能衰竭并危及生命。糖尿病作为威胁人类健康常见病之一,全球患者将近5亿人,而我国有将近1亿糖尿病患者并逐年递增。且肾由于其含有丰富血管网络,较易出现I/R损伤,尤其是糖尿病患者易出现肾小血管病变,更易出现肾I/R损伤甚至急性肾衰[1-3]。由于糖尿病患者肾I/R损伤发病率极高,可引起严重并发症和极高死亡率[4-5]。研究表明,选择恰当麻醉药物对I/R损伤能起到有效预防作用。因此,探讨糖尿病肾I/R损伤发病机制及探索选择恰当的麻醉药物对预防糖尿病肾I/R损伤具有重要临床意义。
许多研究表明,炎症反应和细胞凋亡在肾I/R损伤中起着关键作用[6-8]。肾I/R损伤可引起炎症和凋亡信号通路的活化,而炎症和凋亡两者之间可能相互作用,从而使I/R损伤扩大化[9-12]。既往研究发现,异氟烷(isoflurane,Iso)麻醉预处理可对重要脏器(如大脑、心、肝和肾等)I/R损伤有重要的保护作用[13-19]。目前,糖尿病肾I/R损伤发病机制尚不完全明确,关于Iso与糖尿病肾I/R损伤保护的相关研究较少。因此,本课题组通过制备肾I/R模型,进一步探讨糖尿病肾I/R损伤发病机制及Iso在糖尿病模型大鼠I/R肾损伤中的影响及作用机制,为糖尿病患者进行大中型全麻手术如何选择恰当的麻醉药物提供一定的实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
链佐星(streptozotocin,STZ)购自美国Sigma-Aldrich公司;Iso购自美国Baxter公司;兔抗大鼠核因子-κB(nuclear factor-κB,NF-κB)多克隆抗体购自德国Merck Millopore公司;山羊抗大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)多克隆抗体购自美国R&D公司;免疫组化试剂盒购自美国R&D公司;PBS缓冲液购自中国福州迈新公司;Tris-EDTA修复液购自广州安必平公司。3.7 cm无创动脉夹购自中国上海金钟手术器械厂;动物麻醉仪器购自中国上海海瑞曼信息技术有限公司;Datex Ultima麻醉监测仪购自芬兰Datex有限公司;全自动生化测定仪购自日本HITACHI日立集团有限公司;血糖仪购自德国拜耳公司;显微镜购自日本Olympus公司;NIS元素成像软件4.10版购自日本东京尼康公司。
1.2 大鼠糖尿病肾l/R损伤模型制备和分组给药
清洁级雄性健康SD大鼠,体质量为180~200 g,购自中山大学实验动物中心并获得了伦理审批(SCXK(粵)2011-0029,饲养条件:在动物房通风、清洁环境下饲养,温度控制在18~26℃,相对湿度40~70%)。在清洁、通风环境下饲养2周。实验前禁食12 h,注射STZ 60 mg·kg-1制备糖尿病大鼠模型,72 h后大鼠尾静脉采血,用血糖仪测定血糖,空腹血糖>16.7 mol·L-1认为造模成功[20]。将糖尿病模型大鼠随机分为3组,每组8只:假手术组,肾I/R损伤组和2%Iso预处理30 min+I/R组。
制备肾I/R损伤模型[21]前复测大鼠体质量和血糖。大鼠腹腔注射10%水合氯醛(400 mg·kg-1)麻醉大鼠,并进行腹中线剖腹手术。将双侧肾蒂充分暴露后并使用非创伤性血管夹闭肾蒂45 min,当肾颜色由鲜红色变苍白色时,诱导缺血成功。45 min后移除非创伤性血管夹,当肾颜色从紫红色变为鲜红色时,视为成功恢复肾血流再灌注。逐层缝合手术切口后,大鼠自由进食和饮水。24 h后,麻醉状态下处死大鼠,采集血液和肾样本进行进一步分析。
Iso预处理组[22],先将密封麻醉的玻璃箱一端连接动物麻醉仪器,而另一端2个孔分别连接排气孔和Datex Ultima麻醉气体监测仪。玻璃箱底铺钠石灰并箱内灯泡加热以保证温度维持为35~37℃。将Iso气流设定为1 L·min-1。当Iso浓度稳定在2%时,将大鼠置箱中30 min。然后将大鼠中取出,置正常空气中洗脱10 min后再进行肾I/R损伤模型制作。
假手术组和肾I/R损伤组大鼠接受相同的手术方案,但假手术组仅分离但不夹闭肾蒂。
给药及检测时间点总结如下:①注射STZ 60 mg·kg-1制备糖尿病大鼠模型:实验前,大鼠禁食12 h;②72 h后:尾静脉采血测定血糖,空腹血糖≥16.7 mol·L-1认为糖尿病大鼠模型造模成功,然后进行肾I/R损伤模型制备,Iso组大鼠先用2%Iso预处理30 min,然后再进行手术。③肾I/R损伤模型制备后24 h,采集血液和肾组织标本,自动生化分析仪测定尿素氮(blood urea nitrogen,BUN)和肌酐(creatinine,Cr),HE染色检测肾病理和TUNEL染色检测肾小管上皮细胞凋亡,免疫组化检测TNF-α和NF-κB的表达。
1.3 采集血液和肾组织标本
从大鼠下腔静脉采集约5 mL血液,并将其加入抗凝管。将血样在室温下储存30 min,然后在3℃冰箱冷存过夜。使用自动生化分析仪测定BUN和Cr。采血后切除双侧肾。其中一份保存在10%甲醛溶液中,用于组织病理学检查。另一份在液氮中快速冷冻,并在-80℃下保存以供进一步分析。
1.4 HE染色检测肾组织病理变化
肾组织在95%乙醇中脱水,石蜡包埋并切片,用苏木精-伊红(HE)染色。每个样本随机选取10张肾组织照片(20倍物镜下拍摄),使用NIS元素成像软件4.10版评估肾小管损伤程度。肾小管损伤的严重程度按以下标准进行组织学分级(0~4分)[23]:0分,近曲小管细胞未见明显坏死;1分,单个近曲小管细胞坏死;2分,坏死涉及所有相邻近曲小管细胞;3分,远端近曲小管坏死,伴有肾皮质坏死;4分,所有肾小管坏死。
1.5 TUNEL染色检测肾小管上皮细胞凋亡
常规切片脱蜡并修复,滴加过氧化物酶灭活内源性酶,滴加TUNEL检测液,最后DAB显色,苏木精复染色。正常细胞颜色为蓝色,而肾小管上皮细胞TUNEL阳性凋亡细胞为棕褐色。每个样本随机选取5张肾组织照片(20倍物镜下拍摄),通过以下公式计算得出肾小管上皮细胞凋亡率:细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.6 免疫组化法检测TNF- α和NF-кB的表达
肾组织用石蜡包埋后切片,常规脱蜡,用Tris-EDTA抗原修复液促进抗原修复,用3%H2O2灭活内源性酶,分别滴加抗NF-кB抗体稀释液(1∶100)和抗TNF-α抗体稀释液(1∶50),在4℃培养过夜。PBS缓冲液洗涤后滴加R&D免疫组化试剂盒二抗,37℃恒温培养箱孵育1 h,PBS洗涤干净后滴加DAB溶液显色5~10 min,显微镜下掌握染色程度,自来水冲洗终止显色。苏木素复染1 min,待切片晾干后中性树脂封片。
采用免疫组化染色定量分析:每个样本随机选取10张肾组织照片(20倍物镜下拍摄),采用NISElements图片分析软件Version 4.10进行统计分析,以棕色区域面积与平均吸光度值两者之间乘积表示TNF-α和NF-кB的表达水平。
1.7 统计学分析
2 结果
2.1 lso对肾l/R损伤糖尿病模型大鼠体质量、血糖和肾功能指标的影响
3组大鼠体质量无显著性差异(表1)。糖尿病模型大鼠肾I/R组和Iso预处理组大鼠血糖高于假手术组(P<0.05),但糖尿病大鼠肾I/R组、Iso预处理组之间血糖无统计学差异。与假手术组相比,肾I/R组的BUN和Cr水平明显升高(P<0.01),说明糖尿病模型大鼠肾I/R模型制备成功。经过Iso预处理后,Iso预处理组的BUN和Cr水平较肾I/R组明显下降(P<0.01),提示Iso对糖尿病模型大鼠肾I/R损伤有保护作用。
2.2 lso对肾l/R损伤糖尿病模型大鼠肾组织病理变化的影响
与糖尿病模型大鼠假手术组比较,I/R组肾小管坏死程度明显(P<0.01)(图1);而Iso预处理组肾小管坏死程度明显低于肾I/R组(P<0.01)。提示糖尿病模型大鼠肾I/R损伤可引起肾小管上皮细胞明显坏死,而经过Iso预处理能明显抑制糖尿病模型大鼠肾I/R损伤引起肾小管坏死。
2.3 lso对肾l/R损伤糖尿病模型大鼠肾小管上皮细胞凋亡的影响
糖尿病模型大鼠肾I/R组TUNEL阳性凋亡细胞明显高于假手术组(P<0.01)(图2);Iso预处理组TUNEL阳性细胞数低于肾I/R组(P<0.01)。提示在糖尿病模型大鼠肾I/R损伤组中,TUNEL阳性细胞率明显升高;然而,Iso预处理显著降低糖尿病模型大鼠I/R肾小管上皮的凋亡。

Fig.1 Effect of isoflurane on renal histopathological changes in diabetic rats with renal l/R injury.See Tab.1 for the rat treatment.Different degrees of tubular dilation and necrosis were indicated by the black arrows.±s,n=8.**P<0.01,compared with sham group;##P<0.01,compared with renal I/R injury group.

Tab.1 Effects of isoflurane(lso)on physical,biochemical parameters and renal function in diabetic model rats with renal ischemia-reperfusion(l/R)injury

Fig.2 Effect of isoflurane on apoptosis of renal tubular epithelial cells in diabetic rats with renal l/R injury.See Tab.1 for the rat treatment.±s,n=8.**P<0.01,compared with sham group;##P<0.01,compared with I/R injury group.Apoptotic renal tubular epithelial cells were indicated by black arrows.
2.4 lso对肾l/R损伤糖尿病模型大鼠肾组织TNF- α和NF- κB表达水平的影响
TNF-α主要表达于肾小管上皮细胞的细胞质,而NF-κB阳性表达于细胞核和细胞质(图3)。与假手术组比较,糖尿病模型大鼠I/R组肾组织TNF-α和NF-кB表达明显升高(P<0.01);Iso预处理组TNF-α和NF-кB的表达明显低于I/R组(P<0.01)。表明糖尿病模型大鼠肾I/R损伤与TNF-α和NF-кB表达水平升高有关,Iso预处理能明显抑制TNF-α和NF-кB的表达。提示Iso对糖尿病模型大鼠肾I/R损伤的保护作用机制,可能是通过抑制TNF-α和NF-кB的表达而发挥保护作用。
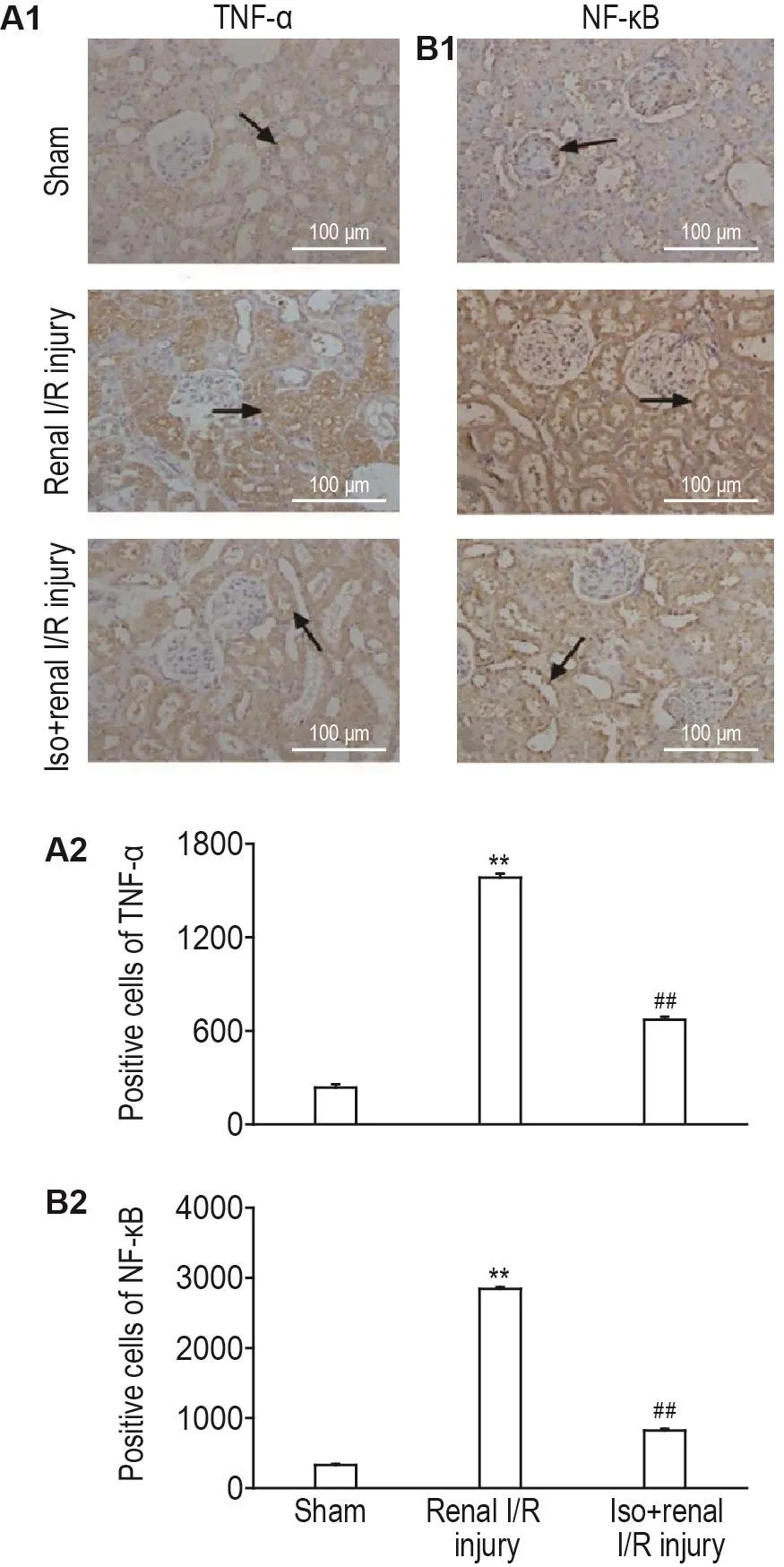
Fig.3 Effect of isoflurane on expressions of tumor necrosis- α(TNF- α)(A1,A2)and NF-кB(B1,B2)in renal tissue of diabetic rats with renal l/R injury.See Tab.1 for the rat treatment.±s,n=8,**P<0.01,compared with sham group;##P<0.01,compared with renal I/R injury group.TNF-α positive staining was expressed in tubular epithelial cell cytoplasm,and NF-кB positive staining was expressed in tubular epithelial cell nucleus and cytoplasm,as indicated by black arrows.
3 讨论
本研究结果表明,I/R可引起糖尿病模型大鼠肾损伤,而经过Iso预处理后对肾有保护作用,可降低BUN和Cr的水平,并抑制肾小管上皮细胞坏死和凋亡。糖尿病模型大鼠肾I/R损伤引起TNF-α和NF-кB表达水平明显升高,提示糖尿病模型大鼠肾I/R损伤与TNF-α和NF-кB表达升高有关;Iso预处理能明显抑制TNF-α和NF-кB的表达,提示Iso对糖尿病模型大鼠肾I/R损伤的保护作用机制可能是通过抑制TNF-α和NF-кB的表达而发挥保护作用。
值得注意的是,目前国内外关于糖尿病大鼠肾I/R损伤相关研究较少。既往研究表明,I/R损伤机制涉及多种因素,机制尚未完全明确,可能与大量氧自由基的产生、细胞内钙超载、线粒体凋亡、炎症因子的调控等有密切关系[24-25],I/R损伤产生的各种炎症介质可能与细胞凋亡相互作用,从而使凋亡信号转导通路逐渐放大,也使得缺血低氧性肾损伤的发生机制更为复杂。其中炎症反应和细胞凋亡是I/R损伤的重要机制[6-8]。既往有研究发现,肾I/R损伤与炎症因子有明确关系[26],NF-кB和TNF-α两者在炎症因子中起到关键主导作用[27]。研究结果表明,糖尿病模型大鼠肾I/R损伤引起肾小管上皮细胞凋亡增加、TNF-α和NF-кB表达水平明显升高,提示糖尿病模型大鼠肾I/R损伤发病机制与肾小管上皮细胞凋亡增加及TNF-α和NF-кB表达升高有关,研究结果与研究报道一致。
肾I/R损伤是糖尿病患者进行大中型手术较易出现的严重并发症之一,研究表明,选择恰当麻醉药物对I/R损伤能起到有效预防作用。Iso是一种吸入性全身麻醉药,目前在全身麻醉诱导和维持中得到广泛应用。通过Iso预处理,能保护肾或非肾器官免受I/R的损伤。既往研究表明,Iso预处理能抑制家兔心肌I/R损伤TNF-α和胱天蛋白酶3蛋白的表达,从而对家兔心肌I/R损伤起到保护心肌作用[28]。Iso对肠道I/R损伤有保护作用,机制主要是通过活化PPARγ进一步抑制TNF-α等炎症因子的表达而起到保护作用[29]。应用Iso麻醉对大鼠肝I/R损伤TNF-α相关系列炎症细胞因子和氧化应激有抑制作用,进而保护肝免受I/R的损伤[30]。另有研究发现,Iso预处理通过抑制IL-1,TNF-α和NF-кB等因子表达,进而通过抗炎症和抗凋亡作用改善大鼠肾I/R注损伤[31-32]。
本研究发现,Iso预处理可显著抑制BUN和Cr水平和肾小管上皮细胞坏死和凋亡,表明Iso预处理对糖尿病模型大鼠肾I/R损伤起到重要保护作用。糖尿病模型大鼠肾I/R损伤引起TNF-α和NF-кB表达水平升高,而经过Iso预处理能明显抑制TNF-α和NF-кB的表达,提示糖尿病模型大鼠肾I/R损伤发病机制与TNF-α和NF-кB表达升高有关,而Iso对糖尿病模型大鼠肾I/R损伤的保护作用机制,可能是通过抑制TNF-α和NF-кB的表达而起到保护作用。
综上所述,Iso对糖尿病模型大鼠I/R肾损伤具有保护作用,可显著降低BUN和Cr水平,并明显减少肾小管上皮细胞坏死与凋亡。糖尿病模型大鼠肾I/R损伤发病机制与TNF-α和NF-кB表达升高有关,Iso对糖尿病模型大鼠肾I/R损伤的保护作用机制,可能是其通过抑制TNF-α和NF-кB的表达而起到保护作用。糖尿病患者进行大中型手术可引起肾等器官发生I/R损伤,因此选择Iso作为麻醉药物,对预防肾等器官发生I/R损伤具有重要临床意义。

