姜黄素对H2O2诱导的HT29细胞氧化损伤的保护作用及机制研究
钟 宇,黄琼林,莫明明,杨青锦,蔡 春
广东医科大学分析中心, 湛江 524023
氧化应激是自由基在体内产生的一种负面作用,自由基又称游离基,是具有非偶电子的基团或原子。自由基的产生与清除,处于动态平衡中,产生的自由基量很少时,在体内可以调节细胞生长、基因表达、杀菌、调节血管舒缩状态,从而发挥重要的生理功能。然而自由基的产生与清除之间的平衡被打破,在人体内积累到一定量时,很容易与邻近细胞发生化学反应,使细胞结构受到破坏,造成细胞功能丧失、 基因突变、甚至死亡,最终引起氧化损伤相关疾病,如老年性痴呆、帕金森病、肿瘤及炎症等。研究发现氧化应激是炎症反应的一个重要病理过[1,2],氧化应激失衡在溃疡性结肠炎(UC)的发病及病理进程中发挥着至 关重要的作用[3-5],过度激活的氧化应激反应引起氧自由基大量表达,造成结肠组织细胞代谢障碍,肠黏膜屏障功能受损,最终导致肠道组织的慢性炎症反应[6,7]。
近年来,从天然药物中探寻具有清除自由基活性的高效低毒的天然抗氧化剂用于保护细胞免受氧化损伤成为研究热点[8]。姜黄素(curcumin)是一种相对分子质量低的多酚类化合物,主要来源于姜科植物郁金块根、姜黄根茎、 莪术根茎和天南星科植物菖蒲根茎等。具有抗炎、抗氧化、抗肿瘤、抗凝、抗肝纤维化、抗动脉粥样硬化等广泛的药理活性,且毒性低、不良反应小[9-11]。研究发现多种疾病的发生与自由基形成、炎症反应的参与有关,姜黄素抗氧化活性和抗炎作用已引起国内外学者的广泛关注。本研究利用H2O2诱导人HT29细胞氧化应激损伤模型,探讨姜黄素对HT29细胞的保护作用及其相关分子机制,以期为姜黄素的药理药效及临床应用提供科学依据。
1 材料与方法
1.1 细胞
HT29(人结肠癌细胞)购自美国ATCC公司。
1.2 试剂与仪器
RPMI-1640 培养基、0.25% EDTA-胰酶、抗青霉素/链霉素溶液、胎牛血清(美国Gibco公司); MTT粉剂(美国Sigma公司); FITC Annexin V Apoptisis Detection Kit、Cycletest Plus DNA Reagent kit(美国BD公司); caspase-3活性检测试剂盒、caspase-9活性检测试剂盒(北京索莱宝科技有限公司);乳酸脱氢酶(LDH)细胞毒性检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、活性氧检测试剂盒、BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF(碧云天生物技术有限公司);姜黄素标准品(上海源叶生物有限公司HPLC ≥98%)。酶标仪(瑞士Tecan公司);流式细胞分析仪(美国BD公司);化学发光成像仪(上海天能科技有限公司)。
1.3 实验方法
1.3.1 细胞培养
HT29细胞培养于含10% FBS、1%青链酶素双抗的RPMI-1640培养基中,37 ℃、5% CO2细胞培养箱内培养,2天传代1次。实验时将细胞接种于培养板中,待细胞进入对数生长期进行实验。
1.3.2 细胞用药配制
称取适量姜黄素,溶于DMSO配成100 mmol/L的储存液,并通过0.22 μm膜过滤除菌,使用前,用含10% FBS的RPMI-1640培养液配成不同浓度的工作液。
1.3.3 细胞损伤模型的建立
取对数生长期的细胞,制成单细胞悬液,调整细胞密度为5×104个/mL,按100 μL/孔接种于 96孔板中,放置于37 ℃、5%的CO2培养箱培养24 h。细胞贴壁,汇合度达到80%~90%,弃去培养基,加入用培养液稀释不同浓度的H2O2(0、25、50、100、200、 400、800、1 600 μmol/L), 设置空白组,空白组加入相同体积的培养液,每组设6个平行孔。 培养4,8,12,24 h后,每孔加 MTT(5 mg/mL)10 μL,置于37 ℃、5%的CO2孵箱中培养4 h后,每孔加100 μL的DMSO,震荡10 min,用酶标仪在490 nm处测定每孔OD值,计算细胞抑制率。
1.3.4 姜黄素给药剂量范围的确定
细胞铺板同上,置于37 ℃、5% 的CO2培养箱培养24 h。给予不同浓度的姜黄素(0、2.5、5、10、25、50、100、200 μmol/L),同时设DMSO组与空白组,DMSO组加入含0.1% DMSO的培养液培养细胞,空白组加入相同体积的培养液,每组设6个平行孔,继续培养24 h。MTT法检测不同浓度姜黄素对H2O2诱导的HT29细胞活力的影响。
1.3.5 姜黄素对H2O2诱导的HT29细胞氧化损伤保护作用研究的细胞分组及药物处理
取实验待用细胞分组为:①正常组(Control):加入完全培养基;②模型组(H2O2):加入终浓度为800 μmol/L的H2O2处理细胞 24 h;③姜黄素低剂量组(Cur-1)、中剂量组(Cur-2)、高剂量组(Cur-3):细胞贴壁后,终浓度分别为2.5、5、10 μmol/L姜黄素预处理6 h后,再加入终浓度为800 μmol/L的H2O2,作用24 h。
1.3.6 姜黄素对H2O2诱导的HT29细胞毒性的影响
细胞接种于96孔板中,放置于37 ℃、5% 的CO2培养箱培养24 h。细胞分组及药物处理同“1.3.5”,MTT法检测姜黄素对H2O2诱导HT29细胞毒性的影响。
1.3.7 Annexin/PI双标记法检测HT29细胞凋亡
细胞接种于6孔板中,细胞分组及药物处理同“1.3.5”。收集细胞和上清液,用PBS轻洗2次;1 000 rpm 离心 5 min, 弃上清,加入适量1×Binding Buffer重悬细胞,使细胞密度大约为1×106个/mL。加入5 μL Annexin V-FITC避光染色15 min,再加入5 μL PI于室温下避光孵育5 min;流式细胞仪检测荧光强度。
1.3.8 PI染色分析HT29细胞周期
细胞接种于6孔板中,细胞分组及药物处理同“1.3.5”。收集细胞,预冷的70%乙醇固定, 4 ℃过夜。弃去乙醇, PBS清洗2次,加入0.5 mL含10 μL碘化丙啶及10 μL RNase的染色缓冲液悬浮细胞,避光孵育30 min,流式细胞仪检测。
1.3.9 细胞内ROS和线粒体膜电位检测
细胞接种于6孔板中,细胞分组及药物处理同“1.3.5”。收集细胞,按试剂盒说明书步骤操作,流式细胞仪检测细胞内ROS水平和线粒体膜电位。
1.3.10 LDH漏出量的检测
细胞接种于96孔板中,细胞分组及药物处理同“1.3.5”,设空白对照孔,孵育结束,取各孔上清120 μL 至新的96孔板中,加60 μL配好的LDH检测工作液,室温避光孵育30 min后,用酶标仪在490 nm处测定OD值,按照试剂说明书计算酶释放量百分数。
1.3.11 细胞内SOD,MDA水平和caspase-3,caspase-9酶活性的检测
细胞接种于6孔板中,细胞分组及药物处理同“1.3.5”。收集细胞,用预冷的PBS洗涤2次,裂解细胞,离心取上清液,另取少量样品上清用Bradford法测定蛋白浓度,按试剂盒说明书操作,酶标仪检测细胞内SOD,MDA水平和caspase-3,caspase-9活性。
1.3.12 统计学分析
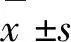
2 结果
2.1 细胞损伤模型的建立
如图1所示,与正常对照组比较,H2O2终浓度为800 μmol/L,作用时间4、8、12、24 h细胞抑制率分别为22.91%、26.12%、30.30%、36.64%。确定H2O2诱导细胞损伤的终浓度为800 μmol/L,作用时间为24 h。
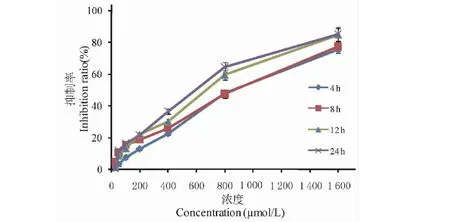
图1 MTT 法检测H2O2对HT29细胞活力的影响Fig.1 Effect of H2O2 on cell viability in HT29 cells
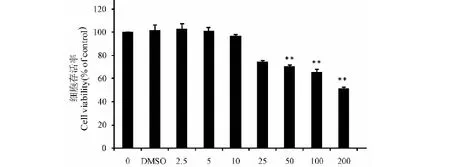
图2 MTT法检测姜黄素对HT29细胞活性的影响Fig.2 Effect of curcumin on cell viability in HT29 cells by MTT 注:与对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
2.2 姜黄素对HT29细胞活力的影响
在正常细胞中,给予不同浓度的姜黄素(0、2.5、5、10、25、50、100、200 μmol/L)单独作用细胞24 h。MTT结果表明,与不加姜黄素的正常对照组比,姜黄素在2.5~10 μmol/L范围内对细胞无毒性;此外,0.1% DMSO对细胞也无毒性(图 2)。

图3 姜黄素对H2O2诱导的HT29细胞活性的影响Fig.3 Effect of curcumin on cell death in H2O2-induced HT29 注:与对照组比较,**P<0.01;与 H2O2 组比较,#P<0.05,##P<0.01。Note:Compared with the control group,**P<0.01;compared with the H2O2 group,#P<0.05,##P<0.01.
2.3 姜黄素对H2O2损伤HT29细胞活力的影响
与正常对照组相比,H2O2模型组细胞活力显著降低(P<0.01),姜黄素组(2.5、5、10 μmol/L)细胞活力明显高于H2O2模型组(P<0.05,P<0.01),且呈剂量依赖关系(图 3)。
2.4 姜黄素对H2O2诱导的HT29细胞凋亡的影响
流式细胞仪检测结果显示(图4),H2O2模型组细胞凋亡率较正常对照组显著增加(P<0.01);姜黄素组(2.5、5、10 μmol/L)细胞凋亡率显著低于H2O2模型组(P<0.01),并呈剂量依赖性抑制凋亡的增加。
2.5 姜黄素对H2O2诱导的HT29细胞周期的影响
与对照组比较(图5),H2O2模型组G0/G1期所占百分比例显著升高(P<0.01), S期所占百分比例显著降低(P<0.01);与H2O2模型组相比,姜黄素组(2.5、5、10 μmol/L)G0/G1期所占百分比例明显减少(P<0.01,P<0.05),S期所占百分比例明显增加(P<0.01,P<0.05)。

图4 姜黄素对H2O2诱导的HT29细胞凋亡的影响Fig.4 Effect curcumin on apoptosis in H2O2-induced HT29 注:与对照组比较,**P<0.01;与 H2O2 组比较,# P<0.05,##P<0.01。Note:Compared with the control group,**P<0.01;compared with the H2O2 group,##P<0.01.
2.6 姜黄素对H2O2导致的胞内ROS水平和线粒体膜电位的影响
如图6所示,与正常对照组比较,H2O2模型组 ROS水平显著增高(P<0.01),线粒体膜电位显著降低(P<0.01);与H2O2模型组比较,姜黄素组(2.5、5、10 μmol/L)剂量依赖性抑制H2O2导致的胞内ROS水平升高(P<0.01,P<0.05),线粒体膜电位剂量依赖性升高(P<0.01)。
2.7 姜黄素对H2O2损伤HT29细胞内LDH漏出率的影响
如图7所示,H2O2模型组LDH释放量显著高于正常对照组(P<0.01);姜黄素高、中剂量组LDH释放量较H2O2模型组降低(P<0.05,P<0.01)。

图5 姜黄素对H2O2诱导的HT29细胞凋亡的影响Fig.5 Effect of curcumin on cell cycle in H2O2-induced HT29 注:与对照组比较,*P<0.05,**P<0.01;与 H2O2 组比较,#P<0.05,##P<0.01。Note:Compared with the control group,*P<0.05,**P<0.01;compared with the H2O2 group,#P<0.05,##P<0.01.

图6 姜黄素对H2O2诱导的HT29细胞内ROS水平和线粒体膜电位的影响Fig.6 Effect of curcumin on the level of ROS and mitochondrial membrane potential in H2O2-induced HT29 注:与对照组比较,**P<0.01;与 H2O2 组比较,#P<0.05,##P<0.01。Note:Compared with the control group,**P<0.01;compared with the H2O2 group,#P<0.05,##P<0.01.
2.8 姜黄素对H2O2诱导的HT29细胞内SOD,MDA水平和caspase-3,caspase-9酶活性的影响
与对照组比较, H2O2模型组中SOD显著下降(P<0.01),MDA显著升高(P<0.01),caspase-3和caspase-9的活性均明显增加(P<0.01);与H2O2模型组相比,不同浓度姜黄素预处理组SOD明显恢复(P<0.01),MDA明显被抑制(P<0.01),caspase-3和caspase-9活性均显著降低(P<0.01),且在2.5~10 μmol/L浓度范围呈剂量依赖关系(见图8)。
3 讨论
本实验通过研究姜黄素对H2O2诱导HT29细胞氧化应激的影响,探讨其作用的分子机制。首先通过H2O2诱导HT29细胞建立体外氧化应激模型。为了确定姜黄素对HT29细胞作用的无毒剂量范围,通过MTT实验,确定低中高三个剂量(2.5、5、10 μmol/L)的姜黄素进行后续的研究。姜黄素组能上调H2O2诱导的HT29细胞的存活率,降低细胞凋亡。 H2O2模型组阻滞细胞于G0/G1期;姜黄素组G0/G1期细胞明显减少,S期细胞增加。提示该剂量范围内的姜黄素对H2O2诱导的HT29细胞氧化损伤的保护作用可能与抑制H2O2诱导的DNA损伤有关。
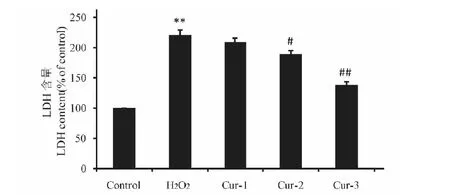
图7 姜黄素对H2O2诱导的HT29细胞内LDH漏出率的影响Fig.7 Effect of curcumin on the releasing rate of LDH in H2O2-induced HT29 注:与对照组比较,**P<0.01;与 H2O2 组比较,#P<0.05,##P<0.01。Note:Compared with the control group,**P<0.01;compared with the H2O2 group,#P<0.05,##P<0.01.
活性氧(ROS)是造成DNA氧化损伤的主要原因之一,也是机体内主要的氧化剂,正常生理条件下,SOD等体内的抗氧化剂能清除ROS,使ROS的产生和清除处于动态平衡状态[12]。细胞受到损伤后,细胞内生成大量ROS,引发细胞膜上脂质过氧化反应,生成终产物MDA;MDA 可破坏组织细胞膜结构,导致受损的细胞膜通透性增强,LDH等胞内酶大量漏出[13],LDH是细胞膜完整性的重要指标,细胞在氧化损伤过程中会将细胞内的LDH释放到培养液中,所以培养液中LDH活性大小可反映细胞的死亡或损伤程度。本研究结果显示,H2O2模型组ROS,LDH显著升高,SOD活性降低,MDA活性提高,表明H2O2诱导细胞膜结构受损,造成抗氧化系统功能减弱,清除氧自由基能力下降;与H2O2模型组比较,姜黄素组ROS,LDH显著降低, SOD活性明显恢复,MDA活性明显受到抑制,提示姜黄素具有明显的抗氧化生物学活性,对H2O2导致的 HT29细胞氧化损伤的保护作用可能与清除ROS有关。
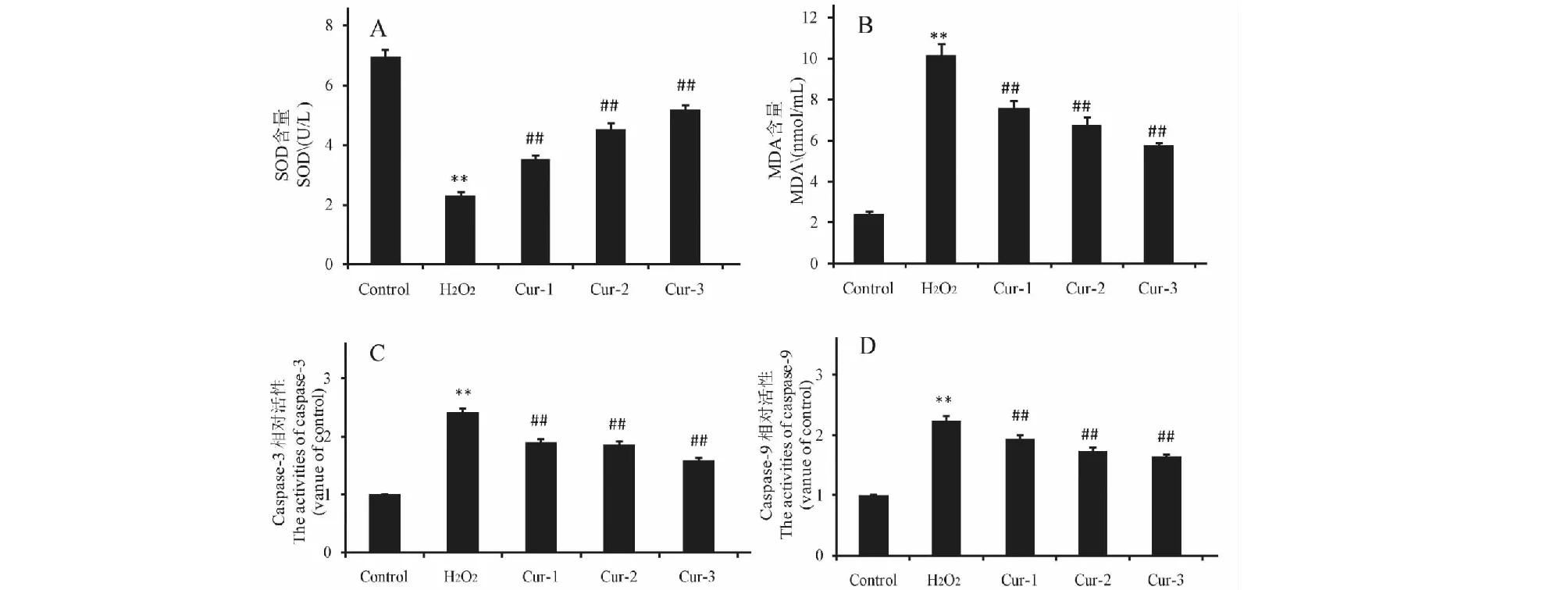
图8 姜黄素对H2O2诱导的细胞内SOD,MDA水平和caspase-3,caspase-9酶活性的影响Fig.8 Effect of curcumin on the level of SOD,MDA,and the activities of caspase-3,caspase-9 注:与对照组比较,**P<0.01;与 H2O2 组比较, ##P<0.01。Note:Compared with the control group,**P<0.01;compared with the H2O2 group,##P<0.01.
线粒体是细胞的能量工厂,也是自由基最重要的来源, ROS可以通过多条途径对线粒体造成损伤。本实验中H2O2模型组线粒体膜电位较正常组显著降低,姜黄素预处理组能显著抑制 H2O2造成的线粒体膜电位的下降。表明2.5~10 μmol/L剂量范围内的姜黄素对H2O2诱导的HT29细胞氧化损伤的保护作用可能与线粒体途径有关。
目前认为线粒体通路、死亡受体通路和内质网通路是细胞凋亡的三个主要凋亡信号通路, caspase-3是这些凋亡信号通路的执行者[14]。caspase-9是凋亡信号转导过程中重要的上游 caspase。在线粒体通路中,活化的caspase-9可以激活caspase-3,引起细胞凋亡[15,16]。本研究通过对caspase-3和caspase-9酶活性进行检测,发现姜黄素组能显著下调 caspase-3和caspase-9 的活性,提示姜黄素对H2O2诱导的HT29细胞氧化损伤的保护作用可能与线粒体介导的凋亡途径有关。
综上所述,2.5~10 μmol/L剂量范围的姜黄素对H2O2诱导的 HT29细胞氧化应激损伤具有较好的保护作用,其机制可能是通过抗氧化,改变细胞周期分布,减轻DNA氧化损伤,改善线粒体功能,下调诱导细胞凋亡的线粒体通路,从而发挥保护作用,修复H2O2诱导的氧化损伤。

