糖尿病大鼠肠黏膜屏障损伤检测方法的评价及蜂胶降糖作用的探讨
刘 颖,常志尚,徐宏伟,薛美兰,李瑞英,梁 惠*
(青岛大学1. 基础医学院,山东 青岛 266071;2. 生物医学公共支撑平台,山东 青岛 266021;3. 公共卫生学院,山东 青岛 266021)
糖尿病是一种以空腹血糖及糖化血红蛋白异常升高为主要表现的慢性代谢性疾病。多项研究证实,肠黏膜屏障损伤与糖尿病的发生发展密切相关[1-2]。因此,修复肠黏膜损伤可望作为新的作用靶点用于糖尿病防治[3],而针对肠黏膜屏障检测方法的选择,则成为降糖药物改善肠黏膜屏障及其机制研究不可或缺的重要环节。目前,肠黏膜屏障检测方法主要包括肠上皮细胞连接装置超微结构观察、紧密连接相关蛋白表达水平检测[4]及肠道屏障功能血清学指标检测[5]等,但其反映肠黏膜损伤及疗效评价的灵敏性却不尽相同。蜂胶是一种富含黄酮、萜烯等多种生物活性成分的天然产物[6],动物实验和人群研究均表明,蜂胶具有降血糖作用[7],但尚不清楚蜂胶的降糖作用是否与其对肠黏膜损伤的修复作用有关。本研究旨在以糖尿病大鼠为研究对象,对上述各种肠黏膜屏障功能检测方法进行分析评价,为蜂胶降糖的肠黏膜损伤修复机制研究提供灵敏可靠的实验手段。
1 材料和方法
1.1 实验动物
6周龄SPF级雄性SD大鼠48只,160 ~ 180 g,由北京维通利华实验动物技术有限公司提供[SCXK (京) 2016-0006]。大鼠饲养于青岛大学附属医院实验动物中心[SYXK (鲁) 2015 - 0003],各组大鼠自由进食和饮水,鼠房环境保持温度(22 ± 2)℃,相对湿度50% ~ 60%,每小时换气5次,12 h光照/黑暗交替。本实验获得青岛大学实验动物伦理委员会的批准(2014审字第09),并按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
蜂胶(每100 g中含总黄酮≥3.2 g),由北京中国农业科学院蜜蜂研究所提供;链脲佐菌素(STZ)及PVDF膜均购自北京 Solarbio科技有限公司;D-乳酸及连蛋白ELISA检测试剂盒(美国Cloud-Clone Corp公司);组织蛋白提取试剂盒购自美国Pierce Biotechnology公司;蛋白检测试剂盒购自美国Bio-Rad公司;Claudin、occludin及ZO-1抗体均购自美国Cell Signaling Technology公司,其相应二抗均购自美国Zymed Laboratories公司;β-actin抗体及其二抗、化学发光试剂盒,均购自美国Santa Cruz公司;高脂饲料(猪油10%,蔗糖20%,蛋黄粉15%,胆固醇1.2%,猪胆盐0.2%,鼠维持饲料53.6%,均为国产)。Accu-Chek Performa 罗氏卓越血糖仪、血糖检测试纸,均购自上海罗氏检测产品有限公司; TRANS-BLOT SD电转膜仪及Variant II糖化血红蛋白仪均购自美国Bio-Rad公司; DYY-60电泳仪(北京六一仪器厂); JEM 1200型电子透射显微镜(日本JEOL);RM 2135型石蜡切片机(德国LEICA);ELx808型酶标仪(美国BioTek); GDS-8000凝胶成像分析系统(美国UVP)。
1.3 实验方法
1.3.1 模型建立与分组
适应性喂养1周后,各组大鼠禁食不禁水12 h,采用罗氏血糖仪检测尾血血糖作为基础血糖。依据基础血糖值将大鼠随机分为4组(n=12/组),包括正常对照组、糖尿病模型组、80 mg/kg和160 mg/kg蜂胶干预组。模型组及各蜂胶干预组喂食高糖高脂饲料,正常对照组喂食普通饲料,持续3周。模型组及各蜂胶干预组腹腔注射1% STZ溶液40 mg/kg,正常对照组腹腔注射相应剂量柠檬酸缓冲液。1周后检测尾血血糖,血糖值>11.1 mmol/L作为成模大鼠。蜂胶干预组分别以80 mg/kg及160 mg/kg 蜂胶灌胃成模大鼠,模型组及正常对照组灌以相应剂量大豆油,各组继续喂食相应饲料,持续4周。大鼠组织取材于青岛大学附属医院实验动物中心动物实验设施内进行[SYXK(鲁)2015-0003]。禁食不禁水12 h后,检测大鼠尾血血糖,30%乌拉坦麻醉,腹主动脉取血,同时留取回肠及结肠组织,用于后续实验。
1.3.2 血糖(FBG)及糖化血红和蛋白(HbA1c)水平检测
采用罗氏卓越血糖仪检测尾血血糖,采用高效液相色谱法检测HbA1c含量,严格按照说明书操作。实验重复3次。
1.3.3 血清学指标检测
采用ELISA实验检测血浆D-乳酸(D-LA)及连蛋白(zonulin)含量,每个样品设3个复孔。严格按照试剂盒说明书操作。
1.3.4 回肠及结肠黏膜上皮细胞连接装置超微结构观察
迅速留取大鼠回肠及结肠1 mm×2 mm组织块,生理盐水漂洗,2.5%戊二醛溶液固定24 h。PBS(pH=7.2)漂洗3次,1%锇酸固定80 min,双蒸水漂洗,梯度丙酮脱水,环氧树脂包埋,50 nm~70 nm厚度切片,3% 醋酸双氧铀和柠檬酸铅分别染色30 min及15 min,双蒸水冲洗,透射电镜观察。每组观察5张切片,每张切片观察5个视野。
1.3.5 Western blot检测回肠及结肠组织紧密连接相关蛋白表达水平
(1)蛋白质样品的制备、电泳和转膜:称取回肠及结肠组织,采用组织蛋白提取试剂制成1∶5(质量浓度)的匀浆,12 000 r/min 4℃离心20 min提取上清液,采用蛋白检测试剂盒对蛋白浓度进行定量测定,严格按照试剂盒说明书操作。以20 μg蛋白/泳道上样,采用10% SDS-PAGE凝胶进行电泳,浓缩胶电压80 V,进入分离胶后将电压提高到120 V,至溴酚蓝到达分离胶底部即终止电泳。甲醇活化PVDF膜,按照从阴极到阳极依次为:滤纸、凝胶、PVDF膜、滤纸的顺序组装转印三明治,将其放入转膜仪中,恒压10 V,转膜1 h,将蛋白样品转移至PVDF膜上。
(2)样品封闭、抗体孵育及图像分析:将电转完毕的PVDF膜标记后,用含 5%脱脂牛奶的TBST缓冲液封闭 1 h。洗膜后加入claudin、occludin及ZO-1抗体4℃孵育过夜。采用TBS缓冲液洗膜3次,加入相应二抗室温孵育1 h,同时设β-actin为内参照。再次采用TBS缓冲液洗膜3次,通过化学发光试剂盒对蛋白样品进行曝光处理,严格按照试剂盒说明书操作。对胶片进行显影、定影后,采用UVP GDS-8000凝胶成像分析系统对目标蛋白光密度值进行检测,以目的蛋白与内参β-actin蛋白的光密度比值作为目的蛋白的相对表达量。实验重复3次。
1.4 统计学方法
采用SPSS 17.0统计软件进行数据统计分析,多组比较采用单因素方差分析,P<0.05被认为有统计学意义。
2 结果
2.1 蜂胶对糖尿病大鼠血糖水平的影响
结果显示,模型组大鼠血糖及HbA1c含量明显升高,分别达到正常对照组的5.92倍和2.59倍,经统计学处理,具有显著性差异(P<0.05)。补充80 mg/kg及160 mg/kg蜂胶后,大鼠血糖水平分别较模型组降低了35.9%和33.4%;HbA1c含量也分别降低了20.9%和27.3%,均具有显著性差异(P<0.05)。但各干预组间比较,均未见显著性差异 (P>0.05)。见表1。
2.2 蜂胶对糖尿病大鼠肠黏膜屏障血清学检测指标的影响
结果显示,与正常对照组比较,模型组血浆D-乳酸及连蛋白含量均有所升高,而80 mg/kg及160 mg/kg蜂胶补充使血浆D-乳酸及连蛋白含量均有不同程度降低,但经统计学处理,各组间均未见显著性差异(P>0.05)。见表2。
2.3 蜂胶对糖尿病大鼠肠黏膜上皮细胞连接装置超微结构的影响
结果显示,正常对照组大鼠回肠及结肠组织上皮细胞连接装置超微结构正常,无间隙增宽等异常表现。模型组大鼠与正常对照组比较,其回肠及结肠组织紧密连接、黏着连接、缝隙连接等细胞间连接装置出现结构松弛,电子密度降低及间隙增宽现象。蜂胶干预后,回肠及结肠组织上述细胞间连接装置较模型组均发生不同程度改善,间隙变窄,与正常对照组接近。见图1、图2。

表1 蜂胶对糖尿病大鼠血糖水平的影响
注:与正常对照组比较,*P< 0.05;与模型组比较,△P< 0.05。
Note. Compared with the control group,*P< 0.05. Compared with the model group,△P< 0.05.

表2 蜂胶对糖尿病大鼠肠黏膜屏障血清学检测指标的影响

注:a: 正常对照组; b:模型组; c: 80 mg/kg蜂胶干预组; d: 160 mg/kg 蜂胶干预组。TJ:紧密连接;AJ:黏着连接;DS:桥粒。图2 蜂胶对糖尿病大鼠结肠黏膜上皮细胞连接装置超微结构的影响 (透射电镜,× 50 000)Note. a: Control. b: Model. c: 80 mg/kg Propolis. d: 160 mg/kg propolis. TJ: Tight junctions.AJ: Adherens junctions.DS: Desmosomes.Figure 2 Effects of propolis on the ultrastructure of colonic mucosal epithelial cells in diabetic rats (transmission electron microscopy, × 50 000)
2.4 蜂胶对糖尿病大鼠回肠组织紧密连接相关蛋白表达水平的影响
Western blot结果显示,模型组回肠组织中claudin-1、occludin、ZO-1蛋白表达水平均较正常对照组显著降低(P<0.05)。80、160 mg/kg蜂胶干预组回肠组织中claudin-1、occludin、ZO-1蛋白表达水平均较模型组明显升高,且具有剂量依赖性(P<0.05)。见图3。

注:1: 正常对照组; 2:模型组; 3: 80 mg/kg蜂胶干预组; 4: 160 mg/kg 蜂胶干预组。*P<0.05 vs正常对照组;△P<0.05 vs 模型组;#P<0.05 vs 80 mg/kg 蜂胶干预组。图3 蜂胶对糖尿病大鼠回肠组织紧密连接相关蛋白表达水平的影响Note. 1: Control. 2: Model. 3: 80 mg/kg propolis. 4: 160 mg/kg propolis. *P<0.05 vs control.△P<0.05 vs model.#P<0.05 vs 80 mg/kg Propolis.Figure 3 Effects of propolis on the expression level of proteins related to the tight junction between ileum epithelial cells of diabetic rats
2.5 蜂胶对糖尿病大鼠结肠组织紧密连接相关蛋白表达水平的影响
Western blot结果显示,模型组结肠组织中claudin-1、occludin、ZO-1蛋白表达水平均较正常对照组显著降低(P<0.05)。80 mg/kg蜂胶干预组结肠组织中claudin-1蛋白及160 mg/kg蜂胶干预组claudin-1、occludin和ZO-1蛋白表达水平均较模型组明显升高,其中,ZO-1蛋白表达水平在两干预组间存在剂量依赖性(P<0.05)。其余各组间比较,均无显著性差异(P>0.05)。见图4。
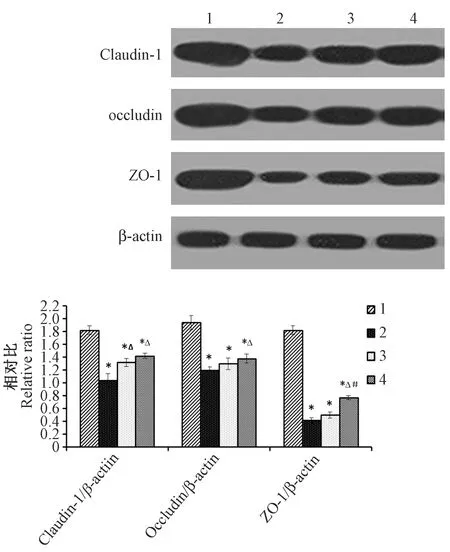
注:1: 正常对照组; 2:模型组; 3: 80 mg/kg蜂胶干预组; 4: 160 mg/kg 蜂胶干预组。*P<0.05 vs正常对照组;△P<0.05 vs 模型组;#P<0.05 vs 80 mg/kg 蜂胶干预组。图4 蜂胶对糖尿病大鼠结肠组织紧密连接相关蛋白表达水平的影响Note. 1: Control; 2: Model; 3: 80 mg/kg Propolis; 4: 160 mg/kg Propolis. *P<0.05 vs Control;△P<0.05 vs Model;#P<0.05 vs 80 mg/kg Propolis.Figure 4 Effects of propolis on the expression level of proteins related to the tight junction between the colonic epithelial cells in diabetic rats
3 讨论
本研究通过高糖高脂饮食联合STZ腹腔注射的方法成功建立了糖尿病大鼠模型,并通过蜂胶补充,有效控制了糖尿病大鼠血糖及糖化血红蛋白水平,表明蜂胶具有良好的降血糖效果,与相关报道一致[7-8]。随后,本实验采用超微结构观察、Western blotting及血清学检测三种实验方法,从不同角度对糖尿病大鼠肠黏膜屏障损伤状况进行评价和分析,以期获得敏感可靠的肠黏膜屏障功能检测方法,用于蜂胶降糖作用的肠黏膜屏障修复机制研究。
国内外多项研究显示,肠黏膜屏障完整性破坏在糖尿病的发生发展过程中发挥重要作用[9]。 Zhong等[1]对38例2型糖尿病患者和152例非糖尿病患者进行比较发现,2型糖尿病患者小肠绒毛性水肿的发生率高达78.9%,Lewis评分也显著高于非糖尿病患者。Horton等[10]采用口服51Cr-EDTA的方法对20例2型糖尿病患者进行检查,发现其肠道渗透性均异常增高。Lee等[11]的研究则显示,非肥胖型糖尿病(NOD)小鼠在感染具有肠黏膜屏障破坏能力的野生型C.rodentium菌株后,不仅其肠黏膜屏障遭到破坏,同时,其胰岛炎症也呈现快速发展趋势。以上人群研究及动物实验均表明,肠黏膜屏障损伤参与了糖尿病的发生发展并发挥关键作用,它也因此成为药物降糖潜在的作用靶点。
本研究透射电镜结果发现,糖尿病大鼠回肠及结肠组织上皮细胞紧密连接及黏着连接发生间隙增宽、密度降低等不同程度异常改变,蜂胶补充有效改善了其紧密连接等细胞连接装置损伤状况,并具有一定剂量依赖性。紧密连接位于上皮细胞基底外侧膜顶端,是肠黏膜上皮细胞间最主要的连接方式,与黏着连接、桥粒、缝隙连接等共同构成细胞间连接装置,在封闭细胞间隙,维持肠黏膜屏障结构与功能完整性方面发挥决定性作用[12]。本研究结果表明,肠黏膜细胞连接超微结构观察对于糖尿病大鼠肠黏膜屏障功能检测具有较高的灵敏性,可用于降糖药物的肠黏膜损伤修复疗效观察。
Western blotting结果发现, 糖尿病大鼠回肠和结肠组织中claudin-1、occludin及ZO-1等紧密连接相关蛋白表达水平均发生不同程度下调,补充蜂胶后,其下调状况得到有效缓解和控制,且随着蜂胶剂量的增加,改善效果尤为明显。Claudin-1和occludin是紧密连接中最主要的跨膜蛋白,也是参与肠黏膜屏障功能调节的主要功能蛋白。它们在胞外与跨膜蛋白相互作用,在胞内则通过支架蛋白ZO-1与肌动蛋白等胞内蛋白相互联系。这种由多种跨膜蛋白及粘附分子组成的“拉链样”结构,环绕整个细胞呈带状分布,共同构成细胞间稳定的紧密连接体系[13]。多项研究指出,紧密连接相关蛋白表达水平降低可造成紧密连接崩解断裂,导致肠黏膜屏障结构与功能损伤;上调肠黏膜紧密连接相关蛋白表达,可使肠黏膜损伤得到修复,缓解疾病进程[14-15],本研究Western blotting与透射电镜结果相互印证,得到了较为一致的结论,表明将紧密连接相关蛋白表达水平检测用于糖尿病大鼠肠黏膜损伤状况评价亦具有较高的灵敏性,可作为药物降糖的肠黏膜屏障修复机制研究较为可靠的实验手段之一。
D-乳酸是肠道细菌代谢产物,当肠道屏障遭到破坏时,D-乳酸可通过受损黏膜渗透入血,使循环血中D-乳酸含量升高;连蛋白是紧密连接通路重要蛋白,当肠黏膜通透性升高时,连蛋白亦可释放入血,引起血液中连蛋白水平增高,二者可在一定程度上反映肠道屏障损伤状况[5]。而本研究血清学检测结果发现,血浆D-乳酸和连蛋白水平在各组大鼠间均无显著性差别,与透射电镜及Western blotting检测结果存在不一致性。表明作为降糖药物肠黏膜修复疗效评价手段,肠黏膜屏障超微结构观察及紧密连接相关蛋白表达水平检测的灵敏性可能更优于肠道屏障功能血清学检测。
此外,本实验针对肠黏膜屏障功能检测方法的比较分析并不全面,其他多种肠黏膜屏障功能检测方法,如血浆内毒素检测、胃肠黏膜pH值测定、酚黄酞测定及肠型脂肪酸结合蛋白含量检测等尚未被涉及,将在以后的实验中加以完善和补充。
总之,肠黏膜屏障超微结构观察及紧密连接相关蛋白表达水平检测能较好反映糖尿病大鼠肠黏膜屏障损伤状况,较血清学检测具有更高的灵敏性,可成为降糖药物肠黏膜屏障修复机制研究可靠的实验手段。同时,蜂胶降糖作用也与其调节紧密连接相关蛋白表达,修复肠黏膜损伤有关。
(致谢:本实验得到青岛大学医学院医学营养研究所的大力支持,感谢实验室全体老师对本实验的帮助。)

