高脂食物和K/BxN血清对ApoE基因敲除小鼠免疫系统的影响
石 娜,张抒扬,牛海涛*
(1. 国家卫生健康委员会人类疾病比较医学重点实验室(中国医学科学院医学实验动物研究所),新发再发传染病动物模型研究北京市重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心,国家中医药管理局人类疾病动物模型三级实验室,北京 100021;2. 北京协和医院,北京 100010)
心血管疾病是世界上导致成年人死亡的主要疾病[1],动脉粥样硬化(动脉硬化)是引起心血管疾病的主要原因,动脉硬化是一种渐进性的慢性炎症,通过固有免疫系统和适应性免疫系统参与斑块的产生、发展、稳定和破裂[2]。动脉硬化由多种细胞亚型和细胞因子相互作用产生[3-4],巨噬细胞在动脉硬化斑块的病理生理学中起重要作用[5]。内皮下单核巨噬细胞使动脉硬化不断发展,循环的单核细胞吸附在激活的动脉内皮细胞上,再迁移到内皮下,在生长因子的作用下分化成为巨噬细胞。巨噬细胞在脂质吸收、抗原呈递、清除死细胞、细胞因子生成等动脉硬化的发展和消退过程中起重要作用[6]。位于斑块内的巨噬细胞是动态平衡的,巨噬细胞的数量和炎症状态影响斑块的发展[7],而且有研究发现巨噬细胞的缺失能显著减少小鼠动脉硬化的产生[8]。
类风湿关节炎(RA)是一种慢性自身免疫性疾病,其特征是产生系统性炎症和自身免疫性抗体[9]。RA由遗传基因和环境因素共同作用所引起,研究表明,抗原蛋白或多肽的瓜氨酸化与RA发病有关,瓜氨酸化是RA特异性抗原被抗体识别的必要条件[10],RA患者血清中存在抗瓜氨酸多肽抗体。环境因素和易感基因相互作用后,促进转录后调控的改变,引起自体蛋白瓜氨酸化。机体通过打破对含有瓜氨酸残基自体蛋白的免疫耐受,激活自身免疫反应。随后,炎症反应转移到关节部位,引起滑膜炎和关节结构的损伤。这一过程涉及的免疫反应有:固有免疫、适应性免疫、炎症及组织应答,但机理仍不明确[11]。
注射K/BxN血清引起的关节炎动物模型对RA研究有十分重要的意义,白细胞介素1(IL-1)、肿瘤坏死因子(TNF)和集落刺激因子(GM-CSF)都在发病中起重要的作用[12],巨噬细胞和中性粒细胞在促进关节炎的发展中起关键作用,RA患者炎性滑液中巨噬细胞和中性粒细胞数量增加[13]。K/BxN血清来源于抗6-磷酸葡萄糖异构酶(glucose-6-phosphate isomerase,GPI)抗体呈阳性的K/BxN小鼠,K/BxN小鼠由KRN雄鼠和NOD/LtJ雌鼠杂交所得,其血液中含有致病性自身抗体GPI,抗GPI抗体与GPI抗原结合形成免疫复合物,从而激活中性粒细胞、单核细胞、巨噬细胞和肥大细胞等固有免疫细胞。单纯的免疫复合物并不致病,但是如果软骨表面表达GPI抗原,抗GPI抗体与之结合形成免疫复合物[13],进而产生较严重的炎症性关节炎。
由于RA患者常合并发生动脉硬化,且引起心血管疾病的传统危险因素如吸烟、高血压、高脂饮食等与RA的炎症标志物相互作用,在心血管疾病的发病中均起重要的作用[14]。很多研究表明,T细胞、B细胞和巨噬细胞等在动脉硬化和RA的发病中均起非常重要的作用[11, 15-17]。因此,我们通过给ApoE-/-小鼠饲喂高脂食物诱发动脉硬化症状,再注射K/BxN血清诱发关节炎症状,模拟动脉硬化合并关节炎的疾病状态,通过比较血脂水平的变化及动脉硬化斑块的差异,以及产生动脉硬化后对关节肿胀程度的影响,流式细胞术检测其免疫细胞的分布情况,从而对动脉硬化合并关节炎的发病机理提供实验基础。
1 材料和方法
1.1 实验动物
SPF级ApoE-/-雌鼠16只,体重为23 ~ 25 g,8周龄,由北京维通利华实验动物有限公司提供[SCXK (京) 2016-0006]。K/BxN小鼠由本实验室通过KRN雄鼠(由哈佛大学赠送)和NOD/LtJ雌鼠(由北京华阜康生物科技股份有限公司提供[SCXK (京) 2014-0004])交配繁殖,用来提供抗GPI抗体呈阳性的小鼠血清。所有小鼠均饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK (京) 2015-0035],动物实验方案已得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的审批[ILAS-PG-2015-002],并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
徕卡冰冻切片包埋剂(OCT)购自德国徕卡公司,血脂检测试剂盒购自南京建成生物工程研究所,Mouse Magnetic 6 plexAssay (LXSAMSM-06)购自R&D公司,CD3、CD4、CD11b流式抗体均购自BD Bioscience公司,高脂饲料购自北京博泰宏达生物技术有限公司,高脂饲料配方如下:15.8%脂肪,1.25%胆固醇和0.5%胆酸盐;流式细胞仪购自美国BD公司,冰冻切片机购自德国徕卡公司,酶标仪购自美国Thermo公司,Luminex 200购自美国R&D公司。
1.3 实验方法
1.3.1 动物分组及关节炎评分
观察注射K/BxN血清前高脂食物对ApoE-/-小鼠的影响,将ApoE-/-雌鼠随机分为高脂食物组(HFD)和普通食物组(CD),每组6~8只,分别饲喂高脂食物和普通食物。观察注射K/BxN血清后高脂食物和K/BxN血清对ApoE-/-小鼠的影响,分别给17周龄HFD和CD组小鼠腹腔注射抗GPI抗体呈阳性的K/BxN血清(通过颌下静脉采血法对K/BxN小鼠采血,待血液凝固后4000 r/min离心 10 min,提取上清获得血清,ELISA法检测血清抗GPI抗体水平,方法同1.3.4,将同一时间段抗GPI抗体呈阳性的K/BxN血清混匀,即可进行腹腔注射),0.2 mL/次/周,同时每周用游标卡尺测量小鼠后肢踝关节宽度并记录四肢关节炎评分(clinical score)(总数=12),0=正常,1=腕部肿胀,2=肿胀至足背部,3=肿胀至脚趾。
1.3.2 脾脏和骨髓CD3、CD19和CD11b细胞检测
小鼠注射戊巴比妥钠麻醉后处死,取脾脏称重后,用载玻片进行研磨,取研磨下层的细胞液,用红细胞裂解液进行裂解5 min,2340 r/min离心5 min,计数,取大约1×106个细胞,2340 r/min离心5 min,加入抗体工作液,4℃避光孵育30 min,2340 r/min离心5 min,弃上清液,洗1~2次,上流式细胞仪(AriaⅠ,Becton Dixon,USA)检测。取完脾脏后将后肢剪下,用1 mL注射器将骨髓抽取到含5%胎牛血清的PBS中,用注射器反复吹打混匀,直到骨髓细胞散在溶解于含5%胎牛血清的PBS中,流式抗体染色后同上述步骤上流式细胞仪(AriaⅠ,Becton Dixon,USA)检测,数据分析用 Flow Jo ver. 10(USA)。
1.3.3 动脉硬化症状检测
油红O染色观察主动脉瓣根部变化,取主动脉瓣根部用OCT包埋,用冰冻切片机修平组织,温度-20℃,切片厚度7 μm,置于玻片上,油红O染色后在光镜下观察脂肪浸润情况,用Image-pro Plus 6软件评估每张切片染色区域占总横截面的百分比。
1.3.4 血清学检测
血脂水平检测,血清总胆固醇(TCHO)浓度、低密度脂蛋白胆固醇(LDL-C)浓度和甘油三酯(TG)浓度通过ELISA法检测,按照试剂盒说明书操作。细胞因子检测,Luminex 200检测血清TNF-α、IL-6、IL-23P19、IL-17A、IL-10、IFN-γ水平,按照Mouse Magnetic 6 plex Assay(LXSAMSM-06)说明书操作。血清抗GPI抗体水平检测,将6-磷酸葡萄糖异构酶用PBS稀释到5 μg/mL 4℃过夜包被于96孔板,PBST洗板一次后,1% BSA封闭抗原,再用血清稀释液将待测血清稀释至1∶100(一抗)加入待测孔,同时设置阳性孔和空白孔,37℃孵育1 h后,结合1∶2000稀释的碱性磷酸酶标记羊抗鼠IgG(二抗),室温孵育1 h,PBST洗板后用磷酸酶底物显色,当肉眼可见阳性孔显黄色时,用酶标仪检测405 nm波长时的吸光度(OD)值。
1.4 统计学方法
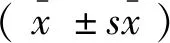
2 结果
2.1 26周龄ApoE-/-小鼠表现出动脉硬化合并关节炎症状
饲喂高脂食物并注射K/BxN血清后,实验组小鼠100%产生动脉硬化和关节炎症状。饲喂高脂食物后ApoE-/-小鼠出现体重增加、皮下脂肪增厚、背毛凌乱、行动迟缓。剖检可见脾脏、心脏及主动脉周围被脂肪包裹,腹腔内充满脂肪。注射K/BxN血清1周后肉眼可见小鼠踝关节、脚趾和脚掌肿胀、颜色发红,通过游标卡尺量取踝关节宽度发现比注射K/BxN血清前明显增加。
2.2 高脂食物和K/BxN血清处理对ApoE-/-小鼠免疫细胞的影响
2.2.1 高脂食物和K/BxN血清使ApoE-/-小鼠脾脏CD3+T细胞和CD19+B细胞下调,CD11b+巨噬细胞上调
脾是体内最大的外周淋巴器官,B细胞与T细胞分隔定位于不同区域,是机体细胞免疫和体液免疫的中心。我们分析ApoE-/-小鼠分别饲喂高脂和普通食物后再注射K/BxN血清,CD3、CD19、CD11b在脾细胞中的分布情况。与ApoE-/-小鼠饲喂普通食物后再注射K/BxN血清相比,饲喂高脂食物后再注射K/BxN血清的ApoE-/-小鼠脾脏CD3+T细胞占淋巴细胞的百分比例下降(P=0.0043<0.01)(见图1A和1B),CD19+B细胞占淋巴细胞的百分比例下降(P=0.0007<0.001)(见图1C和1D),CD11b+巨噬细胞占淋巴细胞的百分比例上升(P=0.02<0.05)(见图1E和1F)。
2.2.2 高脂食物和K/BxN血清使ApoE-/-小鼠骨髓CD3+T细胞和CD19+B细胞下调,CD11b+巨噬细胞上调
骨髓是机体重要的中枢淋巴器官,多能造血干细胞在骨髓中增殖,进而分化、发育、成熟为粒细胞和B细胞等。通过比较ApoE-/-小鼠高脂食物和普通食物处理后再注射K/BxN血清,我们发现与普通食物和K/BxN血清处理相比,高脂食物和K/BxN血清处理后,骨髓CD3+T细胞占淋巴细胞的百分比例下降(P=0.0007<0.001)(见图2A和2B),CD19+B细胞占淋巴细胞的百分比例下降(P=0.0007<0.001)(见图2C和2D),CD11b+巨噬细胞占淋巴细胞的百分比例上升(P=0.0013<0.01)(见图2E和2F)。
2.3 注射K/BxN血清前与注射后,高脂食物均使ApoE-/-小鼠动脉硬化症状加重
2.3.1 注射K/BxN血清前与注射后,高脂食物使ApoE-/-小鼠血脂水平升高
如图3A、3C和3E显示,ApoE-/-小鼠注射K/BxN血清前,高脂食物组比普通食物组血清LDL-C浓度(P=0.0007<0.001)、TCHO浓度(P=0.0007<0.001)和TG浓度(P=0.0007<0.001)显著升高;如图3B、3D和3F显示,ApoE-/-小鼠注射K/BxN血清后,与普通食物与K/BxN血清处理组相比,高脂食物与K/BxN血清共同处理使血清LDL-C浓度(P=0.0012<0.001)、TCHO浓度(P=0.0007<0.001)和TG浓度(P=0.0007<0.001)显著升高。提示注射K/BxN血清前与注射后,高脂食物均使ApoE-/-小鼠血脂水平(LDL-C浓度、TCHO浓度和TG浓度)显著升高。

注:HFD:高脂食物;CD:普通食物;K/BxN serum:K/BxN血清;ApoE-/-:ApoE基因敲除,●代表ApoE基因敲除小鼠经过高脂食物和K/BxN血清处理,▲代表ApoE基因敲除小鼠经过普通食物和K/BxN血清处理,下图同;A、C、E:流式细胞术检测高脂食物组和普通食物组小鼠脾脏CD3、CD19、CD11b细胞直方图,B、D、F:高脂食物组和普通食物组脾脏CD3+、CD19+、CD11b+细胞占淋巴细胞的百分比(%)。高脂食物组与普通食物组比较,*P<0.05,**P<0.01,***P<0.001。图1 高脂食物与K/BxN血清处理使ApoE-/-小鼠脾脏CD3+T细胞和CD19+B细胞下调,CD11b+巨噬细胞上调Note. HFD: high fat diet; CD: control diet. K/BxN serum: K/BxN serum. ApoE-/-: ApoE gene knockout, ● It represents that ApoE gene knockout mice were fed with high fat diet and intra-peritoneally injected with K/BxN serum. ▲ It represents that ApoE gene knockout mice were fed with the control diet and intra-peritoneally injected with K/BxN serum. The same with the following figures.A,C,E: The histogram of CD3, CD19 and CD11b cells of splenocytes in the HFD and the CD groups by flow cytometry, B, D, F: the splenic CD3+, CD19+ and CD11b+cells account for total lymphocytes of mice in the HFD and CD groups (%).The HFD group compared with the CD group,*P<0.05,**P<0.01,***P<0.001.Figure 1 CD3+T cells and CD19+B cells were downregulated, CD11b+macrophages were upregulated in the splenocytes of ApoE-/-mice after treatment of HFD and K/BxN serum
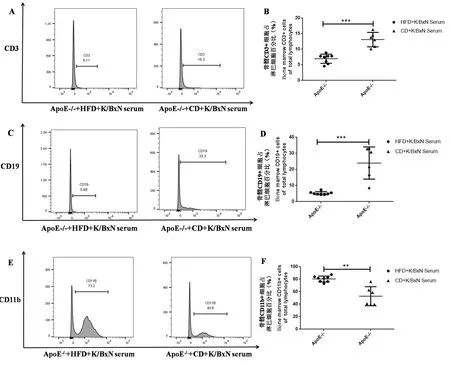
注:A、C、E:流式细胞术检测高脂食物组和普通食物组小鼠骨髓CD3、CD19、CD11b细胞直方图,B、D、F:高脂食物组和普通食物组骨髓CD3+、CD19+、CD11b+细胞占淋巴细胞的百分比(%)。高脂食物组与普通食物组比较,*P<0.05,**P<0.01,***P<0.001。图2 高脂食物与K/BxN血清处理使ApoE-/-小鼠骨髓CD3+T细胞和CD19+B细胞下调,CD11b+巨噬细胞上调Note. A,C,E: The histogram of CD3, CD19 and CD11b cells of bone marrow in the HFD and the CD groups by flow cytometry. B, D, F: the bone marrow CD3+, CD19+ and CD11b+cells account for total lymphocytes of mice in the HFD and CD groups (%).The HFD group compared with the CD group,*P<0.05,**P<0.01,***P<0.001.Figure 2 CD3+T cells and CD19+B cells were downregulated, CD11b+macrophages were upregulated in the bone marrow of ApoE-/-mice after treatment of HFD and K/BxN serum

注:A:注射K/BxN血清前血清LDL-C浓度;B:注射K/BxN血清后血清LDL-C浓度;C:注射K/BxN血清前血清TCHO浓度;D:注射K/BxN血清后血清TCHO浓度;E:注射K/BxN血清前血清TG浓度;F:注射K/BxN血清后血清TG浓度。高脂食物组与普通食物组比较,* P < 0.05,** P < 0.01,*** P < 0.001。图3 注射K/BxN血清前与注射后ApoE-/-小鼠血清LDL-C浓度、TCHO浓度和TG浓度Note. A: The level of serum LDL-C of ApoE-/- mice before K/BxN serum injection. B: The level of serum LDL-C of ApoE-/- mice after K/BxN serum injection. C: The level of serum TCHO of ApoE-/- mice before K/BxN serum injection. D: The level of serum TCHO of ApoE-/- mice after K/BxN serum injection. E: The level of serum TG of ApoE-/- mice before K/BxN serum injected. F: The level of serum TG of ApoE-/- mice after K/BxN serum injected. The HFD group compared with the CD group, * P < 0.05,** P < 0.01,*** P < 0.001.Figure 3 The levels of serum LDL-C, TCHO and TG of ApoE-/- mice before and after K/BxN serum injection
2.3.2 高脂食物使ApoE-/-小鼠主动脉瓣根部斑块面积增加
如图4A显示,ApoE-/-小鼠饲喂高脂食物和普通食物后注射K/BxN血清都能使主动脉瓣根部产生斑块。如图4B显示,与普通食物与注射K/BxN血清处理组相比,高脂食物与注射K/BxN血清处理组的斑块面积占横截面积的比更高(P=0.05)。

注:A:高脂食物组(HFD)和普通食物组(CD)ApoE-/-小鼠主动脉瓣根部冰冻切片油红O染色图(× 40);B:高脂食物组和普通食物组ApoE-/-小鼠主动脉瓣根部冰冻切片油红O染色阳性区域占主动脉瓣根部横截面积百分比(%); 代表ApoE基因敲除小鼠经过高脂食物和K/BxN血清处理,代表ApoE基因敲除小鼠经过普通食物和K/BxN血清处理。高脂食物组与普通食物组比较,*P < 0.05。图4 主动脉瓣根部斑块油红O染色Note. A: Aortic root of ApoE-/- mice in HFD and CD groups (× 40). B: Oil red O positive area account for cross section of aortic root (%). It represents that ApoE gene knockout mice were fed with high fat diet and intra-peritoneally injected with K/BxN serum. It represents that ApoE gene knockout mice were fed with the control diet and intra-peritoneally injected with K/BxN serum. The HFD group compared with the CD group, *P < 0.05.Figure 4 Histological changes of the atheroslerotic plaque at the aortic valve root. Oil red O staining
2.4 注射K/BxN血清前后,高脂食物组ApoE-/-小鼠的踝关节肿胀程度产生变化
如图5A和5B显示,注射K/BxN血清后比注射前所有ApoE-/-小鼠踝关节均产生了肿胀,饲喂高脂食物的ApoE-/-小鼠踝关节宽度和关节炎评分的升高值显著低于饲喂普通食物组。
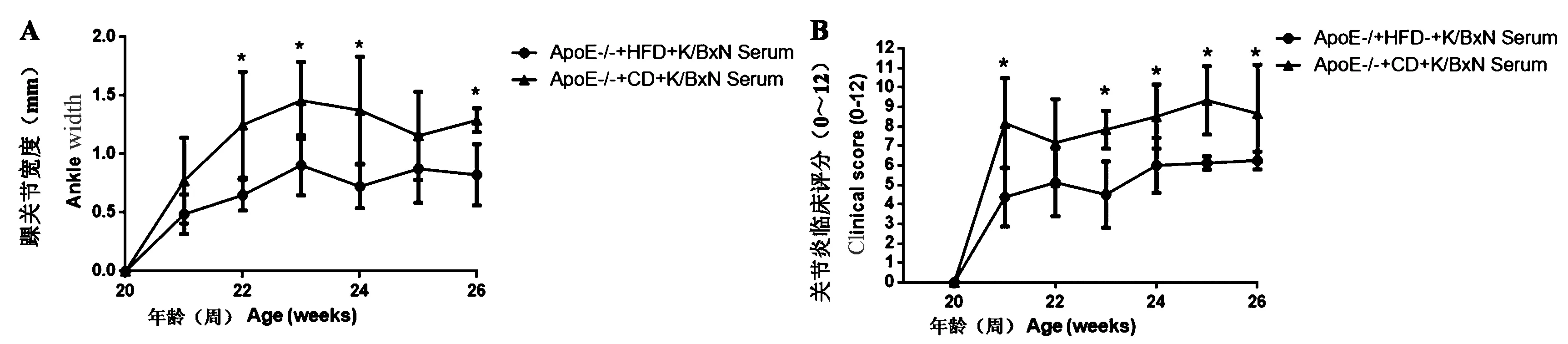
注:A:注射K/BxN血清后比注射前各组ApoE-/-小鼠踝关节宽度的升高值;B:注射K/BxN血清后比注射前各组ApoE-/-小鼠关节炎临床评分的升高值(0 ~ 12)。高脂食物组与普通食物组比较,*P < 0.05。图5 注射K/BxN血清前后各组ApoE-/-小鼠踝关节宽度和关节炎临床评分(0 ~ 12)的升高值Note. A: The increased ankle width of all ApoE-/- mice between two groups. B: The increased clinical scores (0 - 12) of all ApoE-/- mice between two groups. The HFD group compared with the CD group, *P < 0.05.Figure 5 The increased ankle width and clinical scores (0 - 12) of all ApoE-/- mice before and after K/BxN serum injection between two groups
2.5 细胞因子检测结果
此外,细胞因子检测结果显示,各组之间无显著性差异(结果未呈现)。
3 讨论
载脂蛋白E(ApoE)具有抗动脉硬化的功能[18-19],研究表明此功能与载脂蛋白E能清除血浆中多余的脂蛋白有关,血浆中脂蛋白沉积过多可引起斑块产生;载脂蛋白E还可以对血管壁、免疫系统和骨髓发挥作用[20]。载脂蛋白E可抑制平滑肌细胞增殖[21-22]、高脂血症小鼠NF-κB介导的炎症以及动脉硬化[23],从而控制心血管系统的炎症。ApoE基因敲除小鼠表现出人类ApoE基因缺陷的特征,并且通过饲喂高脂、高胆固醇饮食后诱发动脉硬化[18]。本研究中通过高脂食物喂养使ApoE-/-小鼠血脂水平升高(包括血清LDL-C浓度、TCHO浓度和TG浓度升高)及动脉硬化斑块增加,提示饲喂高脂食物可以诱发ApoE-/-小鼠产生显著的动脉硬化症状。注射K/BxN血清后,饲喂高脂食物的ApoE-/-小鼠关节炎症状比饲喂普通食物的ApoE-/-小鼠轻微,但是动脉硬化症状更严重。同时我们发现,注射K/BxN血清后高脂食物组和普通食物组ApoE-/-小鼠血清LDL-C浓度、TCHO浓度和TG浓度均低于注射血清前,推测其原因可能是由于高脂食物喂养时间太长,或者注射K/BxN血清能够减弱动脉硬化症状,我们计划通过进一步实验来验证以上推测。
很多研究证实在RA的发病机制中,T、B淋巴细胞和巨噬细胞都起到非常重要的作用。研究发现抗瓜氨酸蛋白抗体(ACPA)呈阳性的RA患者滑液组织中T、B淋巴细胞含量均升高[11, 15],其中75%~90%的淋巴细胞是T细胞。T细胞与包括B细胞在内的抗原呈递细胞(APCs)相互作用,APC分泌细胞因子的能力影响Th1/Th2值,通过调控Th1/Th2值使之趋于平衡,从而降低炎症水平,因此,RA与激活的Th1细胞有关,Th17亚型在RA发病中也起重要作用[24]。成熟的B淋巴细胞表面表达Ⅱ型主要组织相容性复合物(MHC-Ⅱ),可作为抗原递呈细胞(APC)在抗体产生中起重要作用。次级淋巴组织中的B细胞分泌自身免疫性抗体、抗瓜氨酸蛋白抗体(ACPA)和类风湿因子(RF)[11],这些抗体反应疾病的发展和预后[25],同时临床研究发现利妥昔单抗(Rituximab)可以降低B细胞和RA的疾病活动度并减轻关节损伤[26-27]。因此,B淋巴细胞通过作用于APC、产生自身抗体等,并且活化T淋巴细胞,促进T淋巴细胞浸润于滑膜组织。
T、B淋巴细胞和巨噬细胞对动脉硬化有调控作用[16-17]。在动脉硬化斑块中,T细胞占免疫细胞的比例是可变的,在引发炎症反应方面起重要的作用,Th1细胞有促动脉硬化的作用,Th2细胞的作用还存在争议,调节T细胞(Tregs)通过释放转换生长因子β和IL-10抑制动脉硬化的发生[16]。B细胞在动脉硬化中的作用机理较复杂:分泌促炎细胞因子、提呈抗原给T细胞、以及分化为浆细胞产生免疫球蛋白。其中B1a细胞和B1b细胞保护机体不产生动脉硬化,而B2细胞促进动脉硬化的发生和发展[28]。
巨噬细胞和单核细胞在炎症相关疾病中起重要作用,包括动脉硬化、关节炎、心肌梗塞等[29]。巨噬细胞的累积是慢性炎症发展中很重要的一步[30],单核细胞被环境因素刺激后,迁移并浸润到内皮细胞中,引起动脉硬化斑块中巨噬细胞升高[29]。CD11b又叫整合素αM,在巨噬细胞表面表达,是异质二聚体整合素αMβ2(巨噬细胞-1抗原)的组成部分[31]。研究表明,CD11b+细胞在鼻病毒诱导的炎症反应中起重要作用[31]。
我们的研究中高脂食物与K/BxN血清处理后使ApoE-/-小鼠骨髓和脾脏的CD19+B细胞下调,我们推测是由于B细胞下调,导致浆细胞下调,从而引起B细胞分泌的抗GPI抗体下调,最终引起ApoE-/-小鼠踝关节肿胀程度和关节炎评分下降,以此推测需要进一步的工作来进行验证。B细胞下调引起活化的T细胞下调。高脂食物使骨髓和脾脏CD11b+巨噬细胞上调,且动脉硬化症状加重,由于巨噬细胞的累积引发慢性炎症反应,从而加重动脉硬化症状,包括血脂水平的升高以及动脉硬化斑块的显著增加。有研究表明高脂血症使小鼠Hdc+CD11b+髓样细胞增加,从而促进动脉硬化中的肥大细胞形成[27]。肥大细胞是炎性细胞,其数量随病变加重而升高[33]。
综上所述,高脂食物和K/BxN血清可以诱发ApoE-/-小鼠动脉硬化和关节炎,通过流式细胞术分析显示高脂食物和K/BxN血清使ApoE-/-小鼠骨髓和脾脏的CD19+B细胞下调,可能引起血清抗GPI抗体下调,引起踝关节肿胀程度和关节炎评分下降,同时引起骨髓和脾脏的CD3+T细胞下调,骨髓和脾脏CD11b+巨噬细胞上调,引起动脉硬化症状加重。这一结论有助于我们对动脉硬化合并关节炎小鼠免疫细胞的分布有更全面、深刻的认识,并为临床研究提供一定的实验依据。

