下调miR-192对单侧输尿管梗阻大鼠肾间质纤维化的干预作用及机制
刘新磊,王珊珊,颜月香,陈福莲
(潍坊市益都中心医院,山东 潍坊 262500)
肾间质纤维化是各种慢性肾脏疾病(chronic kidney disease,CKD)进展为终末期肾病的共同途径,主要表现为细胞外基质成分在间质内过度沉积和肾间质成纤维细胞增生,从而引起肾结构破坏、功能丧失[1-2]。肾间质纤维化是决定CKD发生发展及预后的重要因素,早期治疗甚至逆转肾间质纤维化对阻止CKD进展具有重要意义。微小RNA(microRNAs,miRNAs)是一类内源性非编码小分子RNA,具有高度的保守性,在细胞增殖、分化、凋亡、功能调节方面起着重要的作用。研究表明miRNAs在肾脏细胞组织发育、肾功能及内环境稳定方面起着极其重要的作用[3]。在伴有肾纤维化的CKD动物模型或者患者肾组织中存在大量异常表达的miRNAs,可能参与了肾纤维化的发生进展[4]。miR-192是肾特异性表达的miRNAs之一,在多种急慢性肾脏疾病的发生发展过程中异常表达[5-6]。研究显示miR-192与多种慢性疾病造成的器官纤维化密切相关,在肝[7]、皮肤瘢痕[8]、心脏[9]、腹膜[10]等器官纤维化组织中表达明显异常,可能参与了器官纤维化的进程。目前有关miR-192与肾间质纤维化关系的研究较少,并且具体作用机制尚不明确。本研究中我们通过建立经典的肾间质纤维化动物模型-单侧输尿管梗阻(unilateral ureteral obstmction,UUO)大鼠模型,探讨miR-192在肾间质纤维化大鼠肾组织中的表达变化及其下调miR-192对大鼠肾间质纤维化的影响和可能的机制。
1 材料和方法
1.1 实验动物
雄性SPF级SD大鼠45只,鼠龄6周,体重190 ~ 240 g,购自山东大学动物实验中心[SCXK (鲁) 2017-0009]。常规饲养,适应环境[SYXK (鲁) 2014-0008]1周。本研究整个实验过程中严格按照实验动物使用的3R原则给予人道主义关怀[IACUC NO.2016-23]。
1.2 主要试剂与仪器
尿素氮(BUN)和肌酐(Cr)测定试剂盒购自瑞士罗氏公司;TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒和实时荧光定量PCR (qRT-PCR) 试剂盒购自大连宝生物工程公司;miR-192抑制剂antagomir-192及全部PCR引物均购自广州锐博生物公司; Masson 染色试剂盒购自福州迈新生物公司;一抗兔抗鼠钙黏蛋白(E-cadherin)、α平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)及I型胶原蛋白(collagen I)、 GAPDH抗体均购自美国Santa Cruz公司;HRP标记的羊抗兔二抗购自武汉博士德生物公司。LightCycle 96 荧光定量PCR仪购自瑞士Roche公司;电泳仪、凝胶成像系统购自美国Bio-Rad公司;7100型日立全自动生化分析仪购自日本日立公司。
1.3 实验方法
1.3.1 实验动物分组及模型建立
SD大鼠常规饲养,适应环境1周后,所有SD大鼠按随机分为手术组、模型组、antagomir-192组,每组15只。模型组和antagomir-192组参考文献的方法[11-12]建立肾间质纤维化动物模型-UUO大鼠模型,方法简述如下:大鼠麻醉成功后于左侧肋缘下脊柱旁开1.5 cm处切开腹腔分离暴露左肾,游离左侧近肾盂端输尿管,于靠近肾门处和输尿管上1/3水平分别以4-0号丝线结扎输尿管后离断输尿管,缝合腹腔。假手术组麻醉成功后仅切开腹腔暴露左肾,游离左侧近肾盂端输尿管,但不结扎和离断输尿管。术后第1、7、14天antagomir-192组大鼠给予antagomir-192(30 mg/kg)尾静脉注射,而假手术组和模型组大鼠给予等量生理盐水尾静脉注射,术后第21天麻醉处死所有SD大鼠,取大鼠左侧肾组织,留取一部分肾组织置于4%多甲醛溶液中固定,用于病理切片染色;剩余左肾组织经液氮中速冻后转移至-80℃冰箱保存,用于提取mRNA及蛋白。
1.3.2 qRT-PCR检测各组大鼠肾组织miR-192的表达
取冻存肾组织,TRIzol法提取肾组织中总RNA,紫外分光光度计测定总RNA浓度。取总RNA,按照逆转录试剂盒说明书操作逆转录合成cDNA。以cDNA为模板,用miR-192引物参照qRT-PCR试剂盒说明书配置PCR体系后进行PCR反应, 引物序列:miR-192上游引物:5′-GGGGCTGACCTATGAATTGA-3′,下游引物:5′-CAGTGCAGGGTCCGAGGT-3′。内参U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。PCR反应条件:95℃,10 min;95℃,15 s,60℃,60 s,45个循环后结束。以U6作为miR-192的内参基因,miR-192的相对表达量采用2-△△Ct法计算。
1.3.3 各组大鼠血清BUN和Cr水平的检测
麻醉处死大鼠后心脏取血2 mL,以3000 r/min,离心半径15 cm离心15 min取上清液,应用全自动生化分析仪检测各组大鼠血清BUN和Cr的水平。
1.3.4 各组大鼠肾组织HE染色和Masson染色
取多聚甲醛固定的肾组织,酒精脱水、二甲苯透明,石蜡浸润包埋后,切片机制作4 μm厚石蜡切片,45℃恒温箱烘干,再将切片经过二甲苯脱蜡、浸泡等常规处理后进行HE或Masson染色,光镜下观察肾组织的病理学改变。HE染色:苏木精染色5 min,1%盐酸酒精和1%氨水酒精分色,蒸馏水冲洗后,1%伊红染色3 min,酒精脱水、二甲苯透明,中性树胶封片。参考文献进行肾小管间质损伤评分[12], 评分标准如下:0分,肾小球无病变;1分,肾小球病变范围<25%;2分,肾小球病变范围25%~50%;3分,肾小球病变范围51%~75%;4分,肾小球病变范围>75%。Masson染色:Masson染液染色5 min,以醋酸洗液冲洗3遍,再以磷钨酸染色7 min,醋酸洗液冲洗3遍,甲苯胺蓝染色2 min,以醋酸洗液冲洗3遍后,酒精脱水、二甲苯透明,中性树胶封片。参考文献的方法[13]计算肾间质胶原纤维沉积率:每张切片随机选取10个肾小管间质不相重叠的视野,蓝色为Masson阳性染色区(纤维化区),应用Image Pro plus 图像分析软件进行图像面积分析,肾间质胶原纤维沉积率=阳性染色区面积/肾间质总面积 × 100%。
1.3.5 Western blotting检测各组大鼠肾组织E-cadherin、α-SMA、vimentin及collagen I蛋白的表达
RIPA裂解液提取各组大鼠肾组织总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。蛋白上样进行SDS-Page电泳,将蛋白电转移至PVDF膜后,用5%脱脂牛奶室温封闭2 h。加入一抗(E-cadherin、α-SMA、vimentin、collagen I及GAPDH抗体),摇床4℃孵育过夜,TBST洗膜3次,再加入HRP标记的二抗,室温下孵育1 h,TBST洗膜3次后,ECL显像曝光。采集图像用Quality One进行条带灰度值测定,以目的条带灰度值与内参条带灰度值的比值表示蛋白的表达水平。
1.4 统计学方法
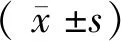
2 结果
2.1 各组大鼠肾组织中miR-192的表达
qRT-PCR结果如图1所示:假手术组、模型组、antagomir-192组大鼠肾组织中miR-192的相对表达水平分别为(1.04±0.04)、(7.41±0.39)、(1.45±0.17)。与假手术组比较,模型组大鼠肾组织miR-192的表达水平明显升高(P<0.05)。与模型组比较,antagomir-192组大鼠肾组织miR-192的表达明显降低(P<0.05)。
2.2 各组大鼠肾功能检测
各组大鼠血清BUN和Cr检测结果如表1所示:与假手术组比较,模型组大鼠血清BUN、Cr水平明显升高(P<0.05);与模型组比较,antagomir-192组大鼠血清BUN和Cr明显下降(P<0.05)。
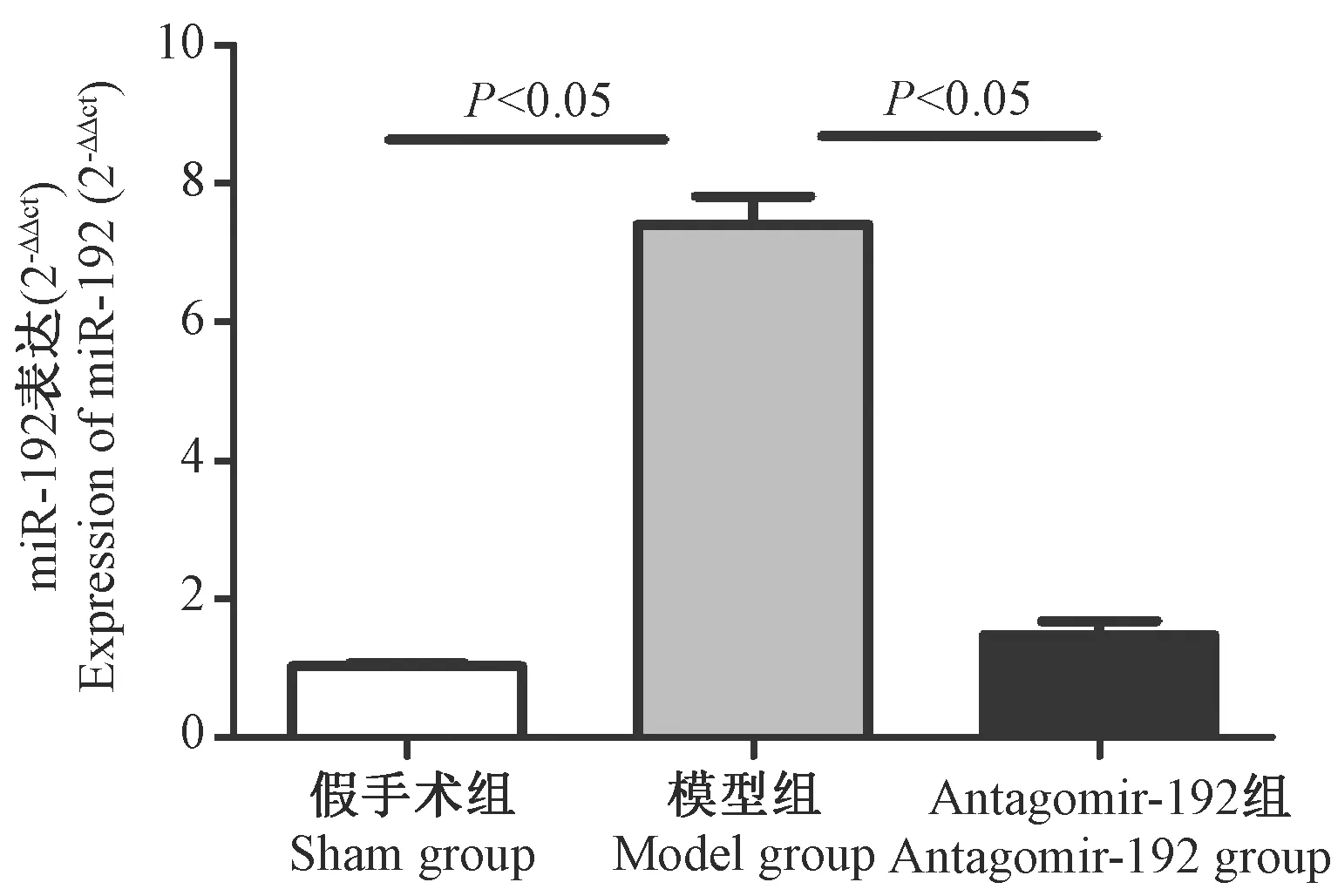
图1 qRT-PCR检测各组大鼠肾组织miR-192的表达Figure 1 qRT-PCR detection of the expression of miR-192 in renal tissues of rats in each group
2.3 各组大鼠肾间质损伤评分及肾间质胶原纤维沉积率
HE染色结果如图2所示,假手术组大鼠肾间质未见明显损伤表现;模型组大鼠肾可见肾小管管腔明显闭塞或扩张,间质增宽,肾间质大量炎性反应细胞浸润;antagomir-192组大鼠病理性改变较模型组明显减轻。各组大鼠肾间质损伤评分如表2所示:模型组大鼠肾间质损伤评分明显高于假手术组(P<0.05),而antagomir-192组大鼠肾间质损伤评分明显低于模型组(P<0.05)。
Masson染色结果如图3所示,肾间质胶原纤维沉积率结果如表2显示:模型组大鼠肾间质胶原纤维沉积率明显高于假手术组(P<0.05),而antagomir-192组大鼠肾间质胶原纤维沉积率明显低于模型组(P<0.05)。
表1 各组大鼠肾功能比较
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05。
Note. Compared with the sham group,#P<0.05.Compared with the model group,*P<0.05.
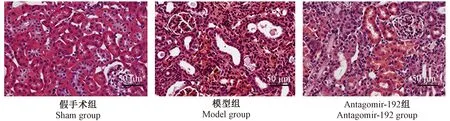
图2 大鼠肾组织的病理学改变(HE染色,× 200)Figure 2 Pathological changes in the rat renal tissues.HE staining
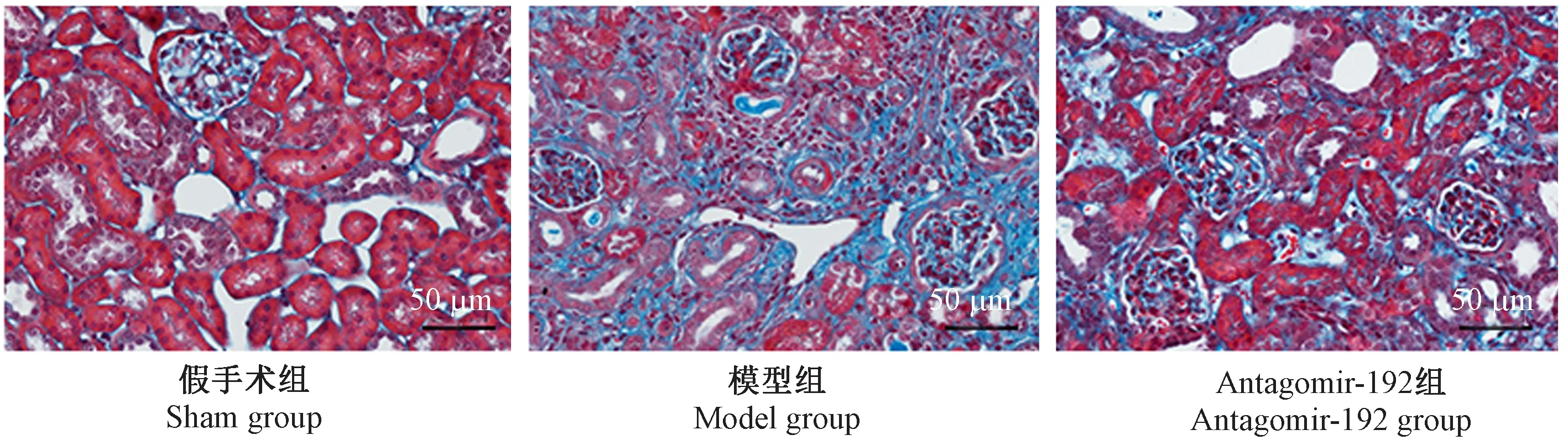
图3 大鼠肾组织的病理学改变(Masson染色, × 200)Figure 3 Pathological changes of the rat renal tissues. Masson staining
表2 各组大鼠肾间质损伤评分及肾间质胶原纤维沉积率比较
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05。
Note. Compared with the sham group,#P<0.05.Compared with the model group,*P<0.05.
2.4 各组大鼠肾组织中E-Cadherin、α-SMA、Vimentin及Collagen I蛋白的表达
Western blotting结果显示:模型组大鼠肾组织中E-cadherind蛋白表达较假手术组明显降低(P<0.05),α-SMA、vimentin及collagen I蛋白的表达较假手术组明显升高(P<0.05);而antagomir-192组大鼠肾组织中E-cadherind蛋白表达较模型组明显升高(P<0.05),α-SMA、vimentin及collagen I蛋白的表达较模型组明显降低(P<0.05)。(见图4)。
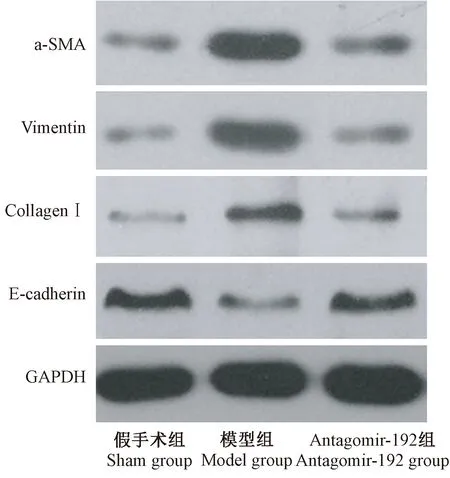
图4 Western blotting检测E-cadherin、α-SMA、vimentin及collagen I蛋白的表达Figure 4 Western blotting results of the expression of E-cadherin,α-SMA, vimentin, and collagen I proteins
3 讨论
肾间质纤维化是CKD进展至终末期肾病的最终结局,是多种细胞因子和信号通路参与的复杂的过程,迄今为止,其具体发生进展机制尚未完全清楚,并且临床上仍缺乏能够有效阻滞或者延缓肾间质纤维化的有效治疗方法[14]。近年来研究显示miRNAs在细胞增殖、分化、凋亡、疾病的发生进展中发挥着重要的作用,并且在肾间质纤维化的发生进展中发挥着一定的作用[15-17]。
miR-192是肾特异性表达的miRNAs之一,近期其与急慢性肾脏疾病及器官纤维化的关系受到人们的广泛关注[5-10]。UUO动物模型是目前研究肾纤维化发病机制、肾细胞分化以及评价肾纤维化治疗方法的理想的动物模型[18]。为了研究miR-192与肾间质纤维化的关系。本研究中我们通过UUO建立肾纤维化大鼠模型。研究结果显示模型组大鼠血清BUN、Cr水平较假手术组明显升高,肾组织HE染色结果显示模型组大鼠肾可见肾小管管腔明显闭塞或扩张,间质增宽,肾间质大量炎性反应细胞浸润,而假手术组大鼠肾间质未见明显损伤表现,模型组大鼠肾间质损伤评分及肾间质胶原纤维沉积率明显高于假手术组,以上提示本研究中UUO大鼠模型造模成功。进一步我们通过qRT-PCR检测大鼠肾组织中miR-192表达发现,模型组大鼠肾组织中miR-192表达水平较假手术组明显升高,提示miR-192在肾间质纤维化中可能发挥着重要的作用。为了进一步验证miR-192在肾间质纤维化中的作用,我们通过尾静脉给予UUO大鼠注射miR-192抑制剂antagomir-192,成功下调了UUO大鼠肾组织中miR-192的表达水平,结果显示antagomir-192组大鼠血清BUN和Cr水平明显降低,病理性改变较模型组明显减轻,并且肾间质损伤评分和肾间质胶原纤维沉积率也明显降低,提示下调miR-192能够抑制UUO大鼠肾间质纤维化。
近年来随着对器官纤维化的研究深入发现上皮-间充质转分化(epithelial mesenchymal transition,EMT)在包括肾在内的众多器官纤维化过程中发挥着重要的作用[19]。在EMT的过程中,上皮表型特征标志物如E-cadherin等表达下调,上皮细胞极性消失及黏附性降低,间充质表型特征标志物vimentin及α-SMA 等上调,并伴有collagen I蛋白等基质组分表达增加[20]。Iwano等[21]在对UUO大鼠模型的研究中发现,在肾间质纤维化中,新形成的成纤维细胞大部分来源于EMT。本研究中我们也发现模型组大鼠肾组织中E-cadherind蛋白表达较假手术组明显降低,α-SMA、vimentin及collagen I蛋白的表达较假手术组明显升高,提示EMT在UUO大鼠肾间质纤维化中也起着重要的作用。近年来研究显示miR-192在EMT的调控中发挥着重要的作用[22-23]。但miR-192在肾间质纤维化中的作用是否也是通过调控EMT来实现的尚不清楚。本研究中我们发现antagomir-192组大鼠肾组织中E-cadherind蛋白表达较模型组明显升高,α-SMA、vimentin及collagen I蛋白的表达较模型组明显降低,提示下调miR-192对UUO大鼠肾间质纤维化的保护作用可以通过调控EMT来实现。
综上所述,miR-192在肾间质纤维化大鼠肾组织中表达升高,下调miR-192可能能够通过调控EMT抑制UUO大鼠肾间质纤维化从而起到保护作用,从而为肾纤维化的治疗提供新的研究方向。

