COX-2基因对TGF-β1诱导的人胚肺成纤维细胞生长及Notch信号通路的影响及其作用机制
郭彩霞,于洪涛,石红梅,商玉立
(河南省胸科医院呼吸内科,郑州 450000)
肺间质纤维化(pulmonary fibrosis,PF)是由自身免疫、生物因素、物理因素、免疫因素等多种因素诱发的慢性肺部疾病发展至晚期的一个相同的病理变化,该病发病机制比较复杂,目前缺乏治疗该病的有效手段[1]。因此,寻找治疗PF有效的途径成为研究者关注的热点。近些年研究显示,成纤维细胞可通过自身异常增殖及转型,作用于转化生长因子(TGF-β)、胰岛素样生长因子-1(IGF-1)等一些炎症和细胞因及上皮细胞,或分泌大量细胞外基质而间接的参与PF的发展进程[2-3]。TGF-β1是促进纤维化的一个最重要的细胞因子,已有多项研究显示,PF中TGF-β1表达升高,TGF-β1可诱导肺成纤维细胞(FB)的增殖和转分化[4-5]。因此,本研究采用TGF-β1诱导人胚肺成纤维细胞系MRC-5以建立PF的模型。环氧合酶-2(COX-2)是一个重要的合成前列腺素过程中的限速酶,有研究显示,在PF大鼠及患者肺组织中存在COX-2的高表达,可能参与PF的发生发展[6-7],但COX-2如何影响PF及机制尚未明确,因此,本研究通过TGF-β1刺激及COX-2的siRNA转染人胚肺成纤维细胞MRC-5,在细胞水平上检测抑制COX-2表达对MRC-5细胞活力、胶原合成、EMT标志物及Notch信号通路的影响,以期为PF的治疗提供新的思路。
1 材料和方法
1.1 实验材料
人胚肺成纤维细胞系MRC-5购自美国ATCC。
1.2 主要试剂与仪器
胎牛血清、DMEM培养基、青链霉素双抗均购自美国HyClone公司;TGF-β1购自Peprotech公司;LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;实时荧光定量PCR试剂购自美国Thermo公司;LOWRY蛋白定量试剂盒购自上海邦奕;COL-Ⅰ、COL-Ⅲ抗体购自武汉博士德;COX-2、平滑肌肌动蛋白(α-smooth muscle actin, α- SMA)、Notch1和Jagged1抗体均购自美国Abacm;酶标仪购自美国Bio-Rad。
1.3 实验方法
1.3.1 细胞培养及转染
MRC-5细胞在含有10%小牛血清及青霉素和链霉素各100 U/mL的DMEM高糖培养基中,置于5%CO2培养箱37℃条件培养,细胞生长为贴壁,每2 d细胞进行一次传代,实验选择生长至对数期的细胞。转染前接种生长至对数期的MRC-5细胞于6孔培养板中用DMEM(含有血清不含抗生素)培养,并将细胞浓度调整为每毫升含1.0×105~2.0×105个细胞,细胞培养24 h贴壁,弃掉旧的培养液,将细胞分为对照组、TGF-β1组(2μg/L的TGF-β1刺激细胞)、COX-2-siRNA组(2μg/L的TGF-β1刺激细胞48 h后再将COX-2-siRNA进行瞬时转染)和NC组(2μg/L的TGF-β1刺激细胞48 h后瞬时转染无干扰作用的siRNA),转染参照LipofectamineTM2000说明,于培养箱中正常培养48 h。
1.3.2 转染后的MRC-5细胞中COX-2的表达检测
参照Trizol Regent试剂盒说明提取转染后培养48 h的各组细胞中的总RNA,参照逆转录试剂盒说明,采用20 μL体系将总RNA反转录为cDNA,参照RT-PCR说明,采用20 μL的扩增体系,以β-actin为内参基因,通过荧光定量PCR仪对COX-2的表达进行扩增,引物均有上海生工合成,序列如下:COX-2 F 5′-GTCTGATGATGTATGCCACAATCTG-3′,R 5′-GATGCCAGTGATAGAGGGTGTTAAA-3′;扩增片段276 bp。 β-actin F 5′-AACCCTAAGGCCAACCGTG AAAAG-3′,R 5′-TCATGAGGTAGTCTGTCAGGT-3′。扩增片段为241 bp。PCR反应条件为94℃预变性4 min,94℃变性30 s,60℃退火30 s,72℃延伸60 s,30个循环,最后72℃延伸10 min,4℃保存。COX-2相对表达量根据RT-PCR所得Ct均值通过2-△△Ct计算获得。
1.3.3 蛋白质印迹(Western blotting)
将1 mL的RIPA(含有10%的PMSF)蛋白裂解液加入转染后培养48 h的细胞,置于冰上裂解反应30 min,离心,收集蛋白,Lowry法对蛋白含量进行检测,每孔道取上样蛋白50 μg进行电泳,电泳后半干法转凝胶至PVDF膜,转好的PVDF膜于50 g/L的脱脂奶粉封闭液中封闭2 h,洗膜,加入适当稀释比例的一抗4℃过夜,COX-2、COL-Ⅰ、COL-Ⅲ、α- SMA、Notch1和Jagged1皆按照1∶500稀释,β-actin为1∶1000稀释,洗膜后加入二抗,室温条件孵育二抗1 h,ECL试剂显色,置于暗室中显影定影。
1.3.4 各组细胞活力检测
收集转染后培养48 h的细胞,避光条件下加MTT溶液10 μL于每孔中,5%CO2培养箱37℃条件培养4 h,培养至时间后弃掉上清液,加入DMSO溶液150 μL于每孔中,混合均匀后震荡10 min,放入酶标仪在490 nm波长测定各组细胞各个孔的吸光度值(OD值)。实验重复3次。
1.4 统计学方法

2 结果
2.1 TGF-β1诱导的MRC-5细胞中COX-2的表达
TGF-β1刺激MRC-5细胞48 h后,通过Western blotting检测COX-2在MRC-5细胞的表达,结果如图1所示,Control组、TGF-β1组、NC组和COX-2-siRNA组COX-2的蛋白表达分别为(0.052±0.010)、(0.467±0.048)、(0.483±0.046)、(0.153±0.017),Control组、TGF-β1组、NC组和COX-2-siRNA组COX-2的蛋白表达比较差异具有统计学意义(F=119.763,P<0.05),TGF-β1组COX-2的表达显著高于对照组(P<0.05),NC组COX-2的表达与TGF-β1组差异无统计学意义(P>0.05),COX-2-siRNA组COX-2的表达显著低于TGF-β1组(P<0.05)。

注:A:各组细胞中COX-2的蛋白表达;B:COX-2的蛋白相对表达;与Control组比较,*P<0.05;与TGF-β1组比较,#P<0.05。图1 COX-2在TGF-β1诱导的MRC-5细胞中的表达Note. A: COX-2 protein expression in the cells of each experimental group. B: Relative COX-2 protein expression. Compared with the control group,*P<0.05. Compared with the TGF-β1 group,#P<0.05.Figure 1 COX-2 expression in the MRC-5 cells activated by TGF-β1
2.2 抑制COX-2表达对TGF-β1诱导的MRC-5细胞活力的影响
CCK8法检测各组细胞活力结果如图2所示,Control组、TGF-β1组、NC组和COX-2-siRNA组OD值分别为(0.327±0.028)、(0.669±0.053)、(0.653±0.056)、(0.431±0.041),4组OD值比较差异具有统计学意义(F=40.457,P<0.05),与对照组比较,TGF-β1组OD值显著升高(P<0.05),与TGF-β1组比较,COX-2-siRNA组OD值显著降低(P<0.05)。
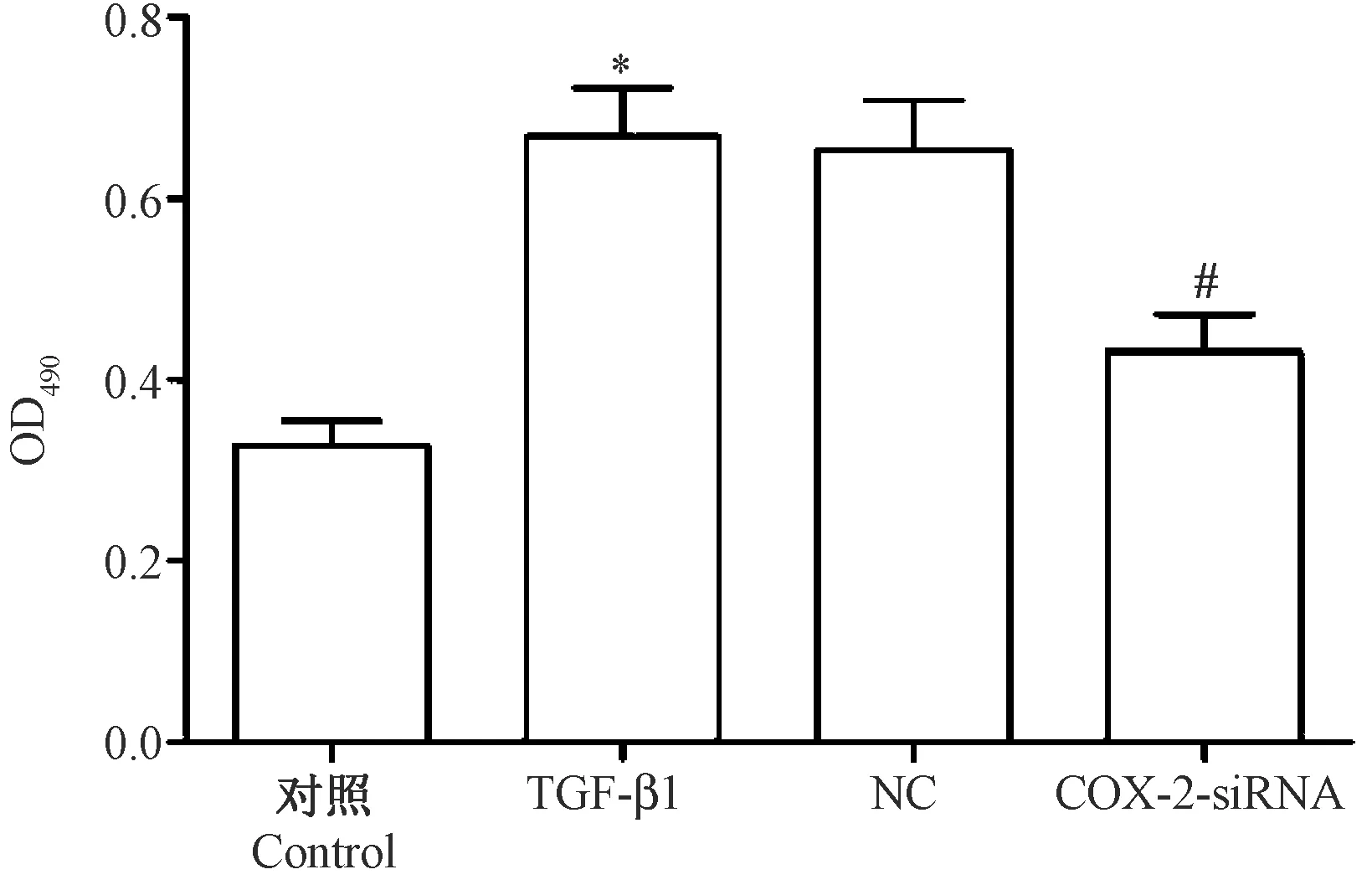
注:与Control组比较,*P<0.05;与TGF-β1组比较,#P<0.05。图2 抑制COX-2表达对TGF-β1诱导的MRC-5细胞活力的影响Note. Compared with the control group,*P<0.05. Compared with the TGF-β1 group,#P<0.05.Figure 2 The effects of inhibition of COX-2 expression on the TGF-β1-dependent activation of MRC-5 cells
2.3 抑制COX-2表达对TGF-β1诱导的MRC-5细胞胶原合成的影响
Western blotting检测COL-Ⅰ和COL-Ⅲ的蛋白表达,结果如图3所示,Control组、TGF-β1组、NC组和COX-2-siRNA组COL-Ⅰ的蛋白表达分别为(0.083±0.008)、(0.405±0.039)、(0.413±0.036)、(0.182±0.021),COL-Ⅲ的蛋白达分别为(0.078±0.007)、(0.297±0.032)、(0.282±0.034)、(0.153±0.016),4组COL-Ⅰ、COL-Ⅲ的蛋白表达比较差异具有统计学意义(F1=97.995,F2=53.442,P<0.05),与对照组比较,TGF-β1组COL-Ⅰ和COL-Ⅲ的表达均显著升高(P<0.05),与TGF-β1组比较,COX-2-siRNA组COL-Ⅰ和COL-Ⅲ的表达均显著降低(P<0.05)。
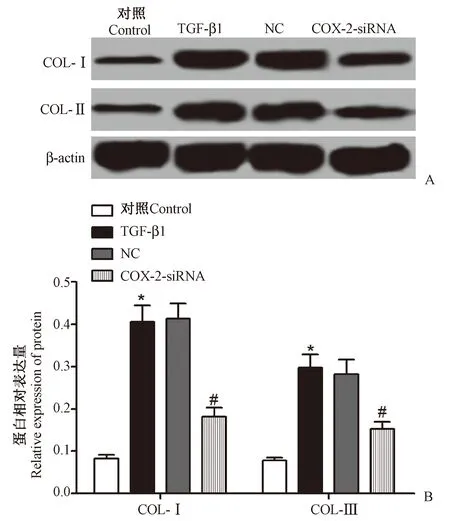
注:A:Western blotting检测COL-Ⅰ和COL-Ⅲ的蛋白表达;B:COL-Ⅰ和COL-Ⅲ的蛋白相对表达量;与Control组比较,*P<0.05;与TGF-β1组比较,#P<0.05。图3 抑制COX-2表达对TGF-β1诱导的MRC-5细胞胶原合成的影响Note. A: Western blotting was used to detect the expression of COL-I and COL-III proteins. B: The relative expression of COL-I and COL-III protein. Compared with the control group,*P<0.05. Compared with the TGF-β1 group,#P<0.05.Figure 3 The effects of inhibition of COX-2 expression on the TGF-β1-dependent synthesis of collagen in the MRC-5 cells
2.4 抑制COX-2表达对TGF-β1诱导的MRC-5细胞EMT标志物表达的影响
Western blotting检测抑制COX-2表达对TGF-β1诱导的MRC-5细胞EMT标志物α-SMA 的影响,结果如图4所示,Control组、TGF-β1组、NC组和COX-2-siRNA组α-SMA的蛋白表达分别为(0.091±0.010)、(0.223±0.026)、(0.228±0.028)、(0.096±0.010),4组α-SMA的蛋白表达比较差异具有统计学意义(F=42.046,P<0.05),与对照组比较,TGF-β1组α-SMA 的表达显著升高(P<0.05),与TGF-β1组比较,COX-2-siRNA组α-SMA 的表达显著降低(P<0.05)。
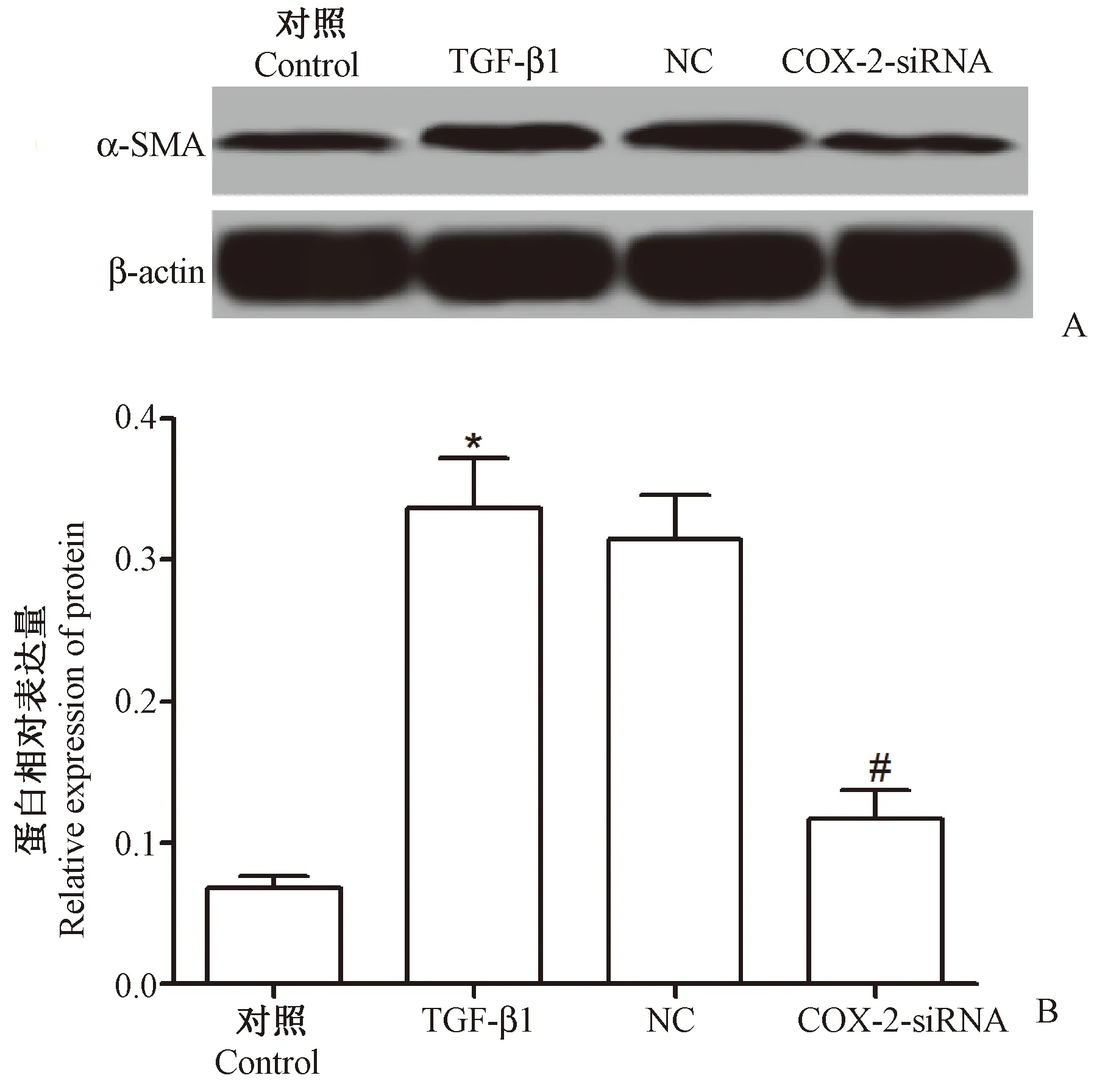
注:A:Western blotting检测α-SMA的蛋白表达;B:α-SMA 的蛋白相对表达量;与Control组比较,*P<0.05;与TGF-β1组比较,#P<0.05。图4 抑制COX-2表达对TGF-β1诱导的MRC-5细胞EMT标志物表达的影响Note. A: Western blotting was used to detect α-SMA protein expression in MRC-5 cells. B: Relative α-SMA protein expression. Compared with the control group,*P<0.05. Compared with the TGF-β1 group,#P<0.05.Figure 4 The effects of inhibition of COX-2 expression on the TGF-β1-dependent induction of EMT markers in the MRC-5 cells
2.5 抑制COX-2表达对TGF-β1诱导的MRC-5细胞Notch信号通路的影响
通过Western blotting检测Notch信号通路受体Notch1 和配体Jagged1的蛋白表达,结果如图5所示,Control组、TGF-β1组、NC组和COX-2-siRNA组Notch1的蛋白表达分别为(0.102±0.010)、(0.826±0.069)、(0.810±0.065)、(0.257±0.032),Jagged1的蛋白表达分别为(0.075±0.008)、(0.259±0.031)、(0.262±0.034)、(0.109±0.017),4组的Notch1、Jagged1的蛋白表达比较差异具有统计学意义(F1=166.102,F2=46.923,P<0.05),与对照组比较,TGF-β1组Notch1和Jagged1的表达均显著升高(P<0.05),与TGF-β1组比较,COX-2-siRNA组Notch1和Jagged1的表达均显著降低(P<0.05)。

注:A:Western blotting检测Notch1 和Jagged1的蛋白表达;B:Notch1 和Jagged1的蛋白相对表达量;与Control组比较,*P<0.05;与TGF-β1组比较,#P<0.05。图5 抑制COX-2表达对TGF-β1诱导的MRC-5细胞Notch信号通路的影响Note. A: Western blotting was used to detect Notch1 and Jagged1 protein expression. B: Relative expression of Notch1 and Jagged1 protein. Compared with the control group,*P<0.05. Compared with the TGF-β1 group,#P<0.05.Figure 5 The effects of inhibition of COX-2 expression on Notch pathway signaling in the MRC-5 cells activated by TGF-β1
3 讨论
PF是常见的一种肺间质疾病,目前尚缺乏治疗该病的有效方法,已有研究表明肺FB的增殖、分化、活化是影响PF的中心事件[9]。FB的增殖或凋亡不足是形成PF的一个重要环节,降低FB的增殖和活化,诱导其凋亡可有效的降低PF[10]。目前PF的病因及发病机制尚未清楚,但可以明确的是多种细胞因子影响了PF的发生发展,TGF-β在这些细胞因子中尤为重要,TGF-β可促使FB表型向肌FB表型转化,而肌FB内的α-SMA与组织器官收缩存在密切联系,且分泌ECM,从而在PF发病机制中发挥重要作用[11-12]。目前,已有大量研究表明TGF-β1可通过刺激FB细胞的增殖、胶原合成、分化等,从而引起PF的发生发展[13-14]。COX-2是一个重要的在合成前列腺素过程中的限速酶,目前在PF中的研究较少,有研究显示,在肺纤维化大鼠及患者肺组织中存在COX-2的高表达,COX-2的抑制剂可降低肺泡早期炎症[15-16];抑制肺组织中COX-2表达可对大鼠肺损伤起到保护作用[17]。目前关于COX-2对TGF-β1诱导的FB生长影响尚未明确。
鉴于此,本研究试图在细胞水平上研究抑制COX-2表达对MRC-5细胞影响,通过TGF-β1刺激及COX-2的siRNA转染MRC-5,可发现TGF-β1刺激可明显提升MRC-5细胞活力,而抑制COX-2后细胞活力明显降低。提示COX-2可影响TGF-β1诱导的MRC-5细生长。
在PF时可形成大量胶原纤维,在PF时肺内的胶原蛋白代谢失衡,肺间质可沉积大量的胶原纤维,随着数量增多最终可导致肺发生弥漫性纤维化[18-19]。COL-Ⅰ和COL-Ⅲ是胶原纤维主要生化成分,有研究显示,在PF时COL-Ⅰ和COL-Ⅲ的表达均明显增多[20]。在TGF-β1诱导的PF中,α-SMA、波形蛋白、N-钙黏蛋白等间质表型标志物表达升高,因此选择α-SMA作为评定TGF-β1诱导的上皮间充质转化的机制[21]。本研究结果显示,TGF-β1刺激可上调COL-Ⅰ、COL-Ⅲ、α-SMA表达,而COX-2-siRNA可抑制其表达。这提示抑制COX-2表达可通过下调COL-Ⅰ、COL-Ⅲ、α-SMA表达降低PF的胶原合成及转化。
多项研究表明,Notch信号通路在PF中发挥重要作用,尤其在FB向肌FB转化中尤为重要[22]。有研究显示,Notch信号通路受体Notch1和配体Jagged1在TGF-β1刺激FB细胞中表达升高,阻断Notch信号通路后Notch1和Jagged1的表达均明显降低[23-24]。本研究结果显示,TGF-β1刺激可上调MRC-5细胞Notch1和Jagged1的表达,COX-2-siRNA可降低MRC-5细胞Notch1和Jagged1的表达。提示COX-2可能通过抑制Notch信号通路降低PF发生发展。
综上所述,本研究发现抑制COX-2基因表达可能通过降低人胚肺成纤维细胞系MRC-5细胞活力、抑制胶原合成和转化及下调Notch信号通路,从而对肺纤维化起保护作用。本研究提示COX-2可能是一个反映纤维化程度的新型指标,可能成为新的用于抗肺纤维化的分子治疗靶点。值得进一步深入探究。

