野罂粟碱对哮喘和溃疡性结肠炎模型大鼠肺及结肠组织相同差异表达基因的干预作用
付骞卉,柯愈诗,宋铭晶,刘伟志*
(1. 中央民族大学药学院,民族医药教育部重点实验室(中央民族大学),北京 100081;2. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021)
野罂粟(PapavernudicauleL.)为罂粟科罂粟属的药用植物, 以全草或花入药,其味微苦微寒且酸涩,归肺、大肠、胃、肾经。在北方各少数民族中临床用于镇咳、止泻时间已久。《吉林中草药》记载野罂粟镇咳、涩肠等。目前发现野罂粟全草的主要有效成分为生物碱,既能拮抗白三烯与其受体结合阻止炎症反应导致支气管痉挛和气道高反应,又能有效降低溃疡结肠炎模型大鼠血管活性肠肽及其受体含量,改善腹泻症状促进肠黏膜组织修复,相关研究证实野罂粟碱具有镇咳平喘、止泻的作用[1-2]。
前期研究中发现野罂粟碱镇咳止泻的主要活性成分野罂粟碱在模型大鼠的结肠组织和肺组织中有较高浓度富集,能引起肠炎大鼠肺、大肠胞内环核苷酸含量出现显著生物学变化,实验结果初步揭示野罂粟碱的药效作用途径与其归经作用相关[3]。归经,指药物作用归属, 即表示药物对机体的选择性作用[4-5]。本研究基于转录组测序技术获得关于特定条件下大鼠肺和结肠组织中几乎所有转录物序列的全面信息,从而分析出肺、肠组织相同差异表达基因[6-7]。通过建立大鼠过敏性哮喘动物模型[8]及溃疡性结肠炎动物模型[9],给与野罂粟碱治疗后,观察野罂粟碱对两组模型大鼠肺、肠组织相同差异表达基因的调控作用,试图部分揭示野罂粟归肺、大肠经的分子内涵。
1 材料和方法
1.1 实验动物
SPF级SD大鼠(200 ~ 220 g),72只,雄雌各半,鼠龄8 ~ 10周,由斯贝福(北京)生物技术有限公司提供[SCXK (京) 2016-0002]。饲养环境为SPF级动物房[SYXK (京) 2016-0043],12 h/12 h昼夜循环照明及常温环境,自由饮食饮水适应性饲养7 d。无菌手术在SPF级动物房内实验操作室[SYXK (京) 2016 - 0043]进行。本实验涉及的动物饲养及动物实验方案已得到中央民族大学生物与医学伦理审查委员会批准[ECMUC-2018-12],并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
野罂粟药材干燥全草采集自河北承德坝上草原,经中央民族大学药学院朱丹教授鉴定为罂粟科罂粟属植物野罂粟种 (PapavernudicauleL.)。
TRIzol(Invitrogen公司,USA,货号:MRN2100);DNase I(Fermentas(MBI)公司,USA, 货号:MRT1009);RNase抑制剂(Fermentas(MBI)公司,货号:MRT1007);Buffer, dNTP (宝生物工程(大连)有限公司), 2 ×Ex TaqMix(宝生物工程(大连)有限公司,货号:MPC1001);DL2000 DNA Marker(宝生物工程(大连)有限公司, 货号:DM0101);
Illumina 平台PCR仪(美国ABI公司,2720型);电泳槽(日本TaKaRa公司,Mupid 2plus);凝胶成像系统(韩国Korea Biotech公司,EUV-LDUV);离心机(韩国Hanil公司,MICRO 17TR);漩涡混合器(美国SI公司,Voltex-Genie2);实时荧光定量PCR系统(德国Roche公司,480II)。
1.3 实验方法
1.3.1 实验药物野罂粟有效成分(总生物碱)的制备
取野罂粟全草原植物,切段,用 8 倍量 80% 乙醇回流提取3次(2 h/次),回收溶剂,盐酸调 pH=3 ~ 4 的酸水溶解浸膏,静置,过滤,适量氯仿洗去脂溶性杂质,酸水液用浓氨水调节 pH=10 ~ 11,氯仿萃取 5 ~ 6 次,回收氯仿,得野罂粟碱脂溶性总生物碱,冷冻干燥,保存备用。使用时取野罂粟碱总生物碱按给药剂量配置含生药0.18 g/mL浓度的溶液,水浴加热至 25°C。
1.3.2 动物模型建立
(1)过敏性哮喘大鼠模型:将OVA 1 mg 和氢氧化铝 200 mg 溶于生理盐水 1 mL 中新鲜配制成凝胶致敏剂,第1 天和第7 天在大鼠双侧胸部,腹股沟共4 点各皮下注射0.15 mL该致敏剂,同时腹腔注射0.4 mL共计1 mL进行致敏。14 d开始将大鼠置于有机玻璃盒内,超声雾化吸入1% OVA 诱发哮喘,每天 1 次,每次30 min,共计1 周。以大鼠出现喷嚏、咳嗽、呼吸急促等典型哮喘样发作为标准验证是否造模成功。
(2)溃疡性结肠炎大鼠模型:取健康家兔结肠黏膜组织,无菌生理盐水匀浆, 4°C离心,3000 r/min,30 min,取上清,双缩脲法进行蛋白定量,加入等体积的完全弗氏佐剂,制成抗原乳化液。分别于第1、15、22、29天注射抗原乳化液于SD大鼠足跖、腹股沟等部位,每次含抗原8 mg。第29天麻醉后进行浓度为120 mg/mL的三硝基苯磺酸-50%乙醇 1∶1 比例灌肠复制UC 模型。通过对 UC大鼠模型的体重、大便等形态学方面的变化及便潜血实验对模型进行评价。
1.3.3 分组及给药
SD大鼠单只单独饲养,雌雄各半,选取同批大鼠设两组空白组(每组12只),其余SD大鼠按上述方法造模, 造模成功后随机分哮喘模型组12只和哮喘给药组12只与UC组12只和UC给药组12只。空白组和两组模型组给与等计量溶媒灌胃2 mL,给药剂量按照大鼠和人的体表面积比确定大鼠的给药量,即大鼠的给药量(kg/d)=0.018×5×人的最大给药量。野罂粟碱治疗组:180 mg/kg。连续给药7日,末日禁食禁水 24 h次日动物常规处死,解剖剪取新鲜同一位置肺组织块与肛门上2~8 cm处结肠组织块。
1.3.4 HE染色观察模型形态学变化
截取部分大肠组织和肺组织固定于4%多聚甲醛,经酒精梯度脱水(70%、80%、90%、100%I、100%II),二甲苯石蜡包埋后将组织切成5 μm厚的薄片,并贴于载玻片上制成石蜡切片,60℃ 恒温烘烤2 h,将石蜡切片保存。取各组的石蜡切片经二甲苯脱蜡、酒精梯度复水(100%I、II、90%、80%、70%),水洗,苏木精-伊红(HE)染色,在光镜下观察各个组的组织结构并获取图像。
1.3.5 转录组测序分析后KEGG注释相同差异表达基因
使用分析软件 Cuffdiff,依据所有样本与参考基因组比对的结果,计算每个基因在样本中的 FPKM 值,以该值作为基因在样本中的表达量。将两个模型组分别与空白组进行差异显著性分析,识别出有相同差异表达的基因基于 KEGG 数据库,运用 BLAST 算法(blastx/blastp 2.2.24+)进行KEGG注释。为控制计算假阳性率,采用FDR方法进行多重检验,找出有相同差异表达的信号通路。
1.3.6 Real-time PCR检测C-C基序趋化因子11,碳酸酐酶1,核激素受体亚家族D组成员1的mRNA表达水平
(1)RNA提取:剪取新鲜的溃疡组织样品和哮喘肺组织样品放入盛有1 mL变性缓冲液(TRIzol)的匀浆器中,冰浴 (将匀浆液移至1.5 mL EP管中,15℃~30℃ 静置5 min(加入0.2 mL三氯甲烷充分混匀15 s,静置 (15℃~30℃) 2~3 min,4℃ 12 000 r/min离心15 min,取上层水相置于新的离心管内,加入等体积的异丙醇,混匀后静置10 min,4℃ 12 000 r/min离心10 min。 弃去上清,加入1 mL的80% 乙醇清洗沉淀,4℃ 12 000 r/min离心10 min,室温风干沉淀,用 20 μL DEPC水溶解沉淀,取2 μL稀释100倍后测定260 nm 吸光度 A,计算RNA 浓度。
(2)逆转录反应合成cDNA 逆转录反应体系:0.1 mol/L DTT 2 μL,5×RT-buffer 4 μL,10 mmol/L dNTPs 1 μL,RNase (40 U/μL) 0.5 μL,Oligo(dT)18(50 nmol/L)2 μL, M-MLV(200 U/μL)1 μL, RNA模板2 μg, DEPC水加至20 μL。逆转录反应条件:42℃ 60 min,70℃ 15 min,在冰上冷却5 min备用定量PCR。
(3)引物设定:根据引物设计原则利用Primer 6.5设计Ca1、Ccl11和Nr1d1基因的引物,见表1,实验重复3次,引物由北京天一辉远生物科技有限公司合成,以GAPDH作为内参。

表1 引物序列
(4)实时定量PCR:实时定量PCR反应体系的配制:2 Ex TaqMix5 μL,Eva green 5 μL,cDNA模板1.0 μL,目的基因上游引物0.3 μL,下游引物0.3 μL,cDNA模板1.0 μL,ddH2O补至10 μL。实时定量PCR反应条件:95℃ 5min预变性后,95℃ 15 s→65℃ 30 s(荧光检测),45个循环。熔解曲线65℃~95℃。在 120 V 的电压水平下,制备 2% 琼脂糖凝胶,并提取 5 μL PCR 反应产物上样于 其中进行电泳,观察并摄取图像。用Quantity One软件进行图像半定量分析,测定光密度值。
1.4 统计学方法
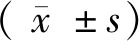
注:(1)结肠的形态学结果(10×10);(2)肺组织的形态学结果(10×10)。图1 各组大鼠肠与肺组织的组织学改变(HE染色)Note. (1) Colon tissues of each group (10 × 10). (2) Lung tissues of each group (10 × 10). Figure 1 Histological changes of the lung and intestinal tissues in each group of rats.HE staining
2 结果
2.1 哮喘模型和UC模型的评价
实验发现经造模措施处理后,大鼠活动减少形体消瘦,毛发色泽灰暗凌乱,哮喘模型组的大鼠尤其在雾化后呼吸急促呼吸频率明显增高,并且大便时干时稀。溃疡性结肠炎大鼠便血、大便不成型大便次数增多。
2.2 大鼠病理形态学观察结果
如图1所示,正常对照组为正常组的结肠(1)和肺组织(2),图(1)A结肠壁的四层分层(黏膜层、黏膜下层、肌层和外膜)明显且结构完整,图(2)A低倍镜下肺组织中的肺泡结构完整。UC模型组结肠组织(1)和肺组织(2),通过图(1)B可以看出结肠组织的四层分层不明显,上皮不完整有明显的溃疡存在,在结肠壁的各层有大量弥散淋巴细胞;图(2)B显示肺泡结构完整,但肺泡隔厚局部有炎症团,说明结肠有炎症同时肺组织也存在炎症。给野罂粟碱后UC模型组结肠四层结构明显,肺组织中肺泡完整,但肺泡隔仍比正常组厚,但比模型组薄。经过治疗后UC组和哮喘组的肺、结肠组织的炎症反应均有一定的缓解见图C。图(1)D中结肠组织结构完整,但是黏膜层中溃疡存在;图(2)D中在细支气管壁附件有大量炎症细胞,但周围肺泡与正常组相似,肺泡隔薄结构完整;图(1)E四层结构明显,大肠腺排列整齐,图(2)E肺边缘处仍有炎症存在,肺泡隔较厚。经给药的大鼠食欲恢复大便逐渐成形,急促呼吸频率减少。
2.3 转录组测序哮喘模型和溃疡性结肠炎模型检测差异表达基因结果
转录组测序后,将显著表达的基因编号进行KEGG注释分析得到共同差异表达的基因分别为核受体亚家族1D1组,碳酸酐酶1及C-C基序趋化因子11。见表2。
2.4 野罂粟碱对两组模型大鼠肺和肠组织中Ccl11 mRNA、Ca1 mRNA及 Nr1d1 mRNA表达的影响
RT-PCR实验结果表示关键差异表达基因表达水平的变化与测序结果上下调情况基本一致,见表3、表4和图2。Ccl11 mRNA表达在图A中与空白组相比Ccl11 mRNA表达显著升高(P<0.001),与模型组比较,给药组表达显著降低,统计结果具有显著性差异(P<0.01)。图B中UC模型组与空白组相比表达显著升高(P<0.001),与UC模型组比较,给药组表达显著降低(P<0.001)。图C中哮喘模型组表达显著高于空白组(P<0.01),与模型组对比,给药组表达降低(P<0.01)。图D中模型组表达显著高于空白组(P<0.001),与模型组对比给药组表达明显降低(P<0.001)。Ca1 mRNA表达在图E中,哮喘模型组表达显著降低(P<0.001),而给药组表达升高(P<0.001)。图F中UC模型组表达显著降低(P<0.001),给药组表达升高(P<0.001)。图G中,与空白组对比,哮喘模型组表达显著低于空白组(P<0.001),但给药组表达升高(P<0.01)。图H中,UC模型组表达显著低于空白组(P<0.001),给药组表达明显升高(P<0.001)。Nr1d1 mRNA表达在图I中哮喘模型组表达显著降低(P<0.001),给药组表达升高(P<0.001)。图J中UC模型组与空白组相比表达显著降低(P<0.001),与模型组比,给药组表达升高(P<0.001)。图K中与空白组对比,模型组表达显著低于空白组(P<0.05),而与模型组相比给药组表达升高(P<0.001)。图L中与空白组对比,UC模型组表达显著低于空白组(P<0.001),与模型组对比,给药组表达明显升高(P<0.01)。

表2 两组模型肺组织和肠组织共同差异表达基因

表3 野罂粟碱对肠组织中Ccl11mRNA、Ca1mRNA及 Nr1d1mRNA表达的影响
注:与空白对照组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。
Note. Compared with the blank control group,#P<0.05,##P<0.01,###P<0.001. Compared with the model group,*P<0.05,**P<0.01,***P<0.001.

表4 野罂粟碱对肺组织中Ccl11 mRNA、Ca1 mRNA及 Nr1d1 mRNA表达的影响
注:与空白对照组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。
Note. Compared with the blank control group,#P<0.05,##P<0.01,###P<0.001. Compared with the model group,*P<0.05,**P<0.01,***P<0.001.
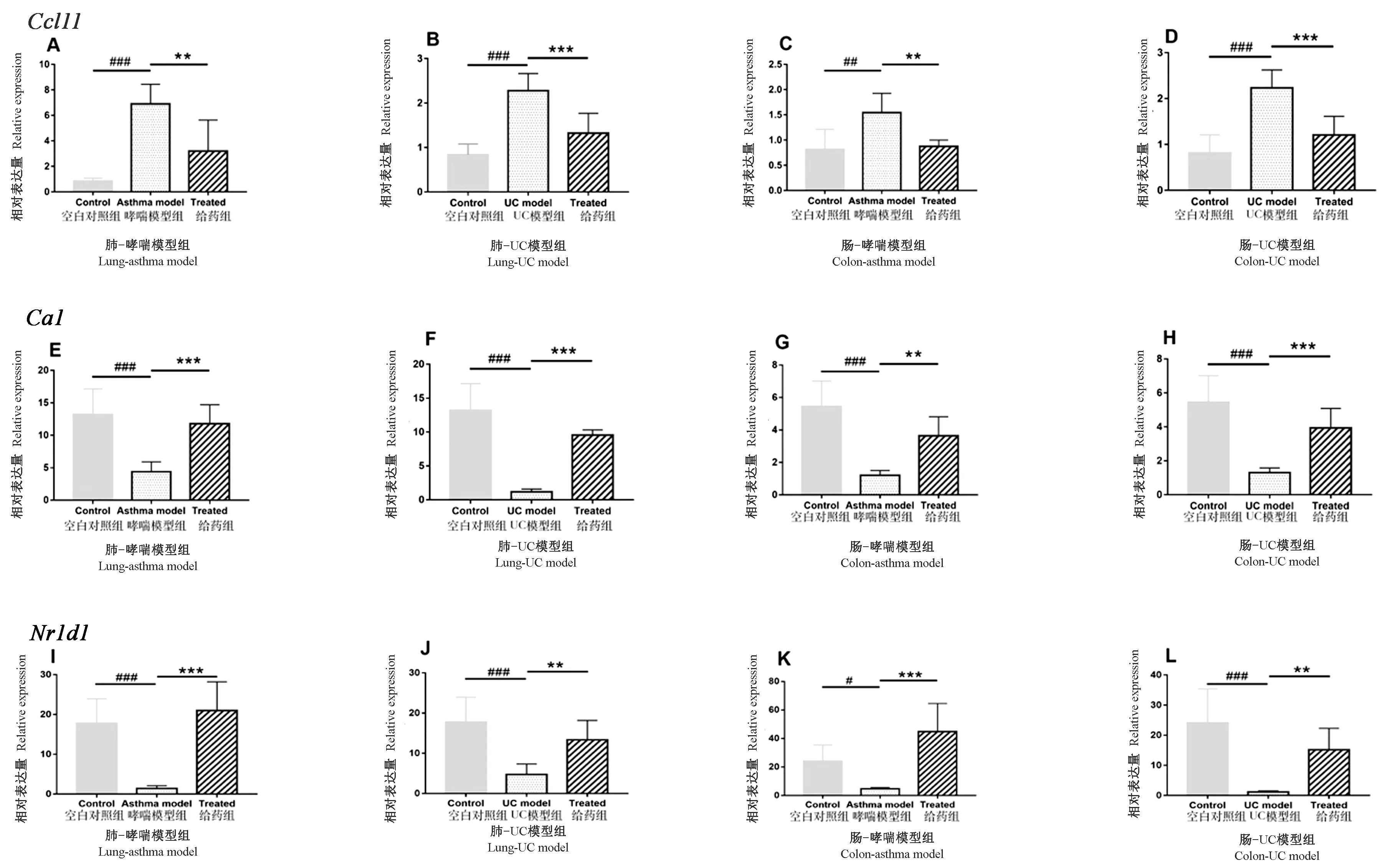
注:模型与空白比较,#P<0.05,##P<0.01,###P<0.001;给药组与模型比较*P<0.05,**P<0.01,***P<0.001。A:哮喘组肺;B:UC组肺;C:哮喘组肠;D:UC组肠;E:哮喘组肺;F:UC组肺;G:哮喘组肠;H:UC组肠;I:哮喘组肺;J:UC组肺;K:哮喘组肠;L:UC组肠。图2 野罂粟碱对Ccl11 mRNA、Ca1 mRNA及 Nr1d1 mRNA表达水平的影响结果Note. Compared with the control group, #P<0.05,##P<0.01,###P<0.001. Compared with the model group, *P < 0.05, **P < 0.01, ***P < 0.001. A: Lung tissue in the asthma model group; B: lung tissue in the UC model group; C: intestinal tissue in the asthma model group; D: intestinal tissue in the UC model group; E: lung tissue in the asthma model group; F: UC model group lung tissue; G: asthma model group intestinal tissue; H: UC model group intestinal tissue; I: asthma model group lung tissue; J: UC model group lung tissue; K: model group intestinal tissue; L: UC model group intestinal tissue.Figure 2 Effect of Papaver nudicaule L. on the expression levels of Ccl11 mRNA, Ca1 mRNA, and Nr1d1 mRNA
3 讨论
过敏性哮喘 (allergic asthma,AA)的气道反应性增高、间歇性可逆气道阻塞和气道炎症是其主要特征。溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病的主要代表之一。最近研究报道发现炎性肠病中溃疡性结肠炎的患者增加并发哮喘的可能性[10]。另一方面,在Raj等人[11]临床研究中也发现呼吸道疾病患者炎性肠病发病率与普通人相比增加了四倍。然而此类并发症的发病机制还未阐明,但在传统医学理论《黄帝内经·灵枢·本输》记载“肺合大肠,大肠者传导之府”最早提出了肺与大肠相表里理论,认识到肺、肠在功能上互联,在病理条件下相互影响[12]。长期的中医临床实践也发现 当肺功能失常,气机不利,则势必影响大肠传导功能,出现大便困难或腹泻,表现出肺病可及肠;而若肠腑壅实,肠腑气机失调,终致肺失宣肃,出现咳嗽气喘,表现为肠病可及肺[13]。因而中医在治疗方针中提出肺肠合治、肺病治肠和肠病治肺等治则。通过RNA-Seq最终得到三个关键差异表达基因C-C基序趋化因子11,碳酸酐酶1,核激素受体亚家族D组成员1。采用RT-PCR验证,与测序结果表达一致,说明结果重复性较好稳定性高。经给药后,发现野罂粟碱使两组模型肺和结肠组织中C-C基序趋化因子11表达与模型组相比显著降低,而碳酸酐酶表达和核激素受体亚家族D组成员表达显著升高。
C-C基序趋化因子11(Ccl11)是野罂粟归经作用的关键基因之一,也称为嗜酸性粒细胞趋化因子,参与哮喘患者嗜酸性粒细胞气道募集的趋化因子参与免疫反应包括先天性和适应性免疫反应[14]。有研究表明过敏性哮喘患者持续气道嗜酸性粒细胞增多,Ccl11表达水平对于诱发哮喘病症有实质性的贡献。另有研究已经证实了Ccl11在结肠炎中的关键作用,UC的两种动物模型中,DSS结肠炎模型和急性恶唑酮结肠炎模型受损小鼠的结肠组织中都发现Ccl11水平增加[15-16]。碳酸酐酶(carbonic anhydrase(Ca)1)也是野罂粟归经作用的关键基因之一,其属于Cas同工酶,广泛分布在肺泡上皮细胞,其催化反应对呼吸作用极为重要[17-18]。而在消化道,Ca主要定位于结肠上皮细胞帮助肠道吸收养分。白雪[19]等人研究表示,Ca在正常肠粘膜高表达,但在癌组织中明显下调,Ca不仅是人体内调节酸碱内环境稳定的关键酶,而且可以降低肿瘤的侵袭能力和炎症反应的趋化能力。本次研究野罂粟归经作用的关键基因Nr1d1(nuclear receptor subfamily 1, group D, member 1),其在炎症反应中占有重要地位[20]。最近的研究表明睡眠障碍与炎症性疾病活动有关[21]。有报道发现Nr1d1具有通过改变肺部昼夜节律功能从而改善哮喘患者的呼吸功能和炎症的能力[22]。另外Polidarova[23]等人发现昼夜节律的变化也是炎性肠病尤其是结肠炎的发病机制。正常情况下,免疫系统具有昼夜节律性,但如果昼夜节律紊乱可能对肠黏膜屏障产生影响且破坏肠黏膜中的肠道微生物稳态产生炎症反应[24]。
本研究在分子水平首次证明了野罂粟归肺与大肠经可能是通过调控这两类疾病共同表达的相关基因。野罂粟碱治疗后降低两组大鼠模型Ccl11基因的表达,抑制了嗜酸性粒细胞向肺及肠道的浸润募集,并且野罂粟碱能够上调哮喘模型大鼠和UC模型大鼠肺组织和肠组织中Ca1和Nr1d1基因从而抑制促炎因子作用且降低趋化因子活性,HE染色结果也提示野罂粟碱能够促进肺肠组织的修复功能的恢复。这项研究还有一定的不足,需进一步敲除关键基因观察野罂粟碱治疗哮喘模型和UC模型与空白对照组病理变化的差异性,探究其中潜在的分子基础[25]。综上所述,哮喘模型和UC模型大鼠肺与肠组织中的Ccl11、Ca1和Nr1d1基因可能是野罂粟“归肺、大肠经”选择性调节的分子靶点。此外,基因的表达变化可能是呼吸道疾病及炎性肠病相互影响导致发病的重要机制之一,为进一步探索疾病发病机制提供基础。

