黄连多糖通过抑制氧化应激和炎症反应减轻糖尿病大鼠肾损伤的实验研究
周东月,王春璐,任艳平,宋 伍,刘 智,姜 爽*,郭 焱*
(1. 长春中医药大学药学院,长春 130117;2. 长春中医药大学临床医学院,长春 130117;3. 修正药业集团长春高新制药有限公司,长春 130021)
黄连是传统中药材之一,为毛茛科植物,具有抗糖尿病、抗癌及抗炎等多种药理作用,应用广泛[1-2]。研究发现,以黄连为主要成分的黄连解毒汤可以通过调控血糖,下调caspase-3、p38MAPK、TGF-β1的表达及降低氧化应激的水平,发挥保护DN大鼠损伤作用[3]。此外,黄连中的活性成分黄连素也可以通过改善胰岛素抵抗、抑制氧化应激反应、降低糖基化终末产物的含量等机制,改善早期DN患者血管内皮功能,从而发挥对肾的保护作用[4]。本课题组的前期工作也证实,黄连中的水溶性成分黄连多糖(CCPW)具有较好的抗糖尿病和改善胰岛素抵抗作用[5-6]。鉴于以上原因,并充分考虑氧化应激及炎症反应在糖尿病肾病进展中的重要作用,本研究以链脲佐菌素(streptozotocin,STZ)诱导的糖尿病模型大鼠为研究对象,在明确黄连多糖具有减轻肾损伤作用的基础上,探讨其对氧化应激和炎症反应的影响,初步阐明作用机制,从而为黄连多糖的临床应用奠定基础。
1 材料和方法
1.1 实验动物
SD大鼠100只,雄性、清洁级,8周龄,体质量(200 ± 20) g,购自吉林大学实验动物中心[SCXK (吉) 2016-0001],SD大鼠饲养于长春中医药大学净月校区动物房内[SYXK (吉) 2018-0014],饲养于光照12 h/12 h明暗交替、温度(24 ± 2)℃、相对湿度70%条件下。本研究经长春中医药大学动物实验伦理委员会批准(审批号:2017011),实验期间按照3R原则给予实验动物人道关怀。
1.2 主要试剂与仪器
黄连多糖由本实验室自制[7];STZ(纯度>98%,批号0210055701,规格1 g)和氯沙坦钾片(批号180624,规格100 mg)分别购于美国Sigma公司和默沙东公司;SOD(批号20180108)、CAT(批号20170418)、GSH-Px(批号20171219)、MDA(批号20170531)、IL-6(批号20180325)、hs-CRP(批号20171108)和TNF-α(批号20171022)检测试剂盒由南京建成生物技术有限公司提供。QUINTIX224-1CN电子天平(德国赛多利斯公司),B200 V全自动生化分析仪(南京英诺华公司),XI5300荧光倒置显微镜(日本Olympus公司),754紫外可见分光光度计(上海菁华公司),Multiskan FC酶标仪(美国赛默飞世尔公司)。
1.3 实验方法
1.3.1 糖尿病模型建立、分组及给药
SD大鼠适应环境1周后,糖尿病大鼠模型采用腹腔注射STZ(60 mg/kg)法建立。将建模成功的大鼠(血糖≥16.7 mmol/L)按体质量随机分为模型组、d黄连多糖高(300 mg/kg/d)、低(100 mg/kg/d)剂量组及氯沙坦钾组(30 mg/kg/d),每组10只;另随机选取SD大鼠10只作为正常组。糖尿病模型建立成功的第2 d灌胃给药,1次/d;而模型组大鼠和正常组大鼠用等体积的生理盐水灌胃,给药持续8周。给药期间记录体质量变化情况。
1.3.2 血清Scr、BUN含量测定及24 h尿蛋白定量
给药结束后,腹主动脉取血,离心分离血清,低温保存备用;一部分血清采用全自动生化分析仪检测Scr和BUN水平,剩余血清用于测定IL-6、hs-CRP和TNF-α含量。代谢笼收集大鼠24 h尿液,尿蛋白定量采用考马斯亮蓝G-250法测定。
1.3.3 肾组织病理观察
主动脉取血完成后,颈椎脱臼法处死大鼠,无菌分离肾组织;精确称重并记录;一部分肾组织用于SOD、CAT、GSH-Px活性及MDA含量等抗氧化指标的测定,另一部分肾组织采用HE染色法观察黄连多糖对肾组织病理改变的影响。
1.3.4 肾组织SOD、CAT、GSH-Px活性及MDA含量检测
取“1.3.3”中剩余肾组织,放在冰上,加入预冷至0℃的生理盐水,比例为1∶10;充分研磨,离心,取上清液,制备10%肾组织匀浆液;采用分光光度法,按照SOD、CAT、GSH-Px活性及MDA含量检测试剂盒说明书的操作步骤进行检测。
1.3.5 血清IL-6、hs-CRP和TNF-α含量检测
取“1.3.2”中剩余血清,采用ELISA法,按照IL-6、hs-CRP和TNF-α含量检测试剂盒说明书的操作步骤进行检测。
1.4 统计学方法

2 结果
2.1 黄连多糖对各组大鼠体质量与肾质量体质量比的影响
与正常组比较,从第2周开始,模型组大鼠体质量显著降低(P<0.05),这种趋势一直持续到给药结束;而肾质量体质量比显著增加(P<0.05)。与模型组比较,氯沙坦钾组及黄连多糖高剂量组、低剂量组大鼠体质量均有不同程度的增加,从第6周开始,差异有统计学意义(P<0.05);而肾质量体质量比显著下降(P<0.05)。见表1。
2.2 黄连多糖对各组大鼠血清Scr、BUN含量及24 h尿蛋白定量的影响
模型组大鼠血清BUN、Scr含量及24 h尿蛋白定量均明显升高,与正常组相比,差异有统计学意义(P<0.05);氯沙坦钾组及黄连多糖高剂量组、低剂量组大鼠血清BUN、Scr含量及24 h尿蛋白定量均明显降低,与模型组相比,差异有统计学意义(P<0.05);与氯沙坦钾组比较,黄连多糖高剂量组、低剂量组大鼠血清BUN、Scr含量及24 h尿蛋白定量均明显增加,差异有统计学意义(P<0.05)。见表2。
2.3 黄连多糖对各组大鼠肾组织病理的影响
正常组大鼠肾未见明显病理变化,组织结构清晰;模型组大鼠系膜细胞及系膜基质增生明显,肾小球硬化,肾小管上皮细胞出现空泡变性;氯沙坦钾组及黄连多糖高剂量组、低剂量组大鼠肾组织病理改变较模型组减轻。结果见图1。
2.4 黄连多糖对各组大鼠肾组织SOD、CAT及GSH-Px活性及MDA含量的影响
模型组大鼠肾组织SOD、CAT及GSH-Px活性显著降低,而MDA含量则明显升高,与正常组比较,差异有统计学意义(P<0.05);氯沙坦钾组及黄连多糖高剂量组、低剂量组大鼠肾组织SOD、CAT及GSH-Px活性显著升高,而MDA含量则明显降低,与模型组比较,差异有统计学意义(P<0.05);与氯沙坦钾组比较,黄连多糖高剂量组、低剂量组大鼠肾组织SOD及低剂量组CAT、GSH-Px活性显著降低,而高剂量组、低剂量组MDA含量则明显升高,差异有统计学意义(P<0.05)。见表3。
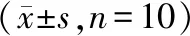
表1 黄连多糖对各组大鼠体质量与肾质量体质量比的影响
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与氯沙坦钾组比较,&P<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the losartan group,&P<0.05.
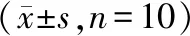
表2 黄连多糖对各组大鼠血清Scr、BUN含量及24 h尿蛋白定量的影响
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与氯沙坦钾组比较,&P<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the losartan group,&P<0.05.
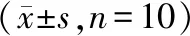
表3 黄连多糖对各组大鼠肾组织SOD、CAT及GSH-Px活性及MDA含量的影响
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与氯沙坦钾组比较,&P<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the losartan group,&P<0.05.

注:a: 正常组; b: 模型组; c: 氯沙坦钾组; d: 黄连多糖高剂量组; e: 黄连多糖低剂量组。图1 黄连多糖对各组大鼠肾组织病理的影响(× 200)Note. a: normal group; b: model group; c: losartan group; d: high-dose CCPW group; e: low-dose CCPW group.Figure 1 Effects of CCPW on renal histopathology in the rats of each experimental group
2.5 黄连多糖对各组大鼠血清IL-6、hs-CRP和TNF-α含量的影响
模型组大鼠血清IL-6、hs-CRP和TNF-α含量明显升高,与正常组比较,差异有统计学意义(P<0.05);氯沙坦钾组及黄连多糖高剂量组、低剂量组大鼠血清IL-6、hs-CRP和TNF-α含量明显降低,与模型组比较,差异有统计学意义(P<0.05);与氯沙坦钾组比较,黄连多糖高剂量组、低剂量组大鼠血清IL-6、hs-CRP和TNF-α含量均呈不同程度的升高,其中黄连多糖低剂量大鼠血清hs-CRP 和TNF-α含量升高明显,差异有统计学意义(P<0.05)。见表4。
3 讨论
糖尿病引起的肾损伤是糖尿病主要的并发症之一,危害巨大[8-9]。研究表明,在长期高血糖状态下,多元醇等氧化活性产物、蛋白质糖基化、自氧化葡萄糖等水平均明显升高,氧化应激与糖尿病引起的肾损伤密切相关[10-11]。SOD、CAT、GSH-Px和MDA是评价机体氧化应激水平的主要指标,SOD能清除O2-保护细胞免受氧化损伤,是生物体内清除自由基中最为重要的抗氧化酶[12]。CAT广泛分布于各类组织中,可以迅速清除细胞的毒性代谢产物,从而对机体起到保护作用[13]。GSH-Px具有维持细胞结构和功能完整性的作用,其主要通过促进过氧化氢的分解、降低过氧化氢水平而实现[14]。MDA含量可以反应机体内脂质过氧化的程度,是评价脂质过氧化产物含量的指标。因此,降低氧化应激水平,将有助于减轻糖尿病引起的肾损伤;研究证实,当归补血汤可以通过降低糖尿病大鼠的氧化应激水平,进而起到抗糖尿病肾病作用[15]。
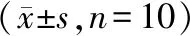
表4 黄连多糖对各组大鼠血清IL-6、hs-CRP和TNF-α含量的影响
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与氯沙坦钾组比较,&P<0.05。
Note. Compared with the normal group,*P<0.05. Compared with the model group,#P<0.05. Compared with the losartan group,&P<0.05.
除氧化应激外,炎症反应在糖尿病引起的肾损伤过程中的作用也逐渐得到了人们的关注;研究表明,在糖尿病患者血清中,IL-6、hs-CRP和TNF-α等炎症因子的含量均明显升高[16]。IL-6可以通过体液免疫和细胞免疫功能介导宿主防御、组织损伤修复和炎症反应等多种生物学过程,由活化单核细胞、血管内皮细胞及成纤维细胞等合成,具有多种生物学效应;此外,IL-6也是联系全身免疫反应和局部血管损伤的主要炎症因子,在合成hs-CRP和急性期反应过程中也发挥重要作用[17]。在高血糖水平下,IL-6一方面可以引起T、B 细胞异常增殖和过度活化,从而促进肾系膜增殖;另一方面,IL-6也可以促进合成hs-CRP,hs-CRP含量增加可以促进单核细胞对内皮细胞的黏附作用,最终加剧其它炎症介质的血管损伤作用[18]。TNF-α由巨噬细胞产生,是主要的炎症因子,可通过自分泌效应作用于其它巨噬细胞,活化的巨噬细胞进而释放多种促炎介质,最终使炎症疾病持续进展[19]。因此,降低炎症反应水平,有助于减轻糖尿病引起的肾损伤;研究证实,芪葵颗粒可以通过降低糖尿病大鼠的炎症反应水平,进而起到抗糖尿病肾病作用[20]。
本研究以我国传统中药黄连中的有效成分黄连多糖为研究对象,探讨其对糖尿病大鼠肾损伤是否具有保护作用。氯沙坦钾为血管紧张肽Ⅱ受体拮抗剂,对长期高血糖引起的肾损伤具有较好的保护作用;同时,相关研究证实,氯沙坦钾具有抗氧化及抗炎作用,因此选择氯沙坦钾作为阳性对照药物[21]。本研究发现,高、低剂量的黄连多糖均对糖尿病大鼠的肾损伤均具有保护作用,且可以抑制氧化应激及炎症反应。虽然黄连多糖高剂量组对模型大鼠肾损伤的保护作用、抑制氧化应激及炎症反应能力均优于低剂量组,但差异并无统计学意义。
综上所述,本研究的相关结果表明,黄连多糖具有减轻糖尿病大鼠肾损伤的作用,该作用与抑制氧化应激及炎症反应有关,但具体的作用机制还有待于深入研究。

