MMP12缺失引起小鼠血液和白色脂肪中巨噬细胞的变化
仰明明,牛 婷,刘 擎,张潇涵,蒋灵笔 ,李豪斌,王丽京,李江超*
(1. 广东药科大学基础学院血管生物学研究所,广州 510006;2. 广东省中医院珠海分院病理科,广东珠海 519015)
MMP12(matrix metalloproteinase-12),于1975年首次在小鼠腹腔的巨噬细胞培养基中发现[1],是MMPs家族的重要成员,是一种广泛底物酶。MMP12也称为巨噬细胞弹性蛋白酶(macrophage elastase),是主要通过巨噬细胞、单核细胞等炎性细胞主动分泌的一种内切蛋白酶,几乎能分解全部细胞外基质成分和血管成分,尤其对富含弹性纤维的血管、肺等组织作用明显,并且是单核细胞募集所必需的[2 - 3]。最早关于MMP12基因敲除小鼠的报道发现巨噬细胞MMP12敲除后降解细胞外基质的能力明显减弱[4]。这种基因工程小鼠可用于免疫学、自身免疫研究、炎症和代谢组学研究及酶缺乏症等表型研究。同时来自MMP12-/-小鼠的巨噬细胞或骨髓细胞显示异常生理功能[3, 5 - 6]。
巨噬细胞(macrophage)属于单个核吞噬系统(mononuclear phagocyte system)中的一类细胞,由于其功能的异质性,在器官发育、清除病原体、介导炎症反应、组织重塑和修复中均发挥着重要作用[7]。不同组织的微环境对其增殖、分化、激活和极化产生不同影响,使其呈现出不同表型,发挥不同生物学功能[8]。巨噬细胞一般可分为经典活化的M1型巨噬细胞和旁路活化的M2型巨噬细胞[9]。M1型巨噬细胞能够帮助宿主抵御病毒和微生物的感染,抑制肿瘤,产生多种炎症因子,从而激活免疫反应;M2型巨噬细胞能够促进细胞碎片的清除、血管生成、基质重塑,损伤组织的修复[10],在肿瘤组织中利于肿瘤的生长[11]。
传统观点认为巨噬细胞由成体骨髓单核细胞分化而来的,即骨髓中的造血干细胞分化为单核细胞,巨噬细胞再从单核细胞分化而来。此外,巨噬细胞还可能来源于卵黄囊和胎肝单核细胞[12],且这些来源的巨噬细胞在出生前已存在组织中,然而不同组织中巨噬细胞确切的来源目前尚不明确[13]。
目前,已知MMP12主要是由巨噬细胞主动分泌的一种内切蛋白酶,但小鼠缺失MMP12后,血液以及白色脂肪中巨噬细胞的具体影响尚不明确。最近一些文献报告显示:在吸烟患者中,巨噬细胞弹性蛋白酶(MMP12)能够抑制白色脂肪组织扩张[14]。并且Heinecke等人发现,MMP12缺失在一定条件下能改变巨噬细胞的浸润与极化。如:在高脂喂养的小鼠中敲除MMP12有助于巨噬细胞向M2型分化[15]。
本研究对MMP12基因缺失小鼠的血常规及巨噬细胞进行了初步分析,发现MMP12能影响血液细胞的发育或分化:与MMP12+/+小鼠相比,MMP12-/-小鼠血液中的巨噬细胞显著下降,但脂肪组织中CD68表达明显增加。结果初步表明MMP12可以改变外周血以及白色脂肪中的巨噬细胞。
1 材料和方法
1.1 实验动物
B6.129X-Mmp12tm1Sds/J基因小鼠,背景是C57BL/6 J小鼠,编号:004855,购自美国Jackson实验室;C57BL/6 J小鼠购自广东省医学实验动物中心[SCXK (粤) 2013 - 0002]。实验动物均在SPF级的环境中饲养[SYXK (粤) 2017-0125],饲养相对温度维持22℃ ~ 28℃,相对湿度维持40% ~ 60%,每天昼夜明暗交替为12 h/12 h,并每天晚上8:00 ~ 10:00为紫外灯照射杀菌时间。本研究中小鼠相关实验获得广东药科大学动物伦理委员会的批准许可,动物福利伦理批准号为:gdpulac2017006,并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
PCR 引物购自上海生工生物有限公司;流式细胞术检测抗体:CD45-precp5.5(B218549)、CD11b-FITC(B22-4362)、F4/80-Bv421(B242663),购自Biolegend公司;免疫组化检测抗体CD68(BA3638), 购自BOSTER公司;DAB显色试剂盒,货号:8059S,购自Cell Signaling Technology公司;红细胞裂解液,货号:GAS-010,购于Life Technologies公司;琼脂糖粉购于西班牙Biowest公司;牛血清白蛋白(BSA)购自上海生工。
苏木素和伊红购于北京世济合力生物科技有限公司;中性树胶,购于广州市秀威贸易有限公司;柠檬酸、柠檬酸三钠购于天津大茂化学试剂厂;无水乙醇、甲醇、二甲苯、氯化钠、氯化钾、30%过氧化氢等购于广州化学试剂厂;包埋盒、载玻片、盖玻片均购于江苏世泰实验器材有限公司;EDTA·K2抗凝管采集血样,进行血常规,流式采血使用ACD抗凝(Sigma)。
独立送回风净化笼具(苏杭实验动物设备厂);PCR仪(美国应用生物系统公司),PCR Mix购自美国Thermo Fisher公司;利用全自动五分类血液分析仪进行检测分析,其型号XT-2000i,SYSMEX日本;检测时,设置小鼠血样程序进行检测。流式细胞仪型号为:BD FACSCantoTMⅡ。
1.3 实验方法
1.3.1 MMP12基因的鉴定PCR方法
MMP12小鼠基因鉴定:野生型条带:引物1∶5′-GCTAGAAGCAACTGGGCAAC-3′,引物3∶5′-ACAT CCTCACGCTTCATGTC-3′,扩增条带为1064 bp。MMP12-/-突变条带: 引物3∶5′-CACGAGACTAGT GAGACGTG-3′,引物4∶5′-ACATCCTCACGCTTC ATGTC-3′,扩增条带为1400 bp。PCR反应条件:94℃预变性3 min,94℃ 30 s、58℃ 50 s、72℃ 1 min;循环38次;72℃延伸10 min,4℃冷却扩增产物。引物3和引物4是鉴定突变型条带,扩增条带为1400 bp,引物1和引物2是鉴定野生型条带,扩增条带为1064 bp。在配置好的1.2%琼脂糖凝胶中,利用TAE电泳缓冲液进行电泳.设定条件:150 V,20 min。再将凝胶放置在凝胶成像系统里,电脑成像系统里观察PCR的电泳结果[16]。
1.3.2 MMP12-/-小鼠血常规检测
取24周龄的MMP12-/-雄性小鼠和MMP12+/+雄性小鼠(体重30 ~ 35 g)各6只。麻醉约1 min,眼眶取血200 μL到1 mL的EDTA·K2抗凝管中待测,使用XT-2000i血细胞分析仪(Sysmex)进行血细胞的分类计数分析,在广东动物监测所进行检测。注意上机前4℃放置。
1.3.3 病理学研究
小鼠颈椎脱臼处死,取小鼠的白色脂肪。10%中性福尔马林固定,常规石蜡包埋切片,HE染色,镜检。免疫组化:一抗为兔多克隆抗体CD68(Boster,BA3638),1∶100,4℃过夜孵育;二抗为过氧化辣根酶标记山羊抗兔IgG,1∶100,37℃1 h,DAB显色2 min,苏木精复染20 s。
1.3.4 流式细胞术检测
小鼠麻醉后眼眶取血,收集新鲜血液置抗凝管中。从血液样本中,各取100 μL血浆原液加入标记好的流式管中,然后分别加入流式荧光抗体CD45-precp5.5、CD11b-FITC、F4/80-Bv421震荡混匀,室温下,避光孵育30 min。最后加入1 mL 1%预冷的多聚甲醛液固定混匀,2~8℃避光保存。在24 h之内进行全血法流式细胞术检测分析,在进行分析前,以白细胞中的单核细胞进行巨噬细胞的设区域设门,检测标本阳性率和荧光强度[17]。
1.4 统计学方法
2 结果
2.1 MMP12-/-小鼠的鉴定
将MMP12+/-雄鼠和MMP12+/-雌鼠杂交,获得的子代有三种情况MMP12+/+、MMP12+/-和MMP12-/-,经鉴定后得到实验鼠突变型小鼠MMP12-/-有一条条带,为1400 bp;野生型小鼠MMP12+/+为1064 bp一条条带;两条条带都有的为杂合子小鼠MMP12+/-,结果如图1。
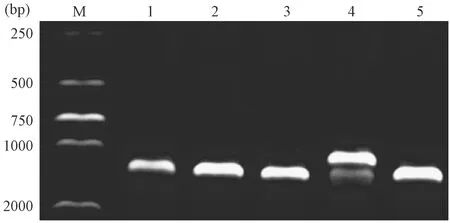
注:M:DNA marker2000;阳性MMP12-/-小鼠为1#、2#、3#、5#,杂合子MMP12+/-小鼠为4#。图1 MMP12基因PCR鉴定图Note. M: DNA marker2000; positive mice MMP12-/- are 1#, 2#, 3#, 5# mice, and heterozygous MMP12+/- mice are 4#.Figure 1 PCR identification of MMP12 gene
2.2 MMP12-/-小鼠的血常规检测
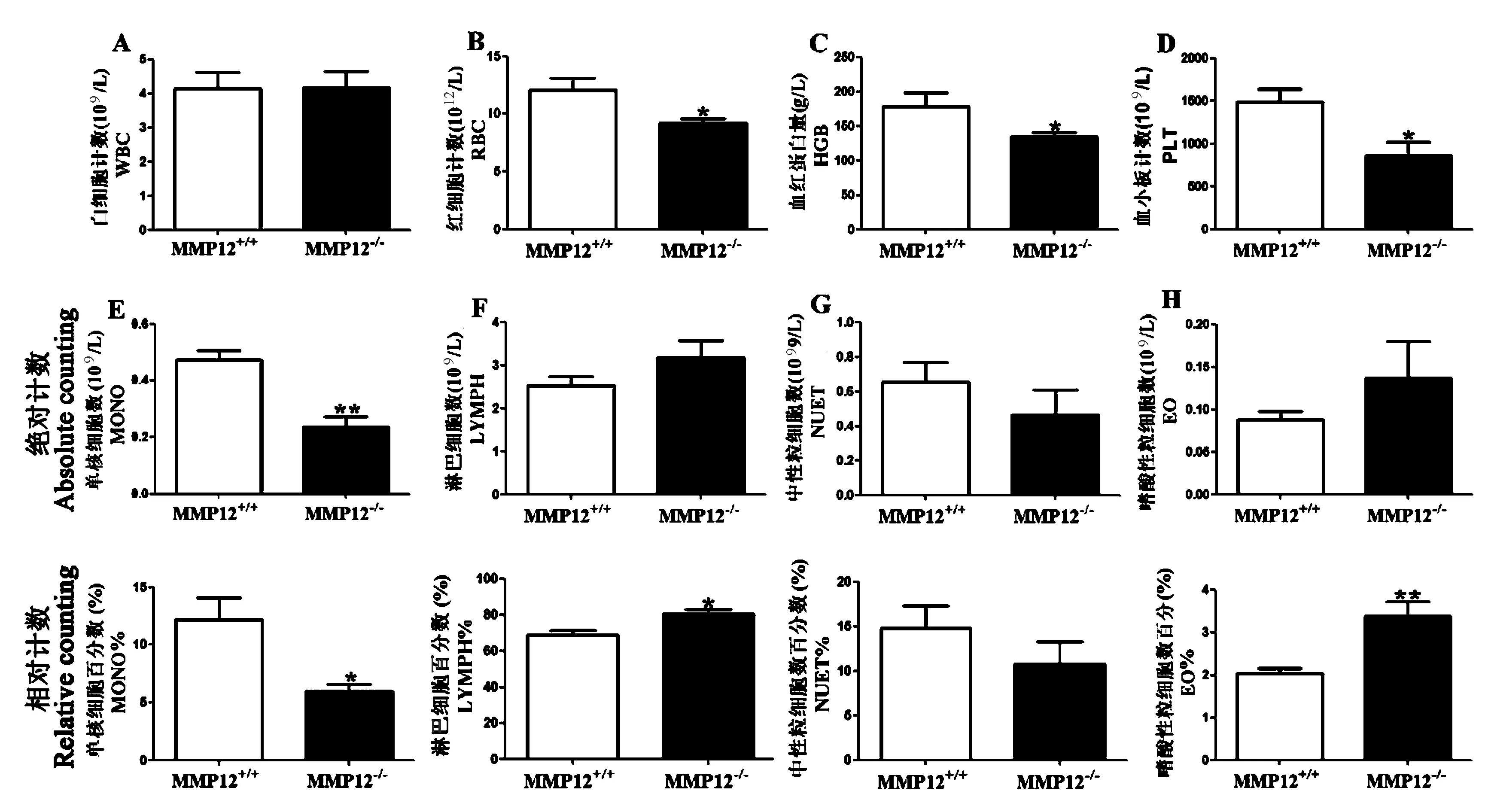
注:A:白细胞总数计数;B:红细胞计数;C:血红蛋白量;D:血小板计数;E:单核细胞数(上),百分数(下);F:淋巴细胞数(上),百分数(下);G:中性粒细胞数(上),百分数(下);H:嗜酸性粒细胞数(上),百分数(下)。*P<0.05;**P<0.01;***P<0.001。图2 血常规中的各项指标Note. A: White blood cell count. B: Red blood cell count. C: Hemoglobin amount. D: Platelet count. E: Monocyte count (top) and percentage (bottom). F: Lymphocyte number (top) and percentage (bottom). G: Neutrophil number (top) and percentage (bottom). H: Eosinophil count (top) and percentage (bottom). *P<0.05;**P<0.01;***P<0.001.Figure 2 Routine blood examination indicators
血常规检测结果显示,白细胞计数、中性粒细胞数以及百分数无显著差异(图2A以及2G)。但MMP12-/-小鼠的红细胞计数、血红蛋白量、血小板计数、单核细胞数以及其百分数与MMP12+/+小鼠相比,均有下降趋势且具有显著性差异(*P<0.05,**P<0.01,图2B、2C、2D以及2E)。淋巴细胞数和嗜酸性细胞数变化不大。但其百分数与MMP12+/+小鼠相比,显著性上升(*P<0.05,**P<0.01,图2F与2H)。
2.3 MMP12-/-小鼠外周血中的巨噬细胞下调
由上述血常规检测结果可知,与同周龄的MMP12+/+小鼠相比,MMP12-/-小鼠的单核细胞数以及其百分数,均有降低趋势且具有显著差异。证明MMP12能影响单核细胞的分化,而巨噬细胞由单核细胞分化而来,所以我们假设MMP12影响单核细胞的分化而导致巨噬细胞的改变[18]。为了进一步验证该假设,我们采用全血法流式细胞术检测巨噬细胞。因为CD11b与F4/80是巨噬细胞表面特异性的标记,可利用二者双阳性的细胞来识别和判断巨噬细胞的变化。所以,我们利用流式细胞术检测白细胞内CD11b与F4/80双阳性细胞来确定巨噬细胞的变化。简单来说,将白细胞中单核细胞群进行设区域设门再进行分析(图3A)。检测结果显示:与MMP12+/+小鼠相比,实验组MMP12-/-小鼠白细胞中CD11b与F4/80双阳性细胞百分比明显下降(图3B与3C),且有显著性差异(*P<0.05,图3D)。
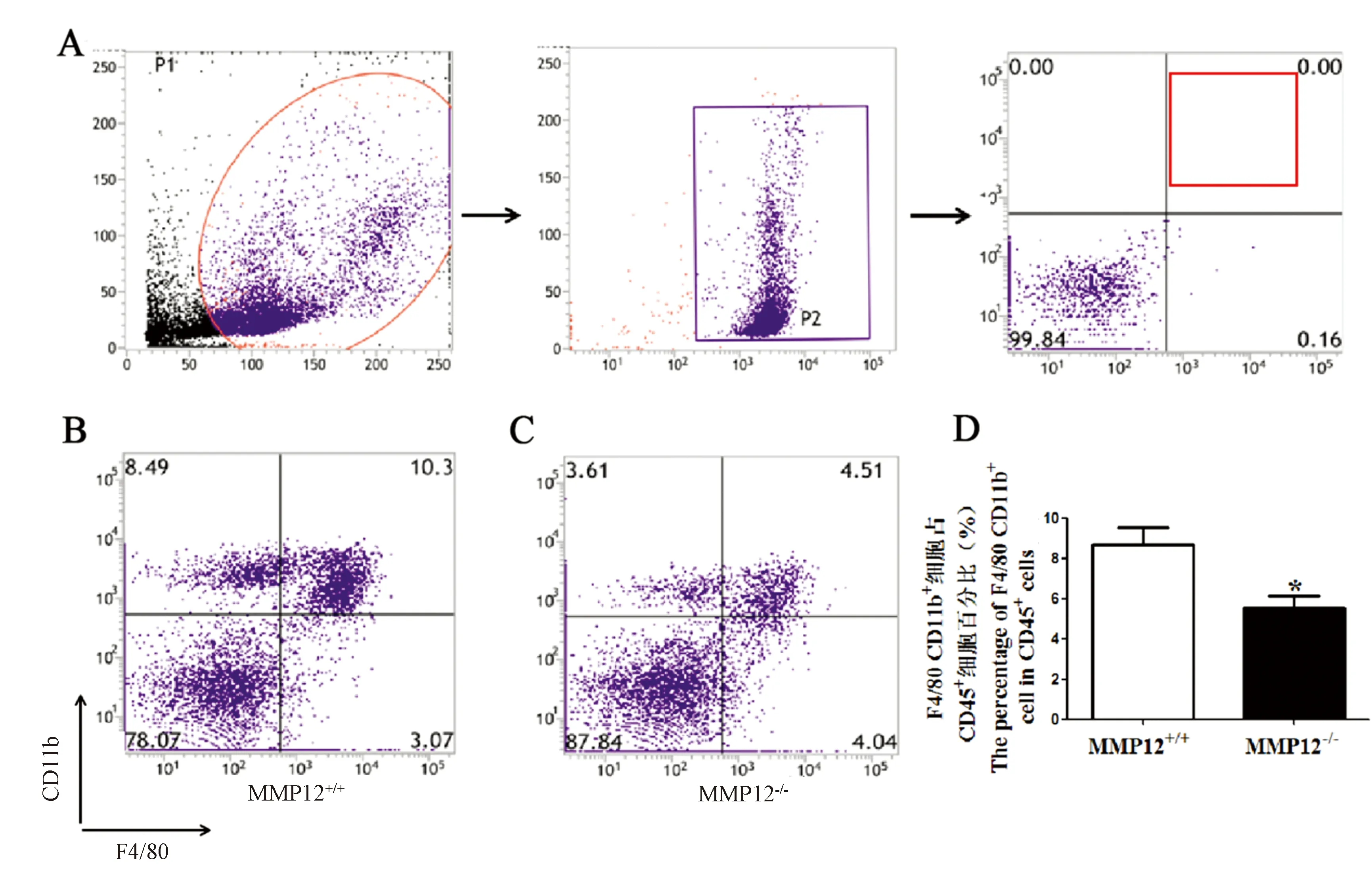
注:A:血液巨噬细胞设门分析示意图;B:对照小鼠血液中的CD11b与F4/80双阳性细胞百分比流式代表图;C:MMP12-/-小鼠血液中的CD11b与F4/80双阳性细胞百分比代表图;D:两组小鼠血液中巨噬细胞百分比统计图,即CD11b与F4/80双阳性细胞的变化,*P<0.05。图3 MMP12-/-与对照小鼠外周血中巨噬细胞流式检测图Note. A: Schematic diagram of blood macrophage gating analysis. B: The percentage of CD11b and F4/80 double-positive cells in the control mouse blood. C: The percentage of CD11b and F4/80 double-positive cells in MMP12-/- mouse blood. D: Statistical analysis of the percentage of macrophages in the blood of the two groups of mice, reflecting the changes in CD11b and F4/80 double-positive cells, *P < 0.05.Figure 3 Flow cytometry of macrophages in peripheral blood of the MMP12-/- and control mice
2.4 MMP12-/-小鼠脂肪组织中的巨噬细胞增多
小鼠颈椎脱臼处死,取小鼠的腹部白色脂肪。4%中性甲醛固定,常规石蜡包埋切片,HE染色,免疫组化染CD68。镜检可得,24周的MMP12-/-小鼠单个白色脂肪细胞面积远大于MMP12+/+小鼠,且有显著性差异(***P<0.001)。与MMP12+/+小鼠相比,24周的MMP12-/-小鼠的白色脂肪组织中大量CD68表达,对巨噬细胞的数量进行统计,且有显著性差异(**P<0.01),结果如图4。
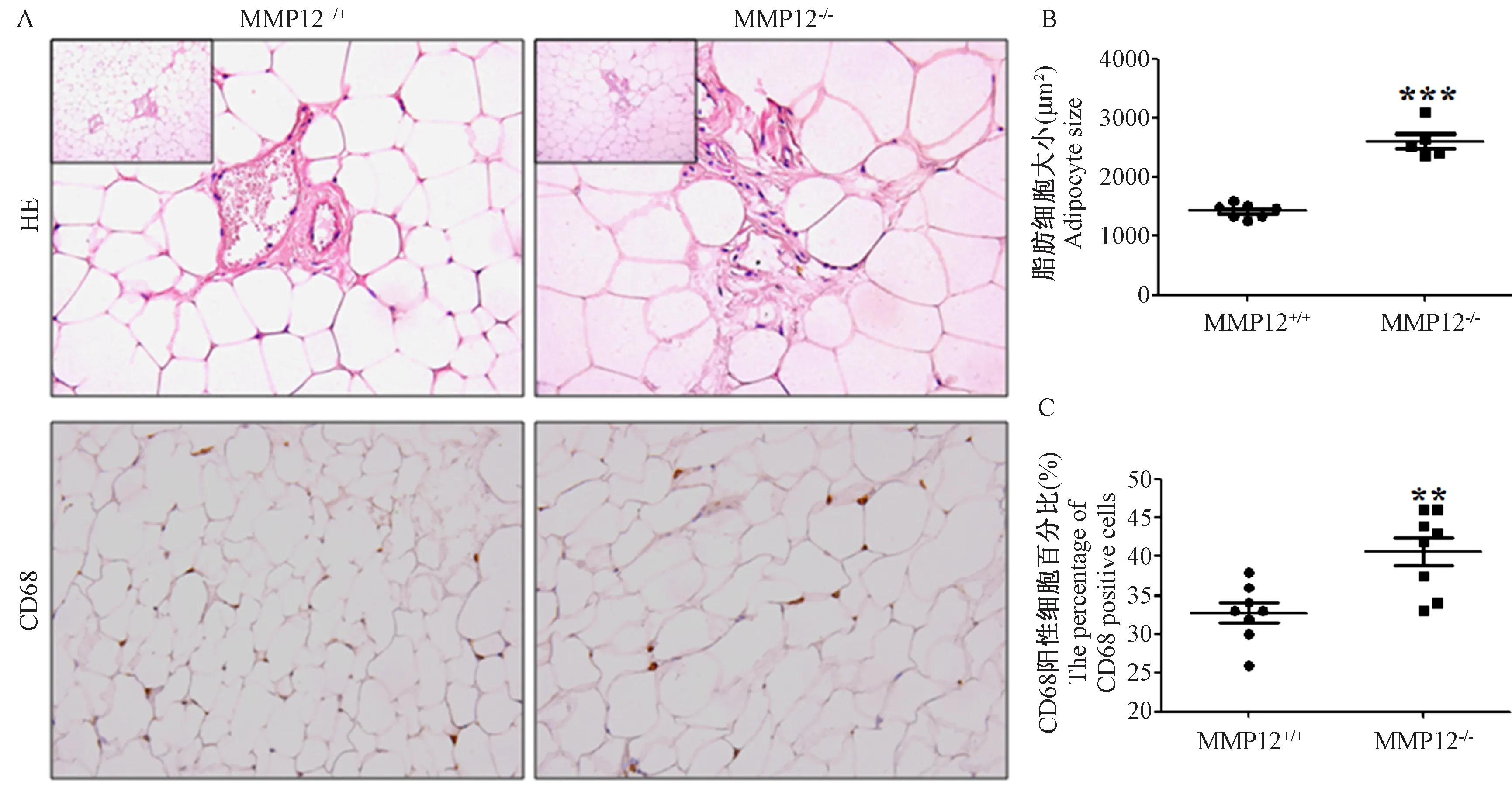
注:A: MMP12-/-与对照小鼠脂肪组织的HE和IHC-CD68染色;B: MMP12-/-与对照小鼠脂肪细胞的大小,***P<0.001;C: MMP12-/-与对照小鼠脂肪组织中巨噬细胞表达量,**P<0.01。图4 MMP12-/-与对照小鼠脂肪组织的HE和IHC染色(× 40)Note. A: MMP12-/- and control mouse adipose tissue subjected to HE and IHC-CD68 staining. B: MMP12-/-and control mouse fat cell size, ***P<0.001. C: The level of macrophages in adipose tissue of MMP12-/-and control mice, **P <0.01.Figure 4 Histology of MMP12-/- and control mouse adipose ttissues. HE and IHC staining
2.5 MMP12敲除对巨噬细胞的影响
上述结果提示巨噬细胞的变化可能与MMP12敲除有关。结果是MMP12敲除导致血液中单核细胞和巨噬细胞减少,白色脂肪中的巨噬细胞增多,图5为其总结图。
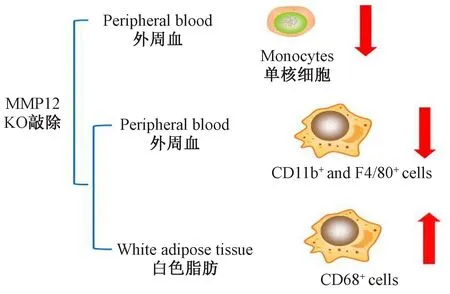
注:箭头代表此细胞上升或下降趋势。图5 MMP12-/-小鼠巨噬细胞检测总结Note. The arrow represents the rising or falling trend in the level of these cells.Figure 5 Summary of MMP12-/- mouse macrophage detection
3 讨论
MMP12主要由巨噬细胞、单核细胞等炎性细胞分泌的一种内切蛋白酶,几乎能分解全部细胞外基质成分和血管成分。本研究利用MMP12敲除小鼠,检测小鼠血液的血常规,流式检测其巨噬细胞的标记物。结果发现与正常小鼠相比,单核细胞和巨噬细胞数目及其百分数血液内含量降低,但是腹下白色脂肪内的巨噬细胞含量增多。提示MMP12敲除会引起血液内巨噬细胞数量变化和巨噬细胞在脂肪组织内的分布。
MMP12缺失小鼠血液内单核细胞的数量减少,巨噬细胞大部分属于单核细胞来源,所以我们进一步利用流式细胞仪检测巨噬细胞变化。在本次实验中,我们对24周MMP12-/-小鼠和MMP12+/+小鼠进行检测,没有考虑其他时间点小鼠单核和巨噬细胞的变化,假设MMP12影响了血液细胞的发育,那么其他时间点我们认为是一致的,但是在本研究我们没有检测。在流式实验设门时,以白细胞中的单核细胞进行设区域设门,选取巨噬细胞表面特异性标记物CD11b与F4/80双阳性的细胞认为是巨噬细胞。研究结果显示:与MMP12+/+小鼠对比,MMP12-/-小鼠白细胞中CD11b与F4/80双阳性细胞百分比有明显下降趋势,且有显著性差异,与上述结果MMP12敲除小鼠的血液单核细胞下降趋势是一致的。这提示MMP12可以通过影响单核细胞的分化来改变巨噬细胞。
近年来,越来越多的证据表明:MMP12与脂代谢有关[19]。Heinecke等人[15]已经发现MMP12缺失将促进脂肪组织的扩增和提高胰岛素的敏感性,且在高脂喂养的条件下,敲除MMP12将导致小鼠的体重和体脂的增加。但MMP12敲除小鼠白色脂肪中巨噬细胞变化尚不清楚,在本研究中,我们取MMP12-/-小鼠和MMP12+/+小鼠白色脂肪HE染色,免疫组化染CD68。镜检可得,24周的MMP12-/-小鼠单个白色脂肪细胞面积远大于MMP12+/+小鼠,且白色脂肪组织中CD68大量表达。不足之处在于,我们没有对高脂情况下脂肪组织中CD68表达进行检测,但是国外研究也已经证实高脂条件下饲养的MMP12敲除小鼠脂肪内巨噬细胞的确是增多。
MMP12缺失可以减少外周血中的巨噬细胞数,增加白色脂肪中的巨噬细胞数量。目前,我们没有检测血液和脂肪中巨噬细胞各个亚型是如何变化的,只证明MMP12通过影响单核细胞的分化而改变巨噬细胞。然而,这一过程是如何引起变化的,其分子机制仍有待深入研究。
总之,我们发现巨噬细胞的变化可能与MMP12敲除有关,其意义在于发现了MMP12敲除可下调外周血中巨噬细胞数量及上调白色脂肪中巨噬细胞数量。这对于深入研究MMP12调控巨噬细胞变化机制有一定的意义[20]。

