伦理委员会在儿童药物临床试验中的作用探讨Δ
刘 毅,朱彦丽,欧 凌,张建民#
(1.首都儿科研究所附属儿童医院GCP办公室,北京 100021; 2.首都儿科研究所附属儿童医院神经内科,北京 100021)
1 儿童药物临床试验的发展机遇
1.1 儿童药品短缺,超说明书用药现象未得到缓解
19世纪30年代,英国的哈利医生发现药物中儿童的用法与用量缺失严重,提出了“治疗孤儿”的概念,提醒人们要重视儿童用药的开发[1]。我国超过90%的药物没有“儿童版”。目前常用的3 500多个药品品种中,儿童剂型仅约60种(含中成药)[2]。药品生产企业对已上市药品缺少二次开发意愿。心血管疾病、神经系统疾病及肿瘤等成人常见疾病治疗药品,在儿童中超说明书用药(off-label drug use,OLDU)现象屡有发生,难以保证儿童用药的安全性与有效性。通过开展儿童药物临床试验,获得疗效与安全性证据,减少发生于儿童的药害事件,提高儿童用药的可及性,是治疗儿童疾病和改善儿童健康水平的有效途径,并已经得到了广泛共识[1-3]。
1.2 国家政策助力儿童药物临床试验发展
1.2.1 国际人用药品注册技术协调会(the international council for harmonization,ICH):我国儿童药物临床试验起步晚,且未建立完整的培训体系。2017年6月,原国家食品药品监督管理总局(China food and drug administration,CFDA)加入ICH,我国的药品监管部门、制药行业和研发机构将逐步转化和实施国际最高技术标准和指南[4]。这是规范儿童药物临床试验的良好契机。ICH的指导原则中,多达13项对儿童药物临床试验具有指导意义(见表1)。其中,ICH-E11[5]是儿童临床试验方案设计的重要参考文件。
1.2.2 国家政策助力儿童药物临床试验发展:2011年以来,国家先后发布鼓励研发、改革审批和技术指导等多项政策,从制度上、技术上和经济上为解决儿童用药短缺问题提供了有效路径和方法,儿童药物研发受到重视,临床试验数量增长显著。首都儿科研究所附属儿童医院(以下简称“我院”)每年新增药物临床试验数量从2012年的6例/年增至12例/年(见图1)。儿童药物临床试验发展方向明确,未来可期。

表1 儿童药物临床试验需要参考的ICH指导原则Tab 1 ICH guidelines for reference to clinical trials on children’s medicine

图1 2012—2017年我院各年新增儿童药物临床试验项目数Fig 1 Number of new clinical trials on children’s medicine in our hospital in each year during 2012-2017
2 严格的伦理审查是保障儿童权益的重要手段
儿童有复杂的生理系统,生长发育、心理特征及药物代谢特征与成人不同,不同年龄段的儿童,其躯体和心理特征也存在一定差异[6]。伦理委员会需对儿童(监护人)与成人的相异点保持关注。
2.1 基于儿童特点的试验方案审查策略
在对儿童临床试验方案的初始审查中,伦理委员会应更关注那些在成人试验中不常被考虑的风险,如恐惧、疼痛、与父母家庭分离及对生长发育的影响等[7];应对所批准的临床试验进行跟踪审查,直至试验结束。结合机构具体情况编制《临床试验项目风险识别、预估、评估表》[8],预估项目难度,合理拟定年度/定期跟踪审查频率。尤其是对于高风险项目,应通过增加年度跟踪审查频率来保证受试患儿的安全与权益。
2.2 对知情同意过程及知情同意书的审查策略
伦理委员会应审查知情同意过程是否对试验目的、试验风险、可替代疗法、随时退出试验且不受歧视等详细说明。知情同意书在描述试验内容与过程时应突出儿童(监护人)关注点,如:收集的血液标本为静脉血还是末梢血及总采血量;是否接受放射性检查及频次;访视周期与频次(是否导致学龄儿童旷课)。项目应备有适龄的儿童版知情同意书,适当运用分组讨论、实景模拟、小视频、小插画甚至卡通片的形式,以便于儿童理解。
2.3 对严重不良事件(serious adverse event,SAE)的审查
SAE指药物临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡及导致先天畸形等事件[9]。各临床试验机构依据法规制定了完善的SAE管理制度和标准操作流程(standard operating procedure,SOP)。2015年2月,CFDA在《药物临床试验质量管理规范》(征求意见稿)中引入“可疑且非预期严重不良反应(serious and unexpected suspected adverse reaction,SUSAR)”,并明确上报主体为申办方[10]。伦理委员会应重视SUSAR,尽快制定相应的审查原则。
3 研究儿童伦理疑难问题是促进儿童药物临床试验开展的有力措施
严格的伦理审查,可以避免患儿暴露在不必要的风险中,切实保护其利益。但这也可能打击了申办方和研究者的积极性,致使被若干政策激活的儿童药物临床试验失去活力。面对研究者缺少儿童临床试验经验的现状,伦理委员会需积极思考审查过程中的伦理挑战,推动问题解决,从而促进儿童药物的研究。
3.1 安慰剂在儿童药物临床试验中的应用
双盲、安慰剂、随机对照更利于评价新药的疗效,被视为“临床试验的金标准”[11]。成人药物临床试验中,安慰剂对照试验屡见不鲜。安慰剂对照试验具有方法学上的必要性,但道德合理性广受质疑[12]。在儿童药物临床试验中,尤其当存在有效治疗方法时,采用安慰剂对照需具备的条件与是否合乎道德仍然是伦理委员会需要深入研究的问题。Sammons等[13]对具有儿童研究经验人员的问卷调查中,假设将安慰剂分别用于镇痛和抗菌药物治疗的新药研究试验中,统计被调查者是否愿意入组儿童,且评估其所在伦理委员会的态度,结果显示,仅有1/3的人员选择同意在镇痛治疗研究中入组儿童并认为伦理委员会允许试验进行,抗菌药物治疗方面有接近1/2的人员选择同意;部分被调查者认为安慰剂不适合用于镇痛治疗(71%)或抗菌药物治疗(41%)中,并建议仅将试验药与阳性药对照。我院开展的3项小儿多动症/抽动症的试验采用了安慰剂对照,方案中均明确提出家长的对儿童心理、行为的干预对多动症/抽动症起到了一定的治疗效果,并且不影响入组的轻症患儿的日常学习、生活。但在实际操作中,入组速度明显慢于其他项目。儿童心理容易受家长(监护人)或研究者语言、行为的影响。如何在知情同意过程中向患儿解释安慰剂试验,使其充分了解利弊非常重要。国外对安慰剂有一定的研究[12-14],但我国医疗、文化环境与国外差异较大,国外经验平移至我国使用需慎重考虑。我国儿童领域安慰剂应用的条件有待明确。
3.2 是否该为儿童提供受试者补助
成人药物临床试验中给予适当的差旅补助、误工补助及通信补助等已经得到了公认,但是在儿童药物研究中给予补助带来的影响(见图2)和补助标准,值得商榷。

图2 是否给予受试者补助对儿童药物临床试验的影响Fig 2 Effects of whether to give the subject a subsidy on clinical trials on children’s medicine
在美国,接近25%的儿童临床研究对受试者提供了补偿[15]。美国儿科学会建议控制儿童试验补助金额,并且禁止在试验结束前披露经济补助方案,以保证补助的发放不会影响对儿童是否应该参与临床试验的判断[15]。欧盟禁止所有针对儿科研究的“激励措施或经济诱导”[16]。我国目前无相关法规支持,且无学会对儿童补助情况进行讨论。
基于此,建议将受试者补助分为一般性补助、补偿性补助与激励性补助,依据实际情况具体分析。(1)一般性补助:患儿因参与临床试验产生的费用,如住院费、护理费、检查费及药物耗材费用。适当地承担部分补助,不会对父母理性判断带来影响。(2)补偿性补助:因参与临床试验,监护人需陪同照顾而产生的差旅费、误工费;患儿付出的时间与精神成本。研究者可以通过给予父母一定的补助,要求其完成相应的任务,如陪同照料孩子,以提高依从性。(3)激励性补助:鼓励患儿(监护人)参与药物临床试验的费用。如有些疾病OLDU严重,且药品疗效、安全性在长期临床实践中已得到验证,需要通过规范临床试验获得证据,补充药品说明书,使患儿明确获益。可通过适当经济补助或奖品,激励患儿(监护人)参与研究,获得证据,增加适应证,缓解OLDU,承担社会责任。
3.3 如何获取急症患儿父母的知情同意
在英国的新生儿监护室,90%的新生儿都要接受没有儿童适应证的药品或器械的治疗[17]。这提示,开展儿童抢救用药临床试验的重要性与紧迫性。需要在较短的时间内对新生儿家长讲解试验目的、试验风险与受益等,并需要家长迅速做出自愿参与的决定,考验了研究者的知情谈判水平。目前,我国缺乏关于寻求父母知情同意的适当时间表和程序的准则。Jansen-van der Weide等[18]将知情谈判分为非紧急状况(充分知情的状态)、时间紧迫(<24 h)、迅速决定和患儿死亡后的知情同意等4种情况,并通过具体案例,陈述每种情况下家长的心理状态、知情同意书的设计和知情同意过程等;该研究总结,在紧急时刻,家长没有时间去思考临床试验的细节,研究者需提供易于阅读且含有核心信息的读本,便于父母理解。
4 组织儿童药物研究伦理知识的培训
4.1 组织全国性儿童药物临床试验伦理专题培训班
我国儿科医师总体数量不足,儿科资源配置存在严重的地区、城乡和省份不均[19]。国家食品药品监督管理总局食品药品审核查验中心药物临床试验机构资格认定数据库中数据显示,儿童药物临床试验机构与儿童医疗资源正相关,专业呈现出数量较成人少且分布不均的情况(见图3)。伦理委员会应促进成立儿童药物临床试验联盟,定期拟定题目,召开“儿童药物临床试验专项讨论会”,兼顾培养合格研究者和解决实际发生的问题,推动儿童药物研究的发展。
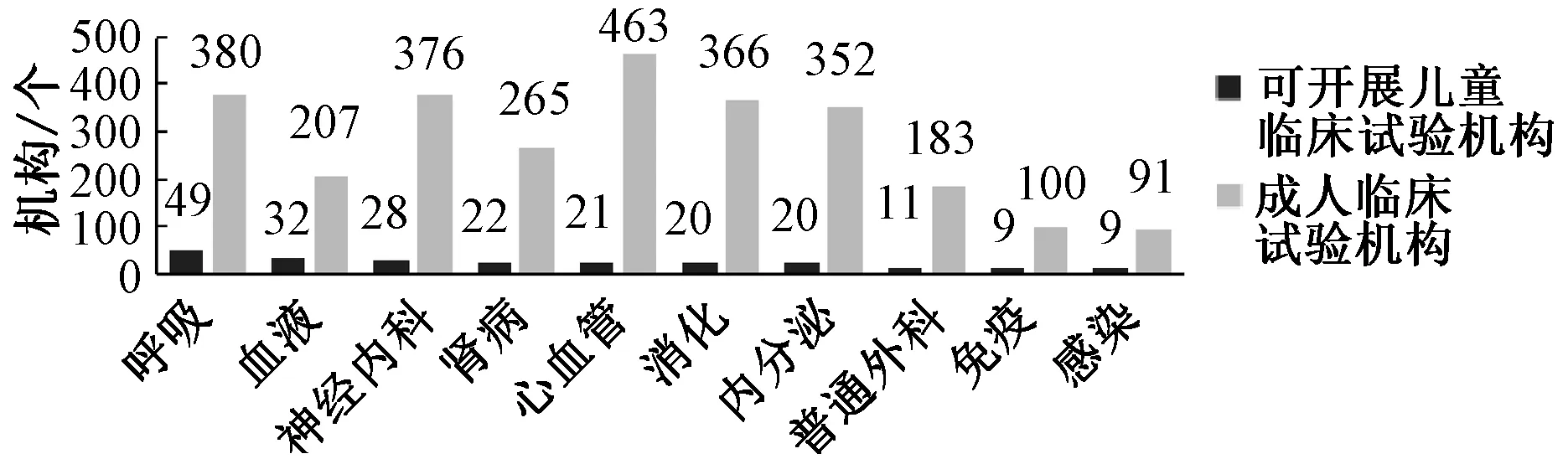
图3 儿童/成人同专业机构数量对比(2018年11月)Fig 3 Comparison of numbers of professional institutes between children and adults (Nov. 2018)
4.2 多种形式开展机构内研究者的伦理培训
儿科医师医疗任务繁重,具有丰富的临床知识,但缺少临床试验经验和积极性。可结合机构的具体情况,通过组织讨论、发放宣传册及启动会中再培训等多种形式,提高研究者对药物临床试验的认知。
总之,儿童药物临床试验伦理委员需要通过严格的伦理审查,保证受试患儿的安全与权益;积极解决伦理难题,提高研究者、申办方的积极性;开展多种形式的交流、培训,提高研究者的整体水平,为儿童药物研究工作保驾护航。

