人参皂苷Rg3对糖尿病大鼠难愈创面表皮细胞及血管新生的影响
李静平,顾 雯,倪艺榕,柯 瑾
(1. 云南中医药大学中药学院,云南 昆明 650500;2. 华南师范大学生物光子学研究院,广东 广州 510631)
糖尿病(diabetes mellitus,DM)创面难愈与糖代谢障碍关系密切,是临床常见、治疗棘手的并发症。其发病机制目前尚未完全清楚,DM是一个多因素、多环节参加的复杂病理过程,形成经久不愈的顽固性溃疡、易感染等一系列糖尿病皮肤病变。严重影响患者生活质量,耗费大量医疗资源和资金[1],临床亟待低毒、高效的治疗方法及药物。
前期临床及动物实验中,我们发现以传统抗肿瘤、抗疲劳、提高免疫等为主要活性的天然药物人参皂苷Rg3,能促进DM皮损患者及糖尿病大鼠难愈创面模型的皮损修复,且愈合良好。Rg3可有效改善创面炎症细胞浸润、促进肉芽组织形成、缩短愈合时间、提高创面愈合率[2]。其修复DM皮损作用是独立于传统药效之外的额外收益,值得深入探索。本研究拟在前期初步药效基础上,探索Rg3对DM难愈创面大鼠表皮细胞(厚度及增殖周期)和创面血管新生的影响,为其修复DM难愈创面的机制研究奠定基础。
1 材料
1.1实验动物♂ SD大鼠,体质量(180~200) g,动物生产许可证号:SCXK(川)2015-030,动物合格证号:51203500004561,购自由成都达硕实验动物有限公司。
1.2药物与试剂Rg3(纯度98.2%),由中国科学院昆明植物研究所植物化学研究室提供;氨基胍(aminoguanidirig,AG),购自昆明市泉港生物科技有限公司。链脲佐菌素(streptozocin, STZ)、Dispase Ⅱ分散酶(货号:4010ES60),美国Sigma公司;苏木精、伊红(货号:C0105-1),碧云天生物公司;CD31抗体(货号:555025),BD公司;二抗孵育试剂盒(货号:PV-9000)、DAB试剂盒(货号:ZLI-9018),中杉金桥科技;胎牛血清(fetal bovine serum,FBS),索莱宝公司,货号:C1010。
1.3仪器SQ2125切片机(Leica公司);Lab.A1光学正置显微镜(蔡司公司);GHP-9050N隔水式培养箱(Thermo公司);CytoFLEX流式细胞仪(Beckman Coulter公司)。
2 方法
2.1动物模型的建立及实验分组Ⅱ型DM模型建立[3-4]:大鼠高脂饲料喂养4周,一次性腹腔注射低剂量STZ 40 mg·kg-1(0.1 mol·L-1柠檬酸缓冲液配制,pH 4.4);正常组腹腔注射等体积的柠檬酸缓冲液。72 h后测空腹血糖及血清中胰岛素水平,并采用HOMA法计算胰岛素敏感指数,胰岛素敏感指数=22.5/(空腹血糖×胰岛素)。空腹血糖≥16.0 mmol·L-1及胰岛素敏感指数≤正常动物均值,为造模成功,有待进一步造难愈伤口模型。将上述DM大鼠按随机数字表法分为模型组、Rg3高、低剂量组、AG组,另设正常组。Rg3组分别灌胃Rg3 15、5 mg·kg-1;AG组灌胃10 mg·kg-1;模型组、正常组给予等剂量生理盐水,每日1次。
AG为一种小分子亲核性肼类化合物,是目前研究最多的一种糖基化终末产物(advanced glycation end products,AGEs)抑制剂。大量体外及动物实验表明,其与葡萄糖中间体,如二羰基化合物相互作用,抑制糖基化和AGEs的生成及长期高血糖状态下AGEs介导的组织损害[5]。因本项目拟研究Rg3改善皮肤局部AGEs蓄积,调节由AGEs直接介导的皮肤组织自身细胞或基质功能不良,促进DM皮损修复的作用机制,故将AG作为阳性对照药。
难愈伤口模型的建立:给药4周后,各组动物背部皮肤全层等面积切除,造创面模型。戊巴比妥钠按体质量45 mg·kg-1腹腔注射麻醉,背部剃毛,自制无菌的直径2 cm圆形硬纸片在脱毛处作标记,剪除全层皮肤。术后每只动物单笼喂养,期间各实验组继续给药直至取材。
2.2检测指标及方法
2.2.1动物处理及标本采集 伤后21 d,分别每组断颈处死大鼠,取新鲜创缘皮肤组织,①HE染色,观察皮肤组织形态学改变;②Image J图像分析软件测量真皮层和表皮层厚度;③消化后分离表皮与真皮,流式细胞仪检测表皮细胞增殖周期,用Lysis软件分析细胞周期;④以抗血小板-内皮细胞黏附分子(CD31)单克隆抗体,对皮肤样本进行免疫组化染色,Image-Pro Plus6.0图像分析软件计算阳性染色区域占视野面积的百分比,反映血管生成情况。
2.2.2创面皮肤组织HE染色观察 取创缘皮肤组织,4%多聚甲醛固定,石蜡包埋,HE染色,光镜下观察创面组织炎症反应、胶原改变、坏死组织存留,以及脱落、新生上皮匍行等形态学变化。
2.2.3皮肤组织表皮层和真皮层厚度测量 HE染色后,镜检拍照,经Image J图像分析软件数据分析,测量大鼠表皮层和真皮层厚度。
2.2.4表皮细胞增殖周期检测 新鲜样本离体后,剪去皮下组织,修剪成直径0.5 cm的皮块,经Dispase Ⅱ消化后,分离表皮及真皮,离心取上清液,0.1 mol·L-1PBS+10% FBS终止反应,流式细胞仪检测,Lysis软件分析表皮细胞周期。
2.2.5CD31表达率检测 免疫组化法检测DM全层皮肤损伤大鼠创面皮肤组织CD31蛋白的表达率,反映新生血管形成情况。4%多聚甲醛固定皮肤样本,石蜡包埋切片,抗原修复,灭活内源性过氧化物酶活性,滴加鼠抗人CD31一抗(1 ∶100),4 ℃孵育过夜,PBS冲洗3次,滴加二步法免疫组化检测试剂的二抗(1 ∶100),37 ℃孵育20 min,PBS冲洗3次,DAB显色5 min,苏木精复染,37 ℃孵育5 min,盐酸酒精分化1~3 s,封片,免疫荧光显微镜下观察染色结果并采集图片,用Image-Pro Plus6.0软件分析阳性染色区域的强度并量化:每张图片取3个高倍视野,统计后求平均值,平均阳性细胞率=阳性区域面积/总面积×100%。
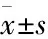
3 结果
3.1创面皮肤组织形态学改变如Fig 1所示,正常组伤后21 d的创面表皮完全再生,无残留创面,可见大量呈纺锤形成纤维细胞,胶原排列整齐,规则,真皮层可见大量毛细血管。与正常组比较,模型组皮肤菲薄,成纤维细胞少且无明显增殖,表皮细胞层次少,真皮层胶原明显水肿,皮下脂肪消失;创面炎性细胞较多,且浸润缓慢而持久,坏死组织脱落及创面肉芽组织形成缓慢,新生血管形成较少。与模型组比较,AG组创面上皮组织覆盖较多,成纤维细胞增加,细胞增殖明显,表皮及真皮均一定程度增厚,见清晰的表皮细胞结构,胶原较多且排列较整齐,炎症细胞减少,坏死组织脱落,出现创缘细胞匍行,新生血管数量较多,肉芽组织较厚。Rg3高、低剂量组大多创面上皮组织完全覆盖,表皮增厚,表皮细胞层次清晰,真皮层增厚,成纤维细胞较多,胶原较多且排列较整齐。Rg3低剂组有一定的细胞增加和表皮增厚作用,但较高剂组不明显。Rg3高、低剂量组创面炎症细胞明显减少,坏死组织形成脱落较早,创缘细胞匍行出现较早,真皮下毛细血管较多,肉芽组织形成较厚。
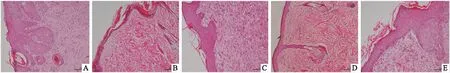
Fig 1 Wound skin tissue on 21st day after injury(HE×100)
A:Control; B:Model; C:AG; D:Rg3 low dose; E:Rg3 high dose.
3.2表皮层和真皮层厚度比较Tab 1结果显示,模型组表皮及真皮较正常组变薄(P<0.01),Rg3组表皮、真皮厚度较模型组明显增厚(P<0.01)。
Tab 1 Thickness of epidermis and
**P<0.01vscontrol;##P<0.01vsmodel
3.3表皮细胞增殖周期变化模型组较正常组G0/G1期比例明显升高(P<0.01),对应的G2/M、S期比例降低(P<0.01),提示模型组动物表皮细胞周期停滞于DNA准备期,细胞增殖减慢。AG组G0/G1期比例较模型组有所下降,S、G2/M期比例有升高趋势(P<0.05),表明AG可能通过抑制AGEs而促进表皮细胞增殖。Rg3高、低剂量组较模型组G0/G1期比例下降,且高剂量组下降明显(P<0.05),S、G2/M期比例升高(P<0.05,P<0.01),提示Rg3可有效改善DM创面皮肤表皮细胞增殖异常状况,高剂量组效果较明显(Fig 2、Tab 2)。
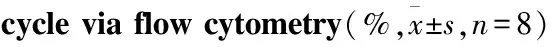
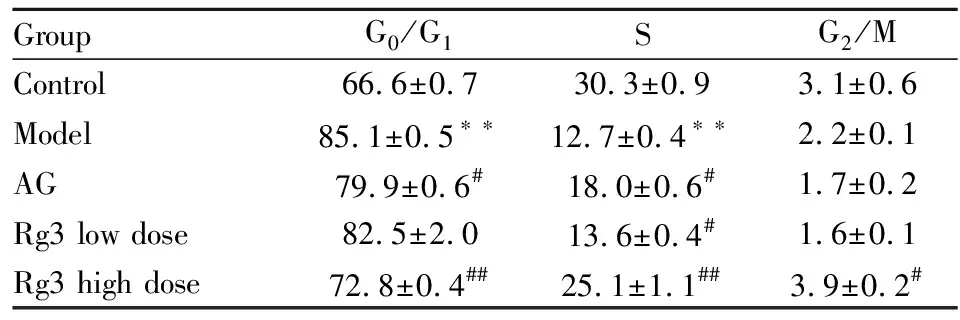
GroupG0/G1SG2/MControl66.6±0.730.3±0.93.1±0.6Model85.1±0.5∗∗12.7±0.4∗∗2.2±0.1AG79.9±0.6#18.0±0.6#1.7±0.2Rg3 low dose82.5±2.013.6±0.4#1.6±0.1Rg3 high dose72.8±0.4##25.1±1.1##3.9±0.2#
*P<0.05,**P<0.01vscontrol,#P<0.05,##P<0.01vsmodel
3.4创面组织CD31的表达如Fig 3所示,模型组创面CD31蛋白表达率明显低于正常组(P<0.01),AG组和Rg3高剂量组CD31蛋白表达高于模型组(P<0.05)。
4 讨论
DM患者最大的威胁来自并发症,也是DM治疗中尤为重要的部分。其中,DM自发性皮肤损伤(如DM溃疡、DM性水疱等)或外源性创伤所致皮肤创面难愈,成为患者最常见、严重的并发症之一。美国创面协会资料显示,约70% DM皮肤难愈创面患者即使经过6个月治疗和护理,仍无明显改善[6]。因此,寻求治疗的新策略和新药物既是全球性的挑战,也有利于节约相关医疗资源。
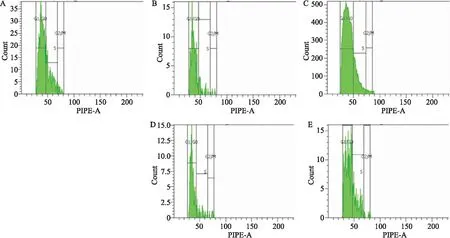
Fig2Epidermalcellproliferationcycleinrats
A:Control; B:Model; C:AG; D:Rg3 low dose; E:Rg3 high dose.
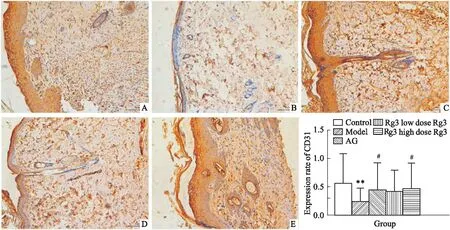
Fig 3 Expression of CD31 in rat skin tissues(×100)
A:Control; B:Model; C:AG; D:Rg3 low dose; E:Rg3 high dose.**P<0.01vscontrol,#P<0.05vsmodel.
Rg3是存在于天然药物人参或三七中的一种四环三萜皂苷,具有抗肿瘤、抗疲劳、舒张血管、提高免疫力等多种药理活性[7],但从未有过其在皮损修复方面的相关活性报道。前期临床及实验证实,Rg3对DM难愈创面有修复作用,能提高愈合率、缩短愈合时间[2]。本研究意在深入探讨其修复DM皮损的作用机制,以期发现其独立于传统抗癌活性以外的新药效。
与以往的报道一致[8],本实验HE染色发现,模型组较正常组皮肤菲薄,表皮细胞层次少,真皮层胶原水肿,伴不同程度的炎症细胞浸润,皮下脂肪消失。Rg3组创面炎症反应带消退,炎症细胞明显减少,血管增生、肉芽组织形成及胶原较多,创缘细胞匍行出现较早。用药后大鼠真皮及表皮层厚度均增厚,提示Rg3可部分逆转皮肤病理改变,一定程度上改善DM皮肤的易损状态。另外,皮肤细胞保持着一定的增殖率,以维持正常新陈代谢需要和表皮结构完整[9]。检测表皮细胞周期发现,模型大鼠表皮细胞停滞于G0/G1期(DNA准备期)比例升高,S期(DNA合成期)的比例及G2/M期(有丝分裂期)比例明显低于正常组。提示在DM状态下,皮肤表皮细胞的增殖生物学行为受扰,不能有效、有序地完成细胞增殖,从而成为皮肤菲薄的细胞生物学基础之一。Rg3组G0/G1期比例下降,S、G2/M期比例升高,提示其能抑制表皮细胞生长停滞期,激活增殖期,进而改善创面皮肤异常的表皮细胞增殖,有利于创面愈合。
患者糖代谢障碍所致糖蛋白沉积于血管内皮,引起血管基底膜增厚,可导致微循环障碍。血管病变加之神经病变、免疫功能低下等多因素,促使DM皮肤创面易反复感染[10]。同时,创面愈合过程涉及炎症反应、肉芽组织形成等方面,而肉芽组织形成是创面愈合的关键阶段,其可修复创面组织缺损,清除坏死组织[11]。新生血管有助于氧气和养料供应,促进肉芽组织形成。新生血管越多,肉芽组织生长越快,则创面愈合时间缩越短[12]。CD31蛋白主要表达于血管内皮细胞中,是新生血管形成的重要标志。由CD31标记的新生微血管密度是目前公认的评价血管形成的标准。创面修复过程中,CD31能客观、直接地反映创面血管生成及愈合程度。结果表明,Rg3高剂组创面CD31阳性表达率高于模型组,提示其修复糖尿病性皮损可能与促进创面血管生成有关。但有文献报道,Rg3在抗肿瘤研究中,有抑制肿瘤异常血管生成的作用,以实现抗肿瘤和抑制肿瘤转移目的[13]。此报道有异于本研究结果,我们研究表明Rg3可促进糖尿病皮肤损伤创面血管生成而修复皮损。这可能是其独立于其传统抗肿瘤药效之外的额外收益,即“老药新用”。不同研究提示,Rg3对血管生成方面的作用值得深入探索,可能因疾病、机体组织及状况而异,呈现抑制或促进的不同活性。
本研究证实Rg3能抑制创面皮肤病理变化,增加皮肤表皮及真皮厚度,改善表皮细胞增殖周期异常状况,促进创面血管新生,为该药物在修复DM难愈创面方面的机制研究奠定了基础。
(致谢:感谢昆明市代谢性疾病中医药防治研究中心、云南中医学院刘昌孝院士工作站及动物实验中心为本研究提供科研场所和仪器。谨向全体课题组成员及同学表示衷心感谢!同时也感谢中国科学院昆明植物研究所植化研究室提供实验用药及帮助。)

