三种试剂用于两种肿瘤细胞活性检测的比较研究
高建 林圣 张倩 林洁 张玲华 谷学英 邵豪 姚克勤 段山
在体外培养细胞的过程中,经常需要判断细胞在某些条件下是否能正常生长以及存活率的问题,这就涉及到对细胞活性的检测,也是细胞增殖、细胞毒性试验、抗肿瘤药物筛选以及其它相关研究的基础[1,2]。目前,有关细胞活性的检测方法很多,基于吸光度或发光检测的商品化试剂盒亦有很多,市场上常见的有CCK-8、alamarBlue 和CellTiter-Glo等[3~5],三种常用试剂该如何选择、各自有何特点是相关学者较为关心的问题,另外,对以上几种试剂用于两种不同类型细胞的检测参数和综合性能评估的报道亦较少。本研究选取代表贴壁细胞类型的人子宫颈癌细胞株Hela 和代表悬浮细胞类型的人弥漫性大B 细胞淋巴瘤细胞株SU-DHL-2 为研究对象,对以上三种试剂分别从接种细胞数目、孵育时间和检测线性范围等方面进行研究,期望为学者提供有价值的实践参考。
1 材料与方法
1.1 一般资料人子宫颈癌细胞株Hela 和人弥漫性大B 细胞淋巴瘤细胞株SU-DHL-2 购自于美国ATCC 细胞资源中心;Cell Counting Kit-8(简称CCK-8)购自于日本DOJINDO 公司;CellTiter-Glo®Luminescent Cell Viability Assay(简称CellTiter-Glo)、GLOMAX Multi Detection System 多功能酶标仪购自于美国Promega 公司;alamarBlue™Cell Viability Reagent(简称alamarBlue)、Gibco®热灭活胎牛血清FBS、Gibco®DMEM 培养基、Gibco®RPMI-1640 培养基、Gibco®Trypsin-EDTA(0.25%)和CO2培养箱购自于美国Thermo 公司;10cm2细胞培养皿、96孔透明和不透明细胞培养板购自于美国Corning 公司;血球计数板购自于上海市求精生化试剂仪器有限公司;荧光倒置显微镜购自于美国Leica 公司。
1.2 研究方法
1.2.1 CCK-8 检测方法 细胞铺板:对于Hela,将处于对数生长期的细胞用胰酶消化计数后,用含10%FBS 的DMEM 培养基将细胞调整到一定密度,接种到96 孔透明细胞培养板中,使每100μl 细胞悬液中的细胞数目分别为0、2 000、4 000、6 000、8 000、10 000、12 000 和14 000个/孔;对于SU-DHL-2,将处于对数生长期的细胞吹散混匀计数后,用含10%FBS 的RPMI-1640 培养基将细胞调整到一定密度,接种到96 孔透明细胞培养板中,使每100μl细胞悬液中的细胞数目分别为0、4 000、8 000、12 000、16 000、20 000、24 000 和28 000 个/孔;每种细胞数目设4 个复孔,在37℃、5%CO2培养箱中预培养4h。线性范围确定:向预培养后的细胞中,每孔加入10μl CCK-8,在37℃、5%CO2培养箱中孵育1~4h,每隔1h 用多功能酶标仪检测450nm 波长处的吸光度;根据平均吸光度值,绘制吸光度随细胞和时间的变化曲线,去掉处于平台期的平均吸光度值后,进行Pearson 线性相关分析,确定可检测细胞数线性范围。
1.2.2 alamarBlue 检测方法 细胞铺板:方法同1.2.1。线性范围确定:向预培养后的细胞中,每孔加入10μl alamarBlue,在37 ℃、5%CO2培养箱中孵育1~8h,每隔1h 用多功能酶标仪检测560nm 波长处的吸光度;根据平均吸光度值,绘制吸光度随细胞和时间的变化曲线,去掉处于平台期的平均吸光度值后,进行Pearson 线性相关分析,确定可检测细胞数线性范围。
1.2.3 CellTiter-Glo 检测方法 细胞铺板:将处于对数生长期的Hela 和SU-DHL-2 计数后,分别用含10%FBS 的DMEM培养基和含10%FBS 的RPMI- 1640 培养基将细胞调整到一定密度,接种到96 孔不透明细胞培养板中,使每100μl 细胞悬液中的细胞数目分别为0、6 250、12 500、25 000 和50 000个/孔,每种细胞数目设4 个复孔,在37℃、5%CO2培养箱中预培养4h。线性范围确定:将CellTiter-Glo 的缓冲液室温溶解后倒入装有底物冻干粉的棕色瓶中混匀,将预培养后的细胞培养板拿出,在室温下平衡30min,然后向每孔中加入100μl 检测试剂,在多功能酶标仪上设置参数:震荡混匀2min,孵育10min,检测发光信号值(RLT);根据平均发光信号值,如有处于平台期的发光信号值则舍弃,然后进行Pearson 线性相关分析,确定可检测细胞数线性范围。
1.3 统计学方法 所有结果均采用SPSS Statistics 22软件进行分析,当4 个复孔的结果存在离群值时剔除该值后再进行平均值计算,以平均吸光度值或平均发光信号值作为纵坐标,每孔接种细胞数目作为横坐标,进行Pearson 线性相关分析。
2 结果
2.1 CCK-8 的检测结果 对于Hela 和SU-DHL-2两种细胞,吸光度值都会随着接种细胞数的增多和孵育时间的延长而均匀增加,随后进入平台期,增幅变得越来越小(见图1A 和图1C)。对于Hela细胞,接种数在0~8 000 之间、孵育时间为1h 时线性相关性最好,Pearson 相关系数r为0.997(见图1B);对于SU-DHL-2 细胞,接种数在0~28 000之间、孵育时间在1h 或2h 时线性关系比较好,Pearson 相关系数r均为0.995(见图1D)。
2.2 alamarBlue 的检测结果 对于Hela 细胞,当孵育时间≤5h、接种细胞数≤2 000 时,试剂尚未发生还原反应,导致背景吸光度值比接种细胞孔的值高或接近(见图2A),当继续孵育至6h、7h 时才能取得非常好的线性,Pearson 相关系数r均为0.996(见图2B);对于SU-DHL-2 细胞,吸光度值随着接种细胞数的增多和孵育时间的延长增加得非常明显,但很快进入平台期(见图2C);孵育时间在2h 时的线性关系最好,Pearson 相关系数r为0.998(见图2D)。

图1 CCK-8 用于Hela 和SU-DHL-2 细胞活性的检测及线性范围

图2 alamarBlue 用于Hela 和SU-DHL-2 细胞活性的检测及线性范围
2.3 CellTiter-Glo 的检测结果 对于Hela 和SUDHL-2 两种不同类型的细胞,当接种细胞数在0~50 000 之间时,平均发光信号值和细胞数之间均表现出非常好的线性,Pearson 相关系数均达到了0.999,可检测细胞线性范围较宽(见图3)。
2.4 三种试剂的最佳检测条件 三种试剂都可用于两种不同类型细胞Hela 和SU-DHL-2 的检测,在可检测细胞数线性范围和最佳孵育时间方面均有所不同,可根据自身的研究需要从中选择合适的试剂和检测参数,见表1。

图3 CellTiter-Glo 用于Hela 和SU-DHL-2 细胞活性的检测及线性范围
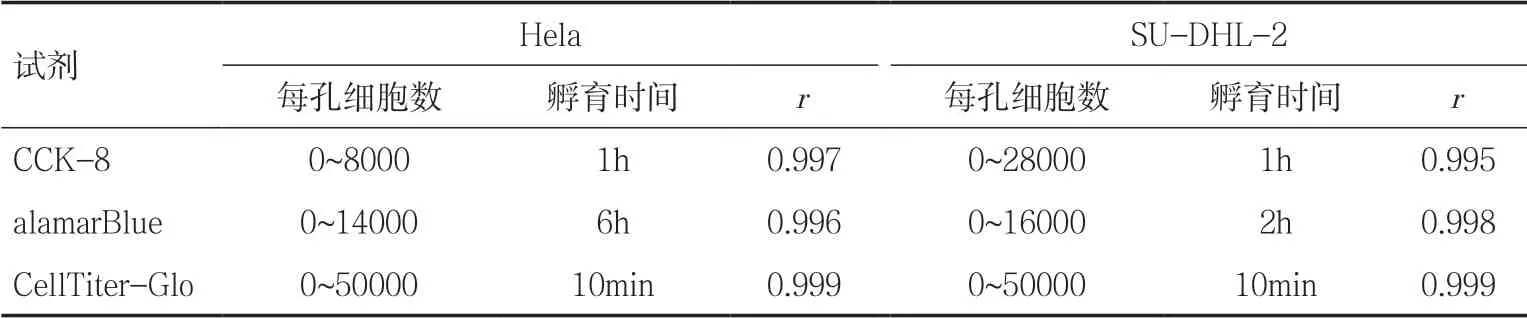
表1 三种试剂检测两种细胞的最佳条件
3 讨论
在体外细胞实验中,常涉及到对细胞增殖和细胞活性的检测,尤其是在细胞增殖、细胞毒性以及细胞对药物敏感度的量化研究方面。在实际操作过程中,可以通过多种方法检测所培养细胞的健康状况,如质膜完整性、DNA 合成、酶活性、ATP 以及代谢活性等,可作为细胞存活和死亡的指标[6~8]。本次研究所选用的三种试剂的检测原理均是基于以上公认的指标之一。CCK-8 和alamarBlue 的原理相似,都是在活细胞线粒体酶的作用下,将底物还原为有颜色的水溶性产物,通过检测有色产物的吸光度来间接反映活细胞的数量[9,10];CellTiter-Glo 是一种通过对ATP 进行定量测定来反映活细胞数目的方法,它采用荧光素酶作检测物,发光信号的强弱与体系中ATP 的量成正比,而ATP 的量又与活细胞的数目呈正相关,因为体系中的ATP 只能来源于活细胞的新陈代谢[11,12]。
实验操作方面,对于CCK-8 和alamarBlue 两种试剂,在检测时都是直接加入到培养基中混匀即可,孵育结束后直接用酶标仪检测吸光度,无需裂解细胞,细胞在检测完毕后还可以继续培养或用于其它实验;由于CCK-8 的颜色与含酚红的培养基比较接近,应尽量避免漏加或多加的情况;而alamarBlue 加入培养基后溶液立刻变成蓝色,很容易区分,但是当细胞浓度过高或孵育时间过长时,会导致继发性还原反应,进而使有色产物颜色消失,整个操作过程还应严格避光,并且保证无菌操作,因为微生物污染物同样可以还原检测试剂而影响实验结果[13];对于CellTiter-Glo 试剂,将底物冻干粉和缓冲液混匀平衡至室温后,与培养基等体积加入,混匀孵育10min 后即可检测,也不受培养基中酚红和有机溶剂的影响,但是细胞不可用于后续实验,因为在孵育过程中被充分裂解,检测时必须用不透明的培养板和配套发光检测设备。
在检测结果方面,以上三种试剂都可同时用于贴壁细胞和悬浮细胞的增殖和活性测定,在一定范围的细胞数目和孵育时间内,均能表现出很好的线性关系,Pearson 相关系数均在0.99 以上。对于CCK-8 试剂,在最佳孵育时间均为1h 的情况下,悬浮细胞SU-DHL-2 的检测线性范围远大于贴壁细胞Hela;对于alamarBlue 试剂,两种细胞的检测线性范围相当,但是孵育时间却存在较大差别,对于贴壁细胞,需要较长的孵育时间;对于CellTiter-Glo 试剂,两种细胞的结果表现一致,检测的线性范围较宽,孵育时间只需要10min,相关性也是最好,由于加样体积的增大和光信号自身的特性,大大降低了系统误差,使得结果的准确性和重复性都较高[14]。
综上所述,三种试剂在一定的条件下,均能取得令人满意的结果。对于CCK-8 和alamarBlue 两种试剂,实验操作最为简单,属于即开即用型,成本也相对较低,检测后的细胞经洗涤可重复使用,可进行后续的细胞活力检测、细胞周期分析或与增殖有关的细胞表面抗体测定等,缺点是需要耗费较长时间来摸索最佳检测条件,CCK-8 对贴壁细胞的检测线性范围较窄,alamarBlue 对贴壁细胞的孵育时间较长,二者对悬浮细胞的检测效果较好;对于CellTiter-Glo 试剂,操作时需要先行解冻并平衡至室温后使用,需要配套仪器来混匀和检测发光信号,整体成本较高,因细胞在检测过程中被裂解而不可用于后续实验,但是该试剂孵育时间仅需要10min,对两种类型细胞的线性检测范围较宽,对细胞数目要求不严格,自动化程度较高,尤其适合大规模的抗肿瘤药物筛选以及细胞毒性试验等,检测效率、灵敏度和准确性均较好。

