碳量子点荧光猝灭法检测Hg2+及其猝灭机理研究
丁 玲,肖 文,钱诗卉,周 进,周尽晖,李世迁,唐欣伟
(1.武汉科技大学省部共建耐火材料与冶金国家重点实验室,湖北 武汉, 430081;2.武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北 武汉,430081;3.福建师范大学福清分校近海流域环境测控治理福建省高校重点实验室,福建 福清,350300)
伴随现代工业的迅速发展,部分重金属离子通过多种途径被排入江河湖海,对人体健康和环境造成了极大的危害[1-4],其中Hg2+被世界野生动物基金会(WWF)确认为近70种环境因素中最危险且普遍存在的无机污染物之一,它通过水循环和食物链的富集效果[5-6]最终在人体内积累,对人类的健康和生命造成严重威胁,如大脑及中枢神经的损伤、肾脏衰竭、DNA 破坏等,对汞污染的研究逐渐成为各国环境工作者研究的热点。目前对Hg2+的测定分析技术也较为成熟,如原子吸收光谱法[7]、电化学分析法[8]、生物传感器法[9]、分光光度法[10]、电感耦合等离子体质谱法[11]等,但由于设备昂贵、样品预处理复杂,这些方法均不太方便,因此迫切需要发展先进的Hg2+检测分析技术。与上述多种方法相比,荧光光谱法检测Hg2+具有灵敏度高、选择性好、用量少、光学性质稳定和易于实现表面功能化等优点[12-14]。近年来,碳量子点的荧光分析已经成功应用于重金属离子检测之中,并获得了良好的检测分析效果。郭颖等[15]以氨基葡萄糖盐酸盐为碳源,通过水热法合成了水溶性好的荧光碳量子点,发现Hg2+对碳量子点荧光有良好的猝灭作用,Hg2+浓度在1.6×10-6~5.1×10-5mol/L范围内与碳量子点荧光猝灭强度呈良好线性关系,检出限为6.7×10-7mol/L;胥月等[16]以苹果汁为原料,通过一步水热法合成得到水溶性好及稳定性高的蓝色荧光碳量子点,发现Hg2+对碳量子点荧光有良好的猝灭作用,在pH=7.0磷酸盐缓冲介质中碳量子点荧光猝灭强度与Hg2+浓度在5.0×10-9~1.0×10-7mol/L和1.0×10-6~5.0×10-5mol/L范围内呈线性关系,检出限为2.3×10-9mol/L。
本文以焦粉为原料,采用一步水热法合成水溶性好的荧光碳量子点,将合成的碳量子点用于检测环境水中的Hg2+,并对Hg2+与碳量子点的结合方式、反应机理等进行研究,探讨Hg2+对碳量子点的荧光猝灭机理,以期为新型碳量子点检测废水中重金属Hg2+提供参考。
1 试验
1.1 原料和试剂
焦粉(取自武钢焦化企业炼焦车间回收料);硝酸、硫酸、氢氧化钠(NaOH)、氯化汞(HgCl2)、氯化锌(ZnCl2)、氯化亚铁(FeCl2)、氯化锰(MnCl2)、氯化铜(CuCl2)、氯化钴(CoCl2)、氯化铁(FeCl3)、氯化铅(PbCl2)、氯化镍(NiCl2)、氯化钾(KCl)、氯化钠(NaCl),以上试剂均为分析纯;实验室用水均为去离子水。
1.2 碳量子点的制备及表征
取经60目标准校验筛筛取的焦粉0.10 g与12 mL混合酸(VH2SO4∶VHNO3=3∶1)在三口烧瓶中用油浴加热至95 ℃,磁力搅拌,回流9 h后冷却,取出原液,采用离心方法去除反应原料,离心速度为6000 r/min,离心时间为30 min;离心后取上层清液,并用5 mol/L的NaOH溶液中和至pH =9[17],然后将滤纸折叠为双层进行过滤,得到纯化的碳量子点溶液。将所得碳量子点溶液稀释数倍后用LS55荧光分光光度计(美国Perkinelmer公司)对其进行荧光光谱表征。
1.3 碳量子点对Hg2+的选择性和抗干扰性试验
取所制碳量子点溶液3 mL于4 mL比色皿中,用荧光分光光度计测定在激发波长为330 nm下碳量子点的荧光强度(F0);分别配置浓度为1.0×10-4mol/L的Hg2+、Fe3+、Fe2+、Cu2+、Pb2+、Mn2+、Ni2+、Zn2+、Co2+、K+、Na+盐溶液,并用移液枪移取30 μL上述盐溶液分别加入到3 mL相同浓度的碳量子点溶液中,在激发波长为330 nm下测定加入金属离子后碳量子点的荧光强度(F),并计算其相对荧光强度(ΔF=F/F0)。
在测定加入金属离子后碳量子点的荧光强度后,再取30 μL浓度为1.0×10-5mol/L的Hg2+溶液加入到上述金属离子存在的碳量子点溶液中,测定其加入Hg2+溶液后碳量子点的荧光强度,并计算在不同金属离子存在条件下加入Hg2+溶液前、后碳量子点的相对荧光强度,分析金属离子对碳量子点检测Hg2+的干扰性。
1.4 Hg2+对碳量子点荧光猝灭试验
在4 mL的比色皿中分别加入3 mL碳量子点溶液,用移液枪移取0、30、60、90、120、150 μL浓度为1.0×10-5mol/L的Hg2+溶液分别滴加到比色皿中,在300、313、323 K温度下,用LS55荧光分光光度计测定其荧光强度,激发波长为330 nm,激发狭缝宽度为5.0 nm,发射狭缝宽度为6.0 nm,扫描波长范围为200~800 nm,采用Stern-Volmer方程[18]分析碳量子点荧光猝灭程度(F0/F)与Hg2+浓度之间的关系,即
F0/F=1+Ksv[Q]
(1)
式中:F0、F分别为加入猝灭剂Hg2+前后碳量子点的荧光强度,a.u.;[Q]为加入猝灭剂Hg2+的总浓度,mol/L;Ksv为Stern-Volmer猝灭常数,L/mol。
2 结果与分析
2.1 碳量子点对Hg2+的选择性
不同金属盐溶液对碳量子点相对荧光强度的影响如图1所示。从图1中可以看出,与Fe3+、 Mn2+、Cu2+、Ni2+、Fe2+、Co2+、Pb2+、Zn2+、K+、Na+相比,Hg2+对碳量子点的荧光猝灭影响最大,由此表明,该碳量子点作为Hg2+检测传感器具有较好的单一选择性。

图1 不同金属离子对碳量子点的相对荧光强度的影响
Fig.1Effectsofdifferentmetalionsontherelativefluorescenceintensityofcarbonquantumdots
2.2 碳量子点检测Hg2+的抗干扰性
图2为不同金属盐溶液存在的条件下添加Hg2+前(黑色)后(灰色)碳量子点的相对荧光强度。从图2中可以看出,加入Hg2+后碳量子点相对荧光强度均减小,不同金属离子的存在并不影响Hg2+对碳量子点荧光的猝灭,由此表明,碳量子点对Hg2+的测定具有较好的抗干扰性。
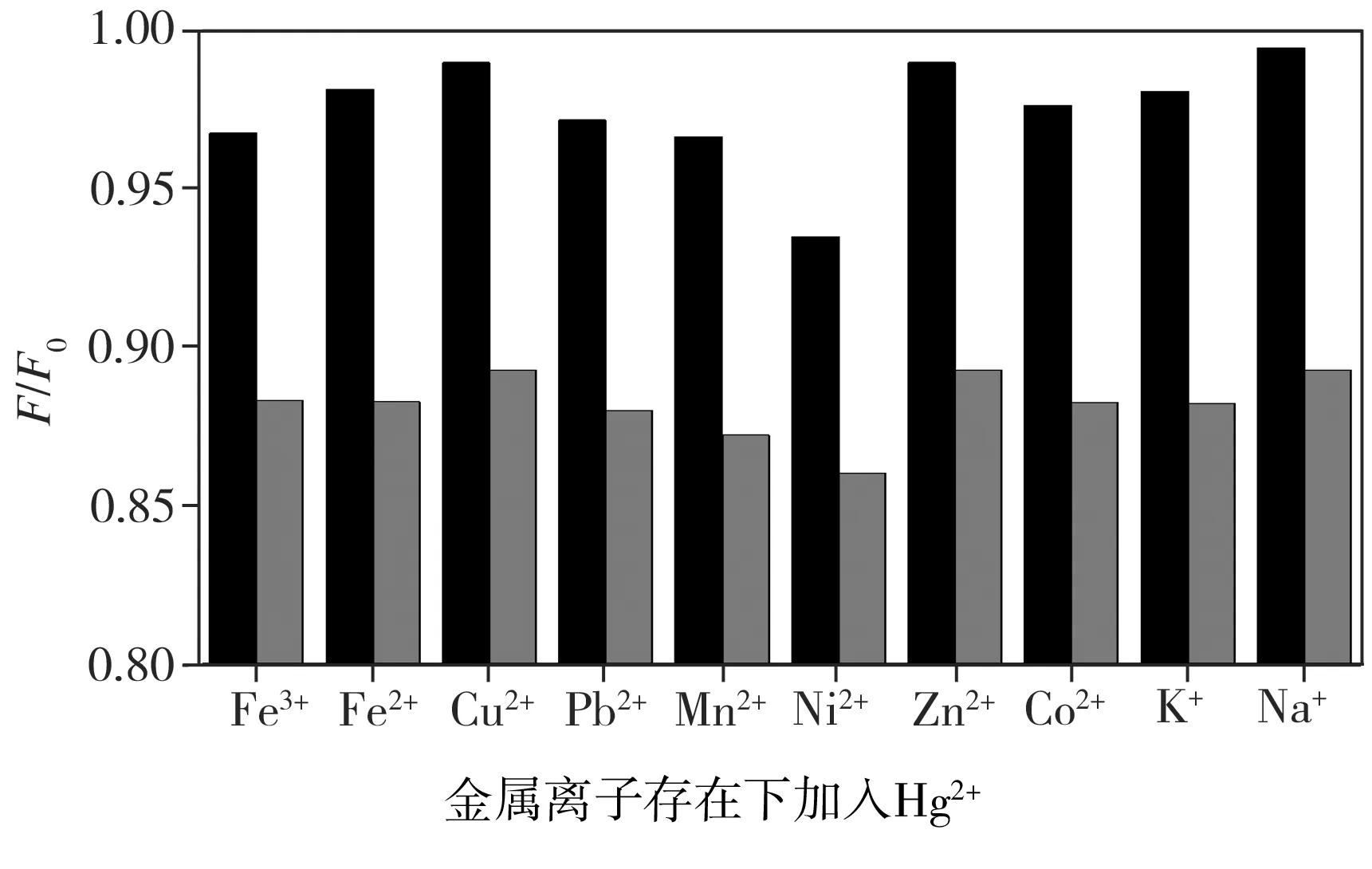
图2不同金属离子存在条件下添加Hg2+前(黑色)后(灰色)碳量子点的相对荧光强度
Fig.2Relativefluorescenceintensityofcarbonquantumdotsbefore(black)andafter(grey)additionofHg2+inthepresenceofdifferentmetalions
2.3 不同浓度Hg2+对碳量子点荧光光谱的影响
浓度级为10-7mol/L的不同浓度Hg2+对碳量子点荧光光谱的影响如图3所示,并根据Stern-Volmer方程绘制其荧光猝灭曲线,如图4所示。从图3中可以看出,在一定浓度范围内,Hg2+对碳量子点的荧光能产生明显的猝灭效应,且随着Hg2+浓度逐渐增大,碳量子点的荧光强度不断减小。从图4中可以看出,Hg2+浓度在1.0×10-7~5.0×10-7mol/L范围内,碳量子点的荧光猝灭程度与Hg2+浓度存在良好的线性关系,其线性相关系数R2为0.9977。
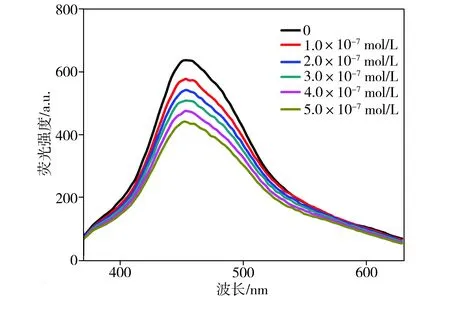
图3浓度级为10-7mol/L的不同浓度Hg2+对碳量子点荧光光谱的影响
Fig.3EffectsofHg2+withconcentrationlevelof10-7mol/Lonfluorescencespectraofcarbonquantumdots
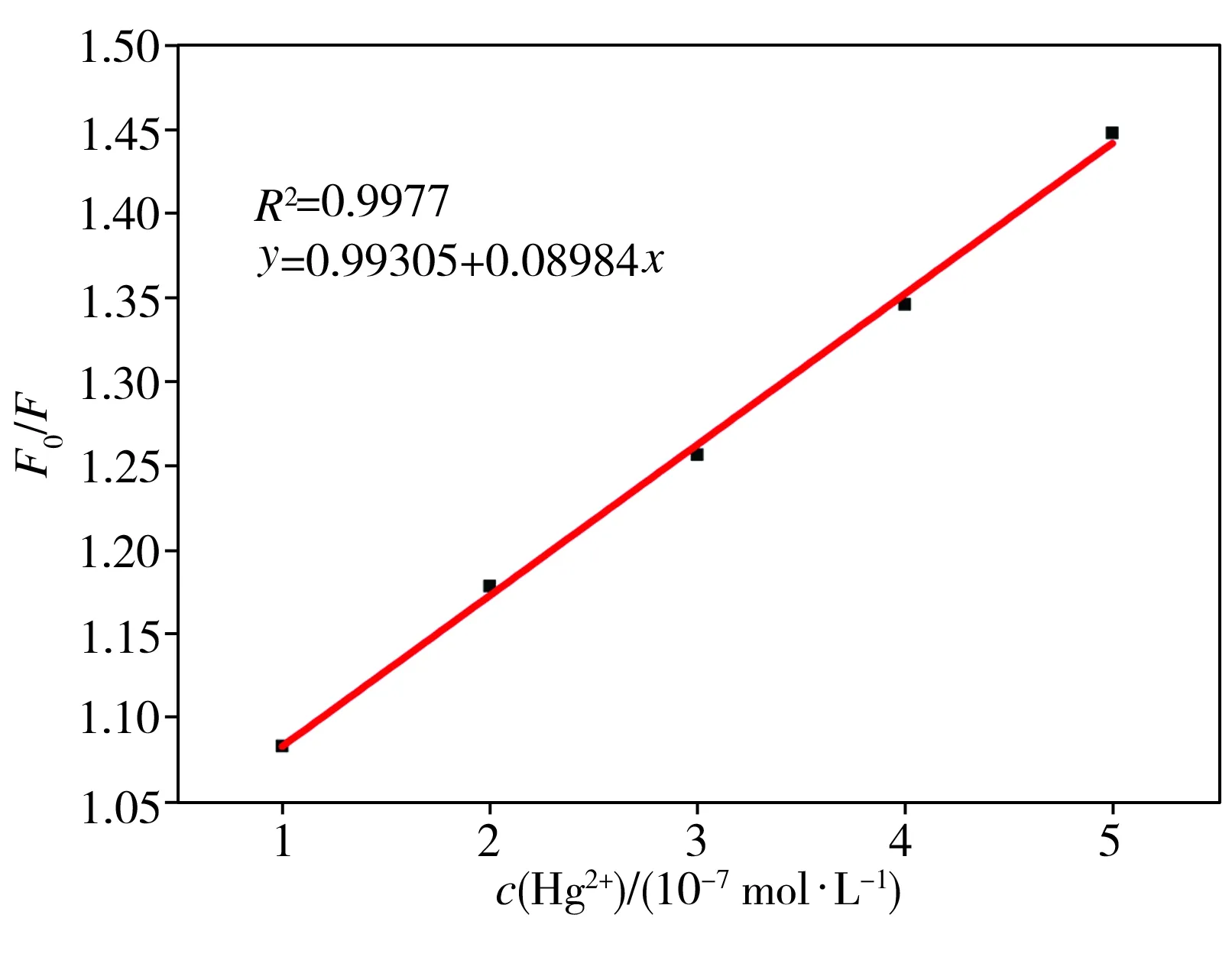
图4碳量子点荧光猝灭程度(F0/F)与浓度级为10-7mol/L的不同浓度Hg2+之间的关系
Fig.4Relationshipbetweenfluorescencequenchingdegree(F0/F)andHg2+withconcentrationlevelof10-7mol/L
浓度级为10-8mol/L的不同浓度Hg2+对碳量子点荧光光谱的影响如图5所示,并根据Stern-Volmer方程绘制其荧光猝灭曲线,如图6所示。从图5中可以看出,10-8mol/L浓度级的Hg2+仍能对碳量子点的荧光产生猝灭效应,但随着Hg2+浓度逐渐增大,碳量子点的荧光强度改变不明显。从图6中可以看出,Hg2+浓度在1.0×10-8~5.0×10-8mol/L范围内,碳量子点的荧光猝灭程度与Hg2+浓度存在一定的线性关系,其线性相关系数R2为0.9839。
比较以上两组不同浓度级的Hg2+对碳量子点的荧光猝灭效应可知,碳量子点对Hg2+的检测范围为1.0×10-8~1.0×10-7mol/L,检出限为1.0×10-8mol/L,与双硫腙分光光度法[19](国标测定方法)相比,检测范围更宽,更方便快捷,且低于同种用碳量子点荧光光谱法检测Hg2+的检出限值8.35×10-8mol/L[20]。

图5浓度级为10-8mol/L的不同浓度Hg2+对碳量子点荧光光谱的影响
Fig.5EffectsofHg2+withconcentrationlevelof10-8mol/Lonfluorescencespectraofcarbonquantumdots
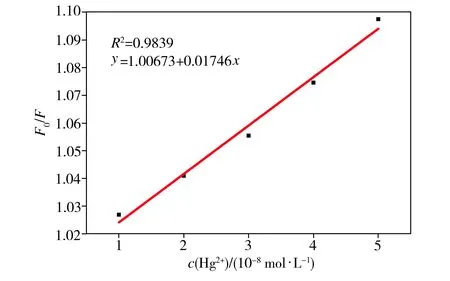
图6碳量子点荧光猝灭程度(F0/F)与浓度级为10-8mol/L的不同浓度Hg2+之间的关系
Fig.6Relationshipbetweenfluorescencequenchingdegree(F0/F)andHg2+withconcentrationlevelof10-8mol/L
2.4 Hg2+对碳量子点荧光猝灭机理
引起荧光猝灭原因主要有:①激发态反应;②能量转移;③碰撞猝灭(动态猝灭);④形成配合物(静态猝灭)。Hg2+与碳量子点相互作用的荧光猝灭机制,可用Stern-Volmer方程中的猝灭常数(Ksv)随温度的变化进行分析判断,对于动态猝灭,猝灭过程依赖于分子的碰撞扩散,由于温度的升高会导致碰撞扩散系数的增大,荧光物质的猝灭常数(Ksv)会随温度的升高而增大,有利于猝灭过程的进行;对于静态猝灭,温度升高会使猝灭剂Hg2+与碳量子点形成的配合物稳定性降低,不利于猝灭过程的进行,荧光物质的猝灭常数会随温度升高而减小。
不同温度下Hg2+溶液对碳量子点的Stern-Volmer猝灭曲线如图7所示。从图7中可以看出,碳量子点的荧光猝灭程度与Hg2+浓度存在良好的线性关系,这是静态猝灭的迹象之一;在300、313、323 K温度下,Stern-Volmer猝灭常数Ksv分别为8.984×105、4.693×105、3.066×105L/mol,即随着温度的升高,Stern-Volmer猝灭常数不断地减小,这表明Hg2+对碳量子点的荧光猝灭并不是因为分子的动态碰撞和扩散而引起的动态猝灭,而是彼此形成的某种特定结构的基态配合物引起的静态猝灭。
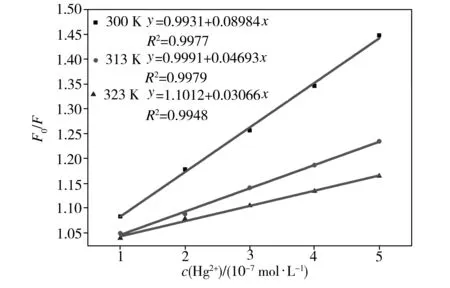
图7不同温度下Hg2+溶液对碳量子点的Stern-Volmer猝灭曲线
Fig.7Stern-VolmerquenchingcurvesofHg2+solutiontocarbonquantumdotsatdifferenttemperatures
静态的猝灭数据可以用修正的Stern-Volmer 方程[18]进行处理,即
(2)
式中:fa为可被荧光猝灭剂接近的发色基团占总的发色基团的百分比;Ka为Hg2+对碳量子点的有效猝灭常数,可近似地认为是猝灭剂和受体体系中的表观结合常数,L/mol。
以F0/(F0-F)对1/[Q]作图来处理实验数据,不同温度下Hg2+溶液对碳量子点的修正的Stern-Volmer猝灭曲线如图8所示。从图8中可以看出,Hg2+对碳量子点的荧光猝灭程度与Hg2+浓度存在良好的线性关系,并由其线性方程推算可得,在300、313、323 K温度下,有效猝灭常数Ka分别为9.95×105、7.72×105、6.27×105L/mol,即随着温度的升高,Hg2+对碳量子点的有效猝灭常数不断地减小,再次表明Hg2+对碳量子点的荧光猝灭并不是因为分子的动态碰撞和扩散而引起的动态猝灭,而是彼此形成的某种特定结构的基态配合物引起的静态猝灭。
由于Hg2+对碳量子点的荧光猝灭是静态猝灭,因此,碳量子点中可能与Hg2+存在某一结合位点。结合位点可以从碳量子点和Hg2+之间的相互作用中推断出。碳量子点的荧光猝火程度和Hg2+浓度的关系可以用公式表示为:
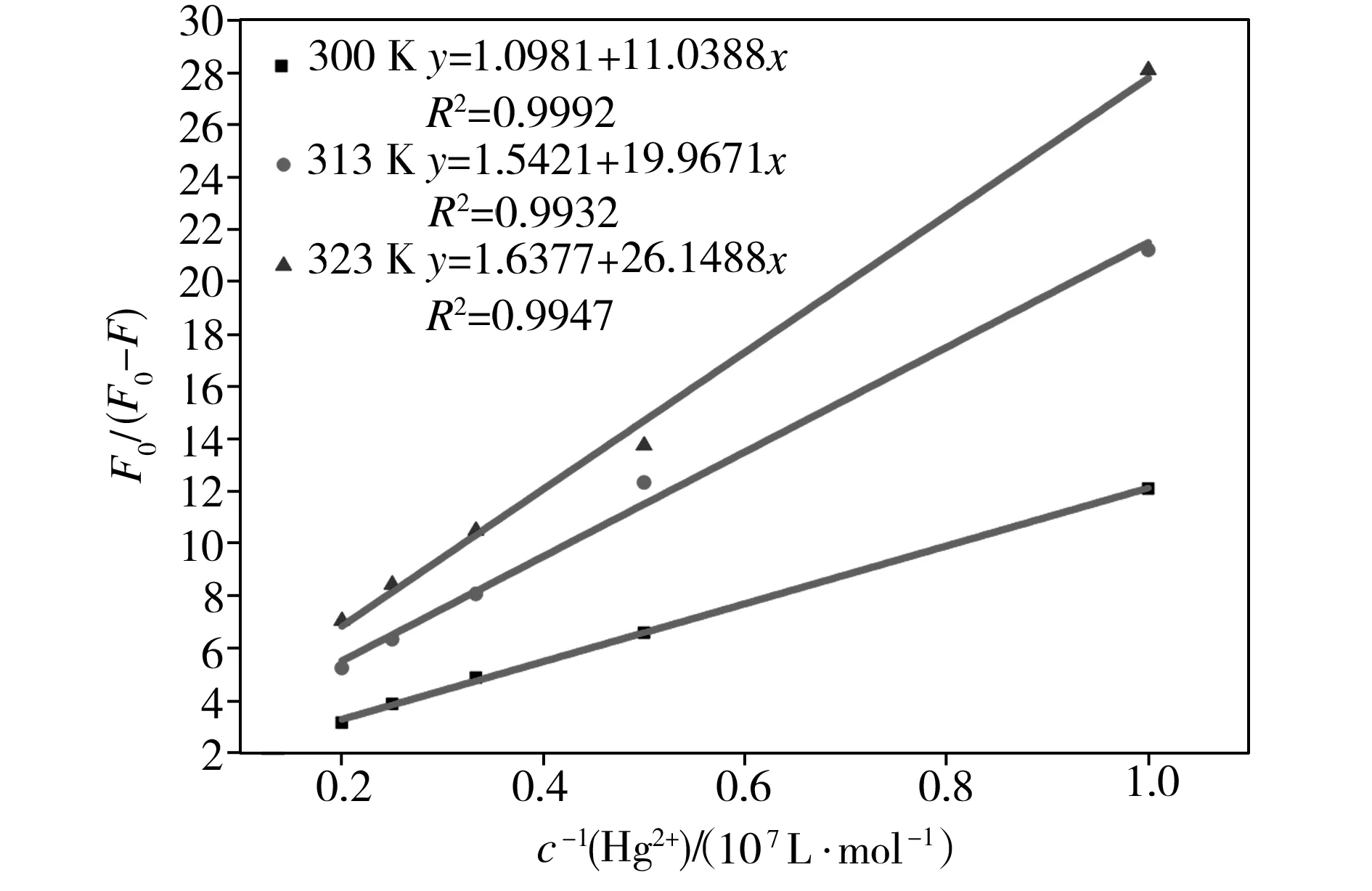
图8不同温度下Hg2+溶液对碳量子点的修正的Stern-Volmer猝灭曲线
Fig.8ModifiedStern-VolmerquenchingcurvesofHg2+solutiontocarbonquantumdotsatdifferenttemperatures
(3)
式中:K为碳量子点和Hg2+的结合常数,L/mol;n为它们之间的结合位点数。
以lg[(F0-F)/F]对lg[Q]作图来处理实验数据,lg[(F0-F)/F]与lg[Q]的关系曲线如图9所示。从图9中可以看出,随着温度的升高,碳量子点和Hg2+的结合常数K不断地减小,和前面分析的修正的Stern-Volmer猝灭常数Ka的变化趋势一致;碳量子点和Hg2+在不同温度下的结合位点数n均接近于1,表明碳量子点和Hg2+之间均只有一个结合位点。由公式(2)已推算得到,在300、313、323 K温度下,Hg2+对碳量子点的有效猝灭常数Ka分别为9.95×105、7.72×105、6.27×105L/mol,前文提到可以将Ka近似地认为是猝灭剂和受体体系中的表观结合常数;根据公式(3)推算可得,在300、313、323K温度下,碳量子点和Hg2+的结合常数K分别为8.166×105、2.139×105、0.975×105L/mol,比较结合常数K和表观结合常数Ka的值,两者均在105数量级附近,因此,可以推断碳量子点和Hg2+之间的反应结合常数为1.0×105L/mol,即二者此时的反应速度快且形成了稳定的化合物,表明碳量子点和Hg2+的荧光猝灭机理为静态猝灭。
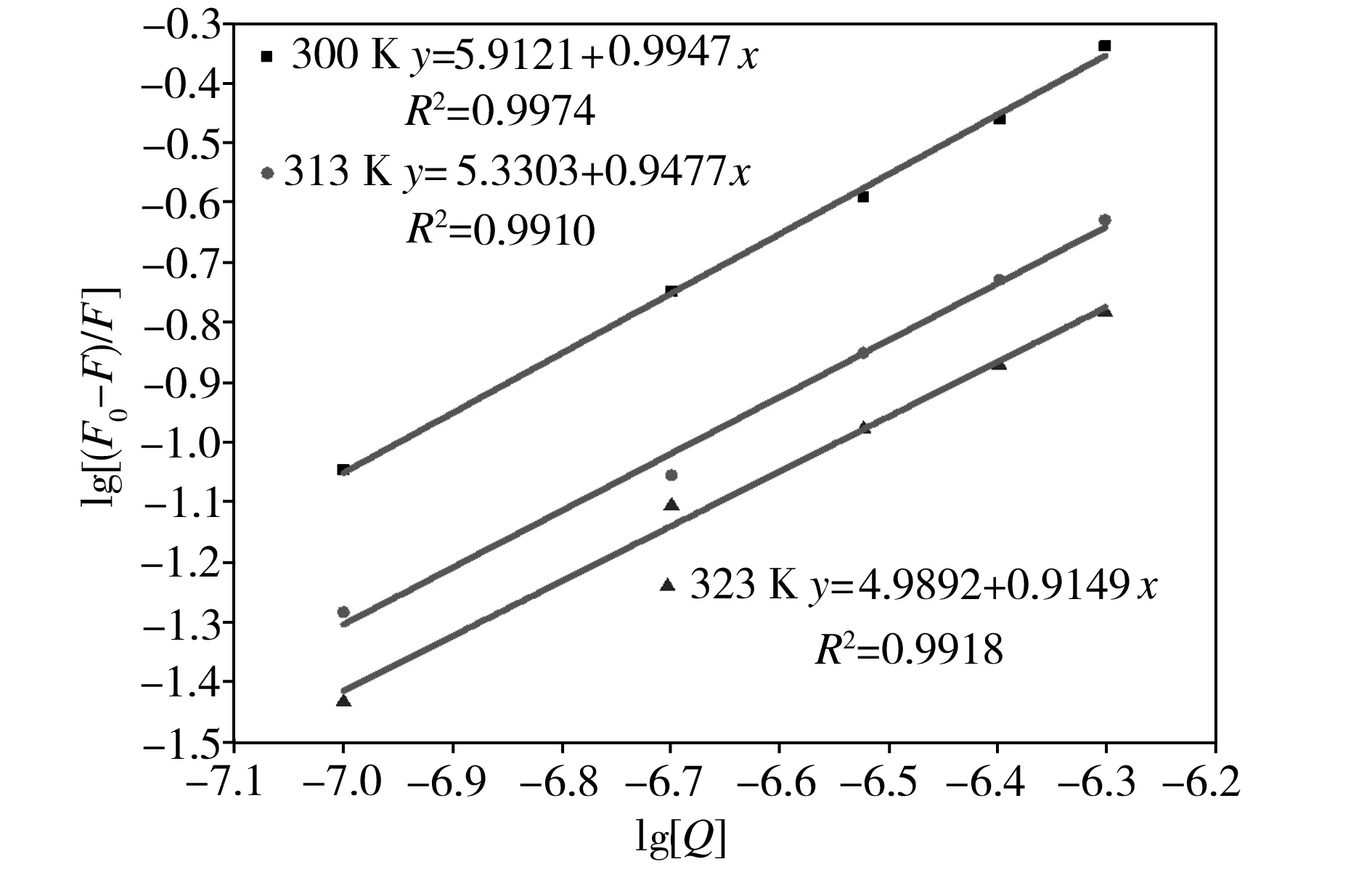
图9碳量子点和Hg2+相互作用时lg[(F0-F)/F]与lg[Q]的关系曲线
Fig.9Relationshipcurvesbetweenlg[(F0-F)/F]andlg[Q]intheinteractionofcarbonquantumdotsandHg2+
2.5 碳量子点荧光猝灭热力学分析
不同温度下碳量子点和Hg2+之间的反应结合常数K与反应的焓变、熵变的关系可用Van’t Hoff 方程[18]表示,即
(4)
式中:ΔH为反应的标准焓变,kJ/mol;ΔS为反应的标准熵变,J/(mol·K);R为气体常数;T为反应温度,K。
以lnK对1/T作图来处理实验数据,碳量子点与Hg2+作用的Van’t Hoff关系图如图10所示。从图10中可以看出,拟合后的曲线具有较好的直线关系,相关系数R2=0.9942。由直线的斜率(-ΔH/R)和截距(ΔS/R)值,可求得ΔH和ΔS,则不同温度下碳量子点和Hg2+之间的反应
自由能(ΔG)可表示为[18]:
ΔG=ΔH-TΔS
(5)
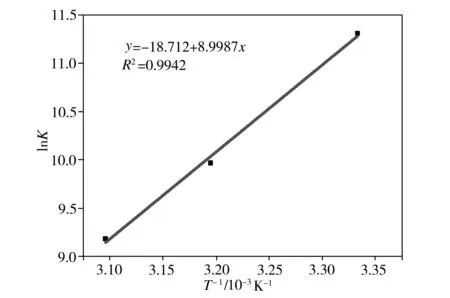
图10 碳量子点与Hg2+作用的Van’t Hoff关系图
Fig.10Van’tHoffdiagramofcarbonquantumdotsandHg2+
不同温度下碳量子点溶液与Hg2+相互作用的热力学参数如表1所示。从热力学的观点来看,任何化学、物理和生物的过程都伴随能量的改变和一系列热力学参数的变化,其中,自由能(ΔG)的变化可以用来判断反应的自发性;焓变(ΔH)被看作是结合过程中分子内的键能交换的结果;熵变(ΔS)则是反应体系自由度或混乱度变化的指标。从表1中可以看出,碳量子点和Hg2+结合过程的ΔG、ΔH、ΔS均小于零,ΔG<0,表明它们的作用过程是一个自发进行的过程;ΔH<0和ΔS<0 表明反应过程中体系能量降低,自由度减小,熵变的不利因素由焓变进行了补偿,推动了反应的发生,因此碳量子点和Hg2+结合过程是一种焓驱动过程。

表1 不同温度下碳量子点溶液与Hg2+相互作用的热力学参数
3 结论
(1)以焦粉为原料,采用一步水热法合成的碳量子点在用于Hg2+检测时具有较好的单一选择性。
(2)Hg2+对碳量子点的荧光有猝灭效应,用碳量子点荧光猝灭法检测Hg2+,方便快捷,灵敏度高,检测范围为1.0×10-8~1.0×10-7mol/L,检出限为1.0×10-8mol/L。
(3)Hg2+对碳量子点猝灭方式为静态猝灭,两者的相互作用是自发进行的焓驱动过程,相互结合位点约为1,反应结合常数为1.0×105L/mol。

