乙型肝炎病毒逆转录酶区多位点预存耐药变异研究*
余 兰,黄丽雯,龚 亮,杨 菁,彭云娟
(福建医科大学附属宁德市医院检验科,福建宁德 352100)
核苷(酸)类似物(NAs)是临床最常用的抗乙型肝炎病毒(HBV)药物,通过靶向抑制HBV逆转录酶的活性发挥抗病毒作用。HBV在复制过程中,由于其高复制率及逆转录酶校对功能的缺乏,具有高度的变异性。在宿主的选择压力下,可形成一个或几个优势突变株,即准种。长期应用NAs时,对药物压力适应性强的突变株成为优势群,从而对NAs产生耐药性,导致治疗失败。然而近期越来越多的研究表明,在未经NAs治疗的慢性乙型肝炎(CHB)患者中,就存在耐药位点突变,即预存耐药变异。预存耐药变异与NAs治疗中的原发无应答、应答不佳或部分病毒学应答密切相关[1-2],引起了临床的高度关注。本研究采用基因芯片法,对未经NAs治疗的CHB患者及慢性HBV携带者进行多位点耐药突变检测,并分析预存耐药变异与患者年龄、性别、谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乙型肝炎e抗原(HBeAg)、HBV-DNA载量之间的关系。旨在明确宁德地区HBV预存耐药变异情况,为临床制订个体化抗病毒治疗方案提供可靠依据。
1 资料与方法
1.1一般资料 选择本院2014-2015年收治的CHB患者及慢性HBV携带者401例为研究对象。其中男247例,女154例,平均年龄34.79岁。纳入标准:(1)HBV-DNA≥104IU/mL;(2)从未使用过NAs治疗或用药史不明确;(3)诊断均符合2015年中华医学会肝病学分会、感染病学分会修订的《慢性乙型肝炎防治指南》的诊断标准[3]。排除标准:(1)肝硬化及肝癌患者;(2)有严重基础疾病;(3)有遗传性或代谢性疾病史;(4)合并甲型肝炎病毒(HAV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)、戊型肝炎病毒(HEV)及人类免疫缺陷病毒(HIV)感染者。
1.2方法
1.2.1生化检测 采用罗氏cobas c501生化仪及罗氏诊断试剂检测患者ALT等生化指标。
1.2.2HBV血清标志物检测 采用CHEMCLIN1500全自动化学发光免疫分析仪,试剂购自博阳生物科技公司,检测血清HBsAg、HBsAb、HBeAg、HBeAb、HBcAb。
1.2.3HBV-DNA定量检测 运用实时荧光定量PCR技术进行检测,试剂盒购自达安基因股份有限公司,检测仪器为ABI StepOnePlus实时荧光定量PCR仪。
1.2.4HBV多位点耐药突变检测 采用珠海赛乐奇生物技术有限公司提供的HBV耐药突变位点检测试剂盒及基因芯片检测平台,运用基因芯片技术进行HBV多位点耐药突变检测。其检测原理为使用PCR技术扩增HBV的特定基因片段,再与芯片上特异性核酸探针杂交以检测特定的基因位点的突变,通过生物信号原位放大技术,使基因芯片杂交信号放大到肉眼判读的水平,检测逆转录酶区rt180、rt181、rt184、rt194、rt202、rt204、rt236、rt250等8个突变位点,涉及拉米夫定(LAM)、阿德福韦(ADV)、恩替卡韦(ETV)、替比夫定(LDT)、替诺福韦(TDF) 以及恩曲他滨(FTC)6种临床上常用的NAs。
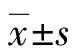
2 结 果
2.1耐药位点突变情况 本研究对逆转录酶区rtL180M、rtA181V/T、rtT184A/G、rtA194T、rtS202G、rtM204V/I、rtN236T、rtM250V 8个主要耐药位点检测,突变位点主要集中在rtN236T、rtM204I、rtL180M 3个位点,突变率分别为15.96%、6.98%、5.24%。rtM204I较rtM204V更为常见,rtN236T的突变率高于rtM204V/I。各位点突变情况见表1。

表1 耐药位点突变情况

表2 预存耐药变异模式
2.2预存耐药变异模式 401例患者中,检出预存耐药变异79例,耐药率为19.70%,其中单个位点突变48例,多个位点突变31例,前3位的突变模式为rtN236T、rtN236T+rtM204I+rtM204V、rtN236T+rtM204I,其突变率分别为9.98%、2.24%、1.25%。具体预存耐药变异模式见表2。
2.3常用药物的预存耐药变异情况 本研究针对6种临床上常用的抗病毒药物进行预存耐药变异研究,包括L-核苷(酸)类似物(LAM、LDT),无环核苷(酸)类似物(ADV、TDF),脱氧鸟苷类似物(ETV),胞嘧啶核苷类似物(FTC)等。预存耐药变异检出率从高到低分别为ADV(15.96%)、LAM(7.48%)、FTC(7.48%)、LDT(6.98%)、TDF(0.50%)、ETV(0.25%)。具体变异情况见表3。

表3 药物的预存耐药变异情况
2.4预存耐药变异与患者年龄、性别的关系 本研究共纳入患者401例,年龄2~81岁,年龄中位数为31岁。其中男247例,女154例,具体见表4、5。本研究中,年龄较小及较大组别突变率更高,女性突变率高于男性。对突变组和未突变组的年龄、性别进行χ2检验,差异均无统计学意义(P>0.05)。

表4 预存耐药变异与患者年龄的关系
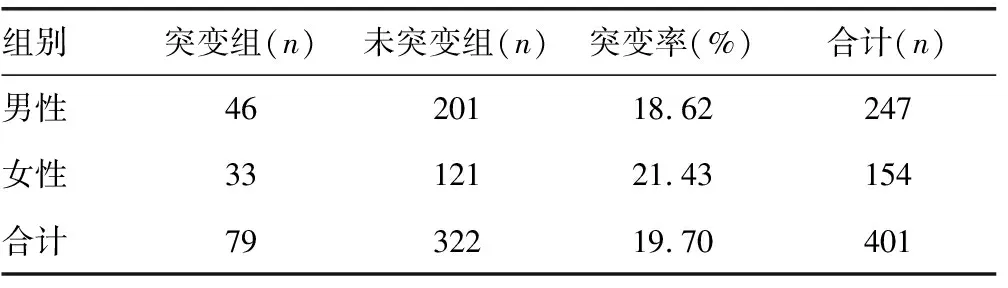
表5 预存耐药变异与患者性别的关系
2.5预存耐药变异与患者ALT、AST之间的关系 根据《慢性乙型肝炎防治指南(2015版)》[3]建议,以ALT、AST的正常上限(ULN)为参考,肝酶升高程度可分为<1 ULN、1~2 ULN、>2~10 ULN以及>10 ULN。对突变组和未突变组的肝酶升高情况进行χ2检验,ALT、AST差异均无统计学意义(P>0.05)。在>10 ULN组别中,耐药突变率较高,突变率随肝酶升高呈上升趋势。见表6、7和图1。

表6 预存耐药变异与患者ALT之间的关系
注:ULN=40 U/L
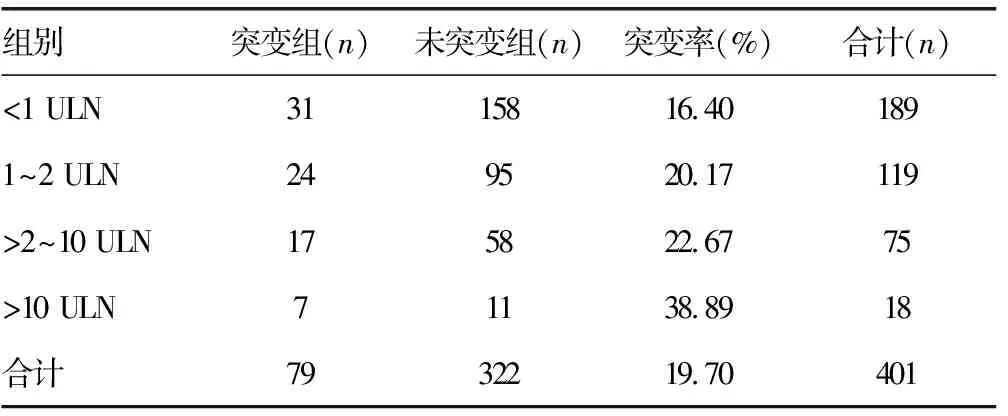
表7 预存耐药变异与患者AST之间的关系
注:ULN=35 U/L
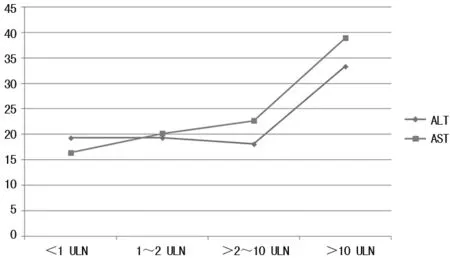
图1 预存耐药变异率与肝酶的关系
2.6预存耐药变异与患者HBeAg阳性率、HBV-DNA载量之间的关系 由于耐药检测试剂盒对HBV-DNA载量有最低限要求,故本研究中HBV-DNA的纳入标准为≥104IU/mL,以103为级差,将病毒载量分为低、中、高3个级别,病毒载量高的组别突变率较高,对耐药突变情况进行χ2检验,两组之间的差异无统计学意义(χ2=4.41,P>0.05)。见表8。
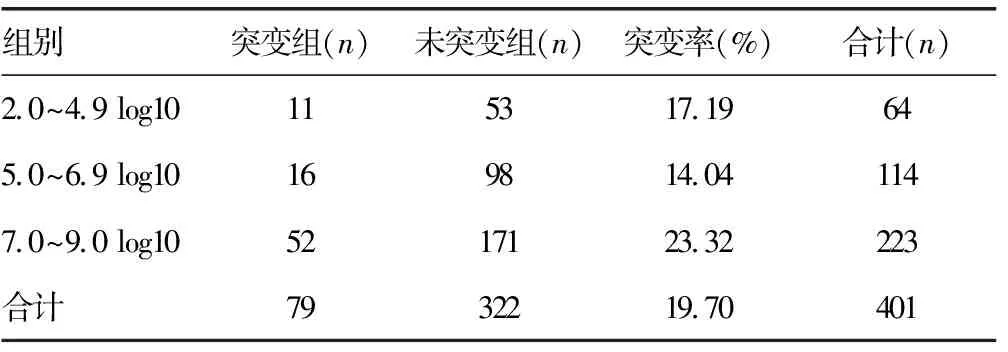
表8 预存耐药变异与HBV-DNA载量之间的关系
HBeAg阳性的患者其突变率高于阴性患者。但对突变组和未突变组HBeAg的表达情况进行χ2检验,两组之间在HBeAg表达情况上的差异无统计学意义(χ2=2.261,P>0.05)。见表9。
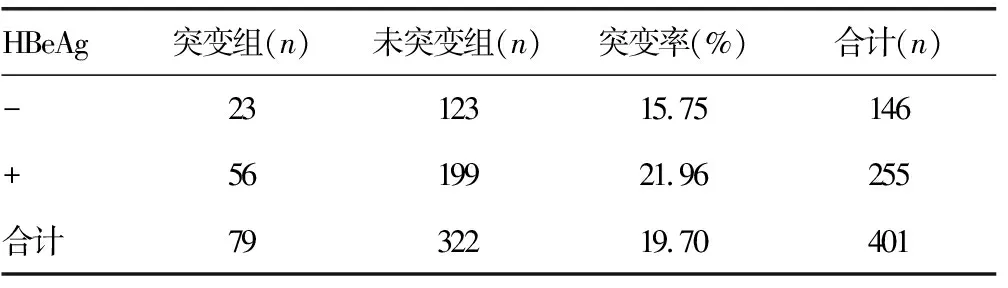
表9 预存耐药变异与患者HBeAg阳性率之间的关系
3 讨 论
大量研究表明,CHB患者在NAs治疗前就存在耐药位点突变,即预存耐药变异。该变异可能是引起抗病毒治疗原发性无应答、应答不佳或部分病毒学应答的主要原因之一。预存耐药变异产生的原因可能为以下两方面。(1)HBV慢性感染期间与宿主免疫应答相互作用的结果:HBV-DNA逆转录酶缺乏严格的校对功能,每天能产生1010~1011个新发的核酸替换,形成大量的突变株。在遗传变异、竞争及宿主的选择压力下,耐药突变被逐渐筛选出来成为优势株,或者仅存在于少量被感染的肝细胞中。受检测方法的敏感度所限,预存耐药变异的优势株易被检出,而非优势株可能被漏检,在临床上可表现为治疗前未检测到耐药突变,抗病毒治疗后原发无应答、应答不佳或迅速检测到耐药突变[4]。(2)HBV耐药株的水平或垂直传播,即患者可能最初直接感染了耐药株[5-6]。
本研究对未经NAs治疗的401例CHB患者及慢性HBV感染者进行耐药突变检测,共检出预存耐药变异79例,耐药率为19.70%,相关药物的预存耐药检出率从高到低分别为ADV、LAM、FTC、LDT、TDF、ETV。类似研究中,预存耐药变异多以LAM为主,ADV次之,其他药物少见[7-8]。本研究中各种药物均检出了相关的耐药位点预存变异,且ADV的预存耐药变异较LAM更为严重,高达15.96%,较LAM高出一倍,此种差异可能与检测方法、地域、用药习惯等有关,原因有待进一步研究。
HBV预存耐药的检出率可能与检测方法有关。盖洪鹏等[9]采用微测序技术,检出CHB患者的预存耐药率为17.19%,突变位点主要与 LAM、ADV 耐药相关。孙静怡等[10]用基因芯片法检测乙型肝炎相关性原发性肝癌术后患者的预存耐药情况,提示预存耐药检出率为19.12%,相关药物为LAM、LDT、ADV。饶友义等[2]、陈灿峰等[7]亦采用基因芯片法,预存耐药检出率分别为14.57%、15.57%,耐药药物为LAM、ADV。与基因芯片技术相比,以PCR扩增产物焦磷酸测序进行预存耐药变异的检出率较低,为4.92%~8.97%[11-12]。罗新月等[13]应用克隆测序法在60例CHB患者中检出33 例逆转录酶区基因变异,预存耐药检出率高达53.3%。提示预存耐药变异可能较文献报道的情况更为普遍。受检测方法的特异度与敏感度影响,预存耐药变异的检出率有较大差别,实验室应按照实际情况,选择合适的检测方法。本研究采用基因芯片法进行突变检测,检出率为19.70%,与其他相同检测方法的研究相比,检出率相近。笔者认为,基因芯片法操作简单,检测时间短,检出率较高,设备成本低,较适宜临床推广。
本研究突变位点主要集中在rtN236T、rtM204I、rtL180M,突变率分别为15.96%、6.98%和5.24%,rtM204I较rtM204V更为常见。与目前报道的预存耐药位点多位于rtM204V/I、rtL180M、rtN236T基本一致[10-13],但本研究中rtN236T的突变率较其他研究高。分析突变模式,单个位点突变48例,多个位点突变31例。前3位为rtN236T、rtN236T+rtM204I+rtM204V、rtN236T+rtM204I,其突变率分别为9.98%、2.24%及1.25%。与用药后的耐药突变相比,预存耐药的单个点突变发生率较高,复杂程度较低,但单位点突变与多位点突变的患者在年龄、性别等方面的差异无统计学意义(P>0.05),未统计病程长短方面的差异。有研究提示,伴随疾病进展和治疗的进行,突变的发生率及复杂程度明显上升[13]。
统计分析预存耐药突变可能的相关因素,提示预存耐药突变组与未突变组,在年龄、性别、ALT、AST、病毒载量、HBeAg等方面的差异均无统计学意义(P>0.05)。但提示年龄<20岁及>60岁,肝酶>10 ULN,病毒载量>107IU/mL、HBeAg阳性的患者,其预存耐药变异检出率较高。此类患者可能更需要谨慎用药,推荐抗病毒治疗前进行耐药基因突变检测。为明确预存耐药突变的影响因素,需加大样本量,细化分组,增加病程、病理分型等研究因素,进一步研究影响其相关因素和发生机制。
在临床治疗方面,除目前临床常用的LAM、ADV、LDT、TDF及ETV外,本文还对FTC进行了耐药位点突变检测。该药物为胞嘧啶核苷类似物,最早用于HIV感染的治疗。其耐药突变位点与LAM相同,即rtM204V/I±rtL180M变异,本研究中预存耐药检出率为7.48%,与LAM一致。自2006年起,FTC被用于CHB的抗病毒治疗,研究证实FTC联合TDF抑制HBV作用优于TDF单药制剂,并能够减少耐药发生[14]。其安全耐受性已获得广泛认可。目前推荐FTC与TDF联合,用于初治与经治HIV/HBV共感染者。在充分的知情同意后,可用于儿童CHB患者、妊娠期HBV感染母婴垂直传播阻断以及妊娠期HBV感染活动者的抗病毒治疗[15],为CHB的抗病毒治疗提供新的治疗选择[14,16]。
2016年更新的CHB NAs经治患者抗病毒治疗专家共识[17]中指出,高病毒载量的CHB患者采用ADV、LAM或LDT等单药治疗时HBV-DNA低于检测下限的比率较低,且耐药变异发生率较高,其中ADV治疗产生原发无应答的概率较大(10%~20%),ETV、TDF治疗发生原发无应答的概率较小。本研究中ADV、LAM、FTC、LDT的预存耐药变异率较高,其中ADV的突变率最高,为15.96%,TDF及ETV的预存耐药突变率仅为0.50%和0.25%,与指南中NAs原发无应答的概况相符,提示预存耐药变异与原发无应答高度相关。宁德地区应遵循指南进行临床诊疗,临床医师对预存耐药变异应充分重视。在条件允许的情况下,治疗前应进行耐药基因突变检测。若未进行耐药突变检测,宁德地区应慎用ADV等预存耐药变异率较高的药物。
宁德地区CHB患者及慢性HBV携带者的预存耐药变异率较高,以rtN236T突变最为常见,相关药物ADV应慎用。TDF、ETV的预存耐药变异检出率低,抗病毒治疗时可首选。抗病毒治疗前进行多位点耐药突变检测,对指导个体化用药具有重要的临床意义。

