表面活性剂对表面等离子体共振分析的影响
李 辉, 李桂澜, 董 志
(北京大学 生命科学公共仪器中心, 北京 100871)
表面等离子体共振(surface plasmon resonance,SPR)技术能够检测距离传感芯片表面约100 nm范围内分子结合和解离导致的折射率的变化,从而实时监测分子间的相互作用。为了研究分子之间的相互作用,让一种分子固定在芯片上,而另一种分子的溶液流过芯片表面,如果有相互作用,则芯片表面附近的质量变化导致表面等离子体共振响应值的变化,从而分析出两种物质相互作用的快慢和强弱[1]。
利用表面等离子体共振技术分析分子之间相互作用的过程中,通常会在运行缓冲液中添加非离子型表面活性剂,以尽量减少蛋白质和其他生物分子在流动系统包括芯片表面以及液体流经的管路中发生沉淀及吸附的可能。有文献报道在特定的条件下,接近临界胶束浓度的表面活性剂有助于保持蛋白的二级结构[2],各种方法被用于研究表面活性剂防止蛋白沉淀或团聚的机理[3-5],但是不同的蛋白与表面活性剂的作用方式不同,表面活性剂防止蛋白沉淀或团聚的机理也并不明确[6]。
表面活性剂是指加入少量能使溶液体系的界面状态发生明显变化的物质。表面活性剂的分子结构具有两亲性:一端为亲水基团,另一端为疏水基团。根据表面活性剂在水溶液中是否电离,可以把表面活性剂分为离子型表面活性剂(包括阳离子表面活性剂与阴离子表面活性剂)、非离子型表面活性剂、两性表面活性剂、复配表面活性剂、其他表面活性剂等。非离子型表面活性剂的亲水基团主要由一定数量的含氧基团(一般为醚基和羟基) 构成,在水溶液中不电离因此稳定性高,不易受强电解质无机盐类存在的影响,也不易受pH值的影响,比较适合应用于生物反应体系。
商业化的表面等离子体共振分析仪配套的运行缓冲液中添加的表面活性剂为聚山梨醇20(polysorbate20,P20)。对于P20的性质以及添加P20对于分子间相互作用实验结果有何种影响并没有相关的文献报道。本文利用等温滴定量热仪对P20的性质进行研究。
1 仪器与试剂
表面等离子体共振分析仪BIACORE T200、CM5芯片、N-乙基-N′-(3-二氨基丙基)碳二亚胺(EDC)溶液、0.1mol/L N-羟基琥珀酰亚胺(NHS)溶液、10×PBS缓冲液(27 mmol/L KCl,1.37 mol/L NaCl)以及surfactant P20均购自美国通用电气公司。等温滴定量热仪ITC200购自英国马尔文仪器有限公司。蛋白(分子量70 ku)及与之相互作用的多肽(1 ku)为用户提供。
2 实验方法
2.1 临界胶束浓度的确定
配置含有不同浓度表面活性剂P20的1×PBS-P缓冲液,用其滴定1×PBS缓冲液,滴定速率为0.5 μL/s,间隔120 s,转速为1 000 r/min,滴定温度为25℃。数据分析采用MicroCal ORIGIN 软件。
2.2 配体在芯片表面的固定
配体在芯片表面的固定采用氨基偶联的方式[7]。将芯片装入仪器中,以10 μL/min的流速通入0.4 mol/L N-乙基-N′-(3-二氨基丙基)碳二亚胺(EDC)溶液和0.1 mol/L N-羟基琥珀酰亚胺(NHS)溶液的混合溶液(体积比为1∶1),活化芯片表面(1通道及2通道)7 min。芯片表面活化后,将配体(蛋白)用10 mmol/L醋酸缓冲液(pH4.5)稀释至20 μg/mL,以10 μL/min的流速注入芯片表面2通道中,达到所需的固定量后,将1 mol/L乙醇胺以10 μL/min的流速注入芯片表面(1通道及2通道)7 min,灭活剩余的酯键。所有反应均在25 ℃的条件下进行。
2.3 分子间相互作用分析
将含有0.05%的P20的1×PBS-P缓冲液作为运行缓冲液,并将分析物(多肽)用1×PBS-P稀释成不同浓度后通入芯片表面。利用不含P20的1×PBS缓冲液重复上述试验。数据记录及分析所用软件分别为Biacore T200 Control software 以及Biacore T200 Evaluation software。
3 结果与讨论
3.1 表面活性剂P20临界胶束浓度的测定
等温滴定量热(isothermal titration calorimetry, ITC)技术是近年来发展起来的一种研究生物热力学的重要方法。利用高灵敏度、高自动化的微量热仪连续监测和记录微量分析物溶液滴加至一定体积的配体溶液中产生的热量变化,同时提供结合平衡常数(KA)、化学计量比(n)、焓变(ΔH)和熵变(ΔS)等多方面的信息。研究表面活性剂分子的性质、团聚的热动力学参数、临界胶束浓度等是等温滴定量热技术的一个重要的应用领域[8-11]。研究[11]表明,利用等温滴定量热仪测量离子型表面活性剂十二烷基硫酸钠(SDS)的临界胶束浓度得到的滴定曲线为“S”型曲线,每次滴加SDS溶液产生的焓变ΔdilH,以及滴加过程完成后的浓度SDS的关系可以用式(1)进行描述[11],式中a1—a5为拟合参数。滴定曲线的拐点对应的浓度即为临界胶束浓度。
(1)
本文利用等温滴定量热仪对P20的性质进行分析,结果见图1(Q为热量,负号表示放热)。
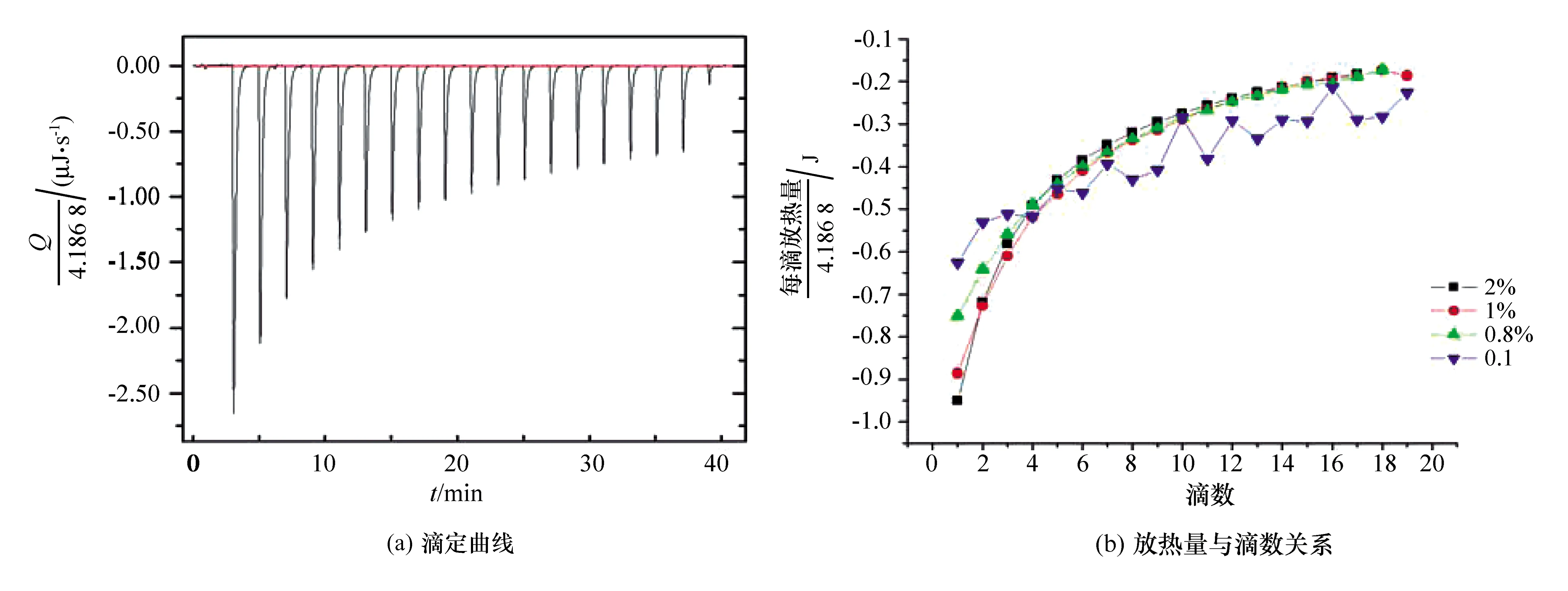
图1 利用含有2% P20的PBS缓冲液滴定不含有P20的PBS缓冲液所得的滴定曲线和不同浓度P20的PBS缓冲液滴定不含有P20的PBS缓冲液的放热量与滴数之间的关系
结果表明,P20在25 ℃的条件下在PBS缓冲液中的稀释过程为放热过程,与上述文献中报道的SDS的滴定曲线不同,并非典型的“S”型曲线,而是与胆汁盐类表面活性剂的滴定曲线[8]较为类似,滴定产生的焓变并没有出现跳跃性突变并导致滴定曲线出现明显的拐点,因此不能准确地测定临界胶束浓度。由此可以推断P20作为一种非离子型表面活性剂,即使在很高的浓度下依然可以均匀分布在缓冲液中,不发生明显的聚集或是形成大的胶束。
从P20的分子结构(图2)看,P20含有20个氧乙烯单元,但是这20个氧乙烯单元在分子不同侧链上的分布数目并不固定,因此P20可以看作多种分子的混合物,可能没有确定的临界胶束浓度。
3.2 添加表面活性剂P20对表面等离子体共振分析的影响
正常情况下,利用表面等离子体共振技术进行分子间相互作用分析实验得到的传感曲线对应分子结合过程的部分应为指数上升曲线,解离部分应为指数下降曲线[12]。
图3(a)为利用1×PBS作为运行缓冲液进行实验得到的传感曲线(2通道响应值扣减1通道响应值),不同颜色表示不同浓度。从图中可以看出,传感曲线形状并非正常的指数上升曲线。在0 s注入样品后,曲线迅速上升至大约9后呈现下降的趋势,然后又逐渐上升,形状为“凹”线。图3(b)为利用1×PBS-P作为运行缓冲液进行实验得到的传感曲线(2通道响应值扣减1通道响应值)。0 s注入样品后传感曲线为比较正常的指数上升曲线。由图3结果可以看出,运行缓冲液中不添加表面活性剂P20无法得到正常的传感曲线。

图2 聚山梨醇20的分子结构

图3 利用PBS和PBS-P作为运行缓冲液所得传感曲线
为了进一步分析不添加表面活性剂P20无法得到正常的传感曲线的原因,对图3中两组传感曲线的参比通道(1通道)以及反应通道(2通道)信号进行了对比分析。
在参比表面由于没有固定配体,不发生结合反应,因此通入样品后得到的相对响应值来源于样品与运行缓冲液之间的折射率差异以及非特异吸附。在无法得到正常的传感曲线时,通常需要对参比通道的信号进行分析,以便得到样品的浓度、非特异吸附等方面的信息。图 4(a)为将25 mmol/L样品通入芯片表面进行测试,在参比通道(1通道)得到的传感曲线。从图中可以看出,在样品及运行缓冲液中没有添加表面活性剂P20的情况下,通入样品产生的相对响应值(绿线)大约为110。添加P20后通入样品后产生的相对响应值(红线)为280。添加P20后1通道的相对响应值显著增加。可能的原因:不添加表面活性剂P20,样品在管路中的非特异吸附量增加,导致流过芯片表面的样品的实际浓度低于配制的浓度,因此流过芯片表面的样品与运行缓冲液的折射率差值减少。
将图4(a)两条传感曲线按照结合点对齐的方式对y轴进行调整后得到图4(b)图。从图4(b)中可以看出,在样品及运行缓冲液中没有添加表面活性剂P20的情况下,通入样品后,参比通道的传感曲线(绿线)有一个持续缓慢上升的过程。添加P20后,参比通道的传感曲线(红线)在注入点之后迅速达到最高点后并保持一定高度,无明显上升趋势。产生这种差异的原因可能是:(1)不添加表面活性剂P20,样品中的分子持续不断地吸附在芯片的表面的参比通道上,从而产生缓慢上升的信号;(2)不添加表面活性剂P20,样品在管壁上的非特异吸附造成样品不均一,首先接触芯片表面的样品浓度低于后来接触芯片表面的样品浓度,随着时间的推移,样品中的浓度逐渐增加至配制浓度;而添加表面活性剂P20之后,样品在管道中以及芯片表面的非特异吸附都有所减少,样品均一度提高。
图5(a)为通入25 mmol/L样品进行测试,在反应通道(2通道)得到的传感曲线。从图中可以看出,在样品及运行缓冲液中不添加表面活性剂P20的情况下,通入样品产生的相对响应值(绿线)大约为110。在样品及运行缓冲液中添加表面活性剂P20的情况下,通入样品后产生的相对响应值为350,添加表面活性剂P20提高了2通道的相对响应值,与1通道情况类似。与1通道不同的是,不添加表面活性剂P20,反应通道的传感曲线在注入点之后迅速达到最高点后并保持一定高度,无明显上升趋势。添加表面活性剂P20,反应通道的传感曲线在注入点之后达到最高点后有一个持续上升的过程。

图4 通入25 mmol/L样品进行测试,在参比通道(1通道)得到的传感曲线(绿线对应的运行缓冲液为PBS,红线对应的运行缓冲液为PBS-P和将(a)图按照结合点对齐的方式对y轴进行调整后所得传感曲线(1通道)

图5 通入25 mmol/L样品进行测试,在反应通道(2通道)得到的传感曲线(绿线对应的运行缓冲液为PBS,红线对应的运行缓冲液为PBS-P)和按照结合点对齐的方式对y轴进行调整后所得传感曲线(2通道)
图5(b)为按照结合点对齐方式对y轴进行调整后所得传感曲线,红线扣减图4(a)红线为利用PBS-P进行实验得到的最终传感曲线,为正常的指数上升曲线。图5(b)绿线扣减图4(b)图绿线为利用PBS进行实验得到的最终传感曲线,为“凹线”。由此可以看出,添加P20减少了非特异性吸附,增强了特异性吸附,使得传感曲线由“凹线”变为正常的指数上升曲线。
4 结语
在运行缓冲液及样品中添加表面活性剂P20,可以减少样品在流通系统中的非特异吸附,防止待测样品的实际浓度低于配制浓度,提高特异性结合水平。在一些应用中,特别是那些涉及脂类囊泡和疏水性蛋白的应用中,缓冲液中不使用表面活性剂[1],可能是为了避免表面活性剂与脂类囊泡和疏水性蛋白的相互作。在这类实验中如何避免样品在流通系统及芯片表面的非特异吸附需要进一步的研究。

